无论是成骨细胞还是破骨细胞,都是由骨髓细胞分化而来,因而可利用骨髓细胞,加入诱导剂并在合适的基质上培养,使其向成骨细胞显型转化,从而培养出成骨细胞。这种方法培养出的细胞具有成骨细胞的大部分表型。
胎儿颅骨是分离成骨细胞及破骨细胞的理想材料。分化的成骨细胞一般位于骨组织中,有坚固的骨组织作为保护屏障,需要相对较长时间才能分离出。胎儿时期,由于骨组织尚未发育完全,骨组织较软,易操作,是分离成骨细胞及破骨细胞的理想时期。通常取胎儿的颅盖骨或四肢长骨,剔除筋膜及血液、骨髓等,将组织块剪碎,冲洗后放入培养皿置培养箱中贴壁培养,约1周后可见有细胞长出。胎儿骨可直接用胶原酶消化。消化常采用两步法。第一步消化游离出的细胞大多为成纤维细胞及破骨细胞;第二步消化时间长,游离出的大多为成骨细胞。选择第二步消化后的细胞悬液进行成骨细胞培养,贴壁速度比成纤维细胞慢,可通过反复转皿来去除成纤维细胞。
由于胎儿本身的发育不完全,其成骨细胞的功能还不完善。例如,人胎成骨细胞表面就不表达上皮生长因子(EGF)受体。一般取成人的髂骨、下颌骨、股骨颈等部位的骨松质,采用髂骨组织块培养法,所获得的成骨细胞纯度高,活性好。将骨松质剪碎成2~5mm3大小,PBS猛烈振摇洗涤后,Ⅱ型胶原酶消化至骨质完全变白呈蜂窝状,再将消化的骨组织贴壁培养,大约20天后细胞可满底。
成骨细胞的鉴定包括形态观察、ALP染色及活性测定、PAS染色、Ⅰ型胶原染色和骨钙素测定。
一、形态观察与增殖率
在相差显微镜下,成骨细胞主要呈上皮样,胞核大而清晰,圆形或卵圆形,含1~2个核仁,并伸出多个突起与周围细胞相连。细胞满底后,原代培养的细胞有规律排列,可呈同心圆样向周围放射性生长。成骨细胞胞质含丰富的基质前体成分,应用过碘酸-Shiff法细胞化学染色,呈红色阳性反应。成骨细胞能分泌大量的Ⅰ型胶原,形成骨基质。在成骨细胞培养过程中,细胞聚集在一起形成结节,并在结节及周围分泌大量Ⅰ型胶原。用von Gieson苦味酸酸性复红染色,可显示在结节周围产生的大量胶原(呈红色)。
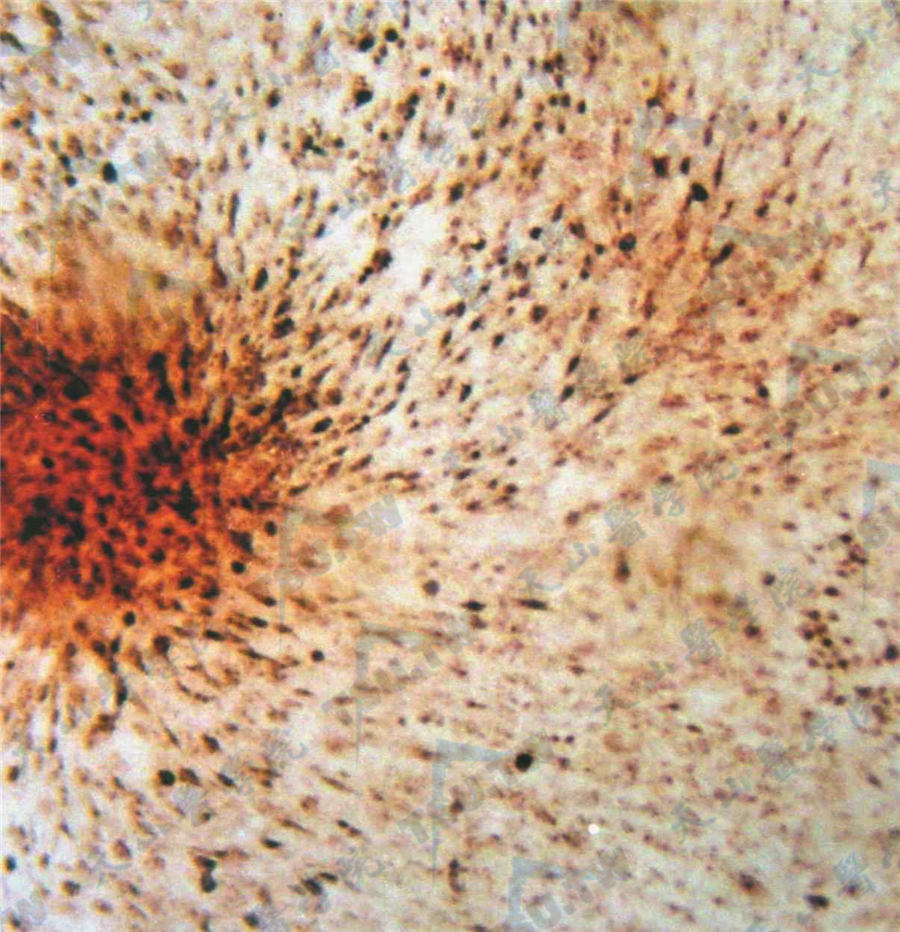
培养的成骨细胞胶原染色
注:培养的成骨细胞聚集形成结节,von Gieson苦味酸酸性复红染色,示结节周围有大量胶原(深红色处)
成骨的强弱与成骨细胞的数目密切相关,采用3H-TDR掺入法、MTT法或考马斯亮蓝染色法均可测得细胞增殖率,3H-TDR法经典但常有放射性污染;MTT法简便、快速、安全,但其误差较大。
二、ALP活性
成骨细胞含有丰富的碱性磷酸酶,是成纤维细胞的5~20倍。它一方面可水解有机磷酸释放出无机磷而用于羟磷灰石的形成。另一方面可分解钙盐沉着的抑制剂——焦磷酸盐而有利于成骨,成骨功能活跃时,其ALP含量增高。成骨细胞含有丰富的骨特异性ALP(BSALP),用Gomori钙钴法对培养细胞染色,既可对培养细胞作出鉴定,又可得出培养细胞纯度。也可收集细胞,测细胞裂解液中BS-ALP活性,根据BS-ALP活性的高低鉴定细胞的纯度。
三、矿化结节的计数
经β磷酸甘油诱导,成骨细胞在培养过程中可形成矿化结节,经von Kossa染色后,矿化结节呈棕黑色。在40倍光镜下计数,以>200μm为标准。矿化结节形成代表了成骨细胞分化成熟、行使成骨功能的阶段,是成骨功能的形态表现。
四、护骨素(osteoprotegerin,OPG)
由成骨细胞表达,有学者认为它在调控破骨细胞的发生发展过程中起核心作用,其他的骨吸收调节因子可能部分或全部通过调节OPG的生成而发挥作用。雌激素、1,25-(OH)2D、BMP-2及许多与骨代谢相关因子如IL-6、IL-1、BGP、ALP、TNF等均可使其基因表达发生改变。
骨质疏松和动脉硬化都是老年人的退行性变疾病,但是近年的研究发现,两者不单是并发症,二是存在一定的病因联系。OPG/receptor activator of nuclear factor-κB(RANK)/ RANK ligand(RANKL)系统是动脉钙化的介导物质,而OPG是血管钙化的调节因子。另一方面,脂连素(adiponectin)基因敲除鼠发生动脉钙化,脂连素是动脉钙化的一种保护因素。
五、1,25-(OH)2D刺激的骨钙素测定
骨钙素(osteocalcin,OC)由成骨细胞产生,为成骨细胞分化成熟的指标,反映成骨细胞的成骨功能,成骨细胞膜上及细胞内均有维生素D受体,测定1,25-(OH)2D刺激后成骨细胞分泌骨钙素的变化,可特异性地鉴定成骨细胞。可采用放射或酶联免疫法、RT-PCR或Northern杂交测定。体外培养的胎儿/鼠细胞及细胞株分泌骨钙素较少,用骨钙素放射免疫法难以测出,因而在药物干预前可用1,25-(OH)2D对细胞进行预处理。
