目前,用于人类胚胎冷冻的方法可分为两大类:快速冷冻法(rapid cooling)和慢速冷冻法(slow cooling)。
快速冷冻法
快速冷冻法与缓慢冷冻法的最大不同在于:快速冷冻法不是依赖冰结晶形成速度与细胞脱水速度之间的平衡来防止细胞内冰结晶的形成,而是依赖高浓度的冷冻保护剂和添加剂,使细胞快速脱水,以避免冰结晶的形成,并将冷冻胚胎直接放入液氮中迅速降温冷冻。
快速冷冻法又可大体上分为两种,一种称为玻璃化冷冻(Vitrification),一种称为快速冷冻或超速冷冻。玻璃化冷冻是指冷冻保护剂的浓度等于或高于40%(v/v)。在冷冻或解冻过程中溶液里出现冰结晶则称之为快速冷冻,而不能称为玻璃化冷冻。
下面详细介绍玻璃化冷冻方法:
与常规的慢速冷冻相比,玻璃化冷冻的最大优势在于其降温速度快(500~20 000℃/min),在冷冻过程中组织和细胞能够非常快速地通过+15°C至-5°C这一危险的温度区间,从而有效地避免急速降温(chilling injury)对细胞造成的损害,防止冷冻过程中细胞内冰结晶的形成。同时,玻璃化冷冻过程耗时较短,不需要昂贵的降温设备,因而近年来得到越来越多的关注。虽然慢速程序冷冻仍然是一些胚胎实验室的首选,但是随着近年来冷冻技术的发展和人们对发育生物学理解的不断加深,玻璃化冷冻在人类辅助生殖领域得到了越来越广泛的应用。从目前已有的资料来看,玻璃化冷冻大有取代传统慢速冷冻的趋势,特别是对于一些难以保存的组织和细胞,例如卵母细胞、干细胞以及卵巢组织等,玻璃化冷冻更是具有慢速程序冷冻难以比拟的优势。
虽然水的凝固点是0℃,但是要成功地将一小滴水进行玻璃化需要高达每秒300万度的降温速度,很显然这在实际应用中是不可能的。高浓度的冷冻保护剂(5~8mol/L)有效地降低了成功进行玻璃化冷冻所需要的降温速度,从而为玻璃化冷冻的实施提供了可能性。同时,最小量的冷冻保护液以及玻璃化冷冻液与液氮直接接触,将降温速度进一步最大化。但是,高浓度的冷冻保护剂所对于细胞可能带来的影响也引起人们的关注,在操作实践中,多采用逐步添加冷冻保护剂的方法来降低细胞毒性和渗透应激(osmotic stress)。为了达到成功的玻璃化冷冻所需要的降温速度,目前所用的载体多为开放系统,封闭系统虽有成功的报道,但是考虑到其可能降低降温速度,应用尚不如开放系统广泛。由于降温和复温速度都非常快,对操作者的经验和能力要求也相对较高。
虽然大多数玻璃化冷冻方法相差不大,但迄今为止还没有一种大家一致公认有效的玻璃化冷冻方案,各个实验室所采用的玻璃化冷冻载体也不一样,目前较常用的商品化玻璃化冷冻载体主要有冷冻载杆(Cryotop),Cryotip,Cryoloop和Cryoleaf等,其他的载体还有自制的OPS(Open pulled straw),电子显微镜铜网等。由于所用的玻璃化冷冻方案和载体不尽相同,目前很难对各家的冷冻结果做一个客观的评价。本节以Cryotop为例介绍人类卵母细胞和胚胎的玻璃化冷冻。Cryotop是一种开放式玻璃化冷冻载体,也是一种新的Minimum Volume Vitrification,他利用一个宽0.4mm、长20mm、厚0.1mm的塑料载片连接到硬塑胶把手上,此外还有一个3cm长的塑胶盖片。

Crytop
人卵母细胞的玻璃化冷冻
卵母细胞特殊的生物物理特性决定了其冷冻保存较受精卵和分裂期胚胎要困难得多。首先,卵母细胞是人体最大的单细胞,其过小的表面积与体积比影响了冷冻过程中冷冻保护剂和水通过卵母细胞膜的速度,因而更加容易导致细胞内冰结晶的形成;其次,成熟卵母细胞第二次减数分裂中期的纺锤体对急剧冷却(chilling)非常敏感;第三,卵母细胞膜对水和冷冻保护剂的通透性较受精卵和分裂期胚胎要低;此外,冷冻过程还有可能诱发卵母细胞的孤雌生殖和透明带的变硬。
一、冷冻前的准备工作
(1)冷冻保护液的准备:玻璃化冷冻液可自行配制或者直接从厂家购买成品。
(2)人卵母细胞玻璃化冷冻液的配制
- 基本操作液(basic solution,BS):Modified HTF(mHTF)+20%(v/v)血清蛋白替代物(serum protein substitute,SPS)。
- 预平衡液(equilibration solution,ES):以BS为基础液配制7.5%(v/v)二甲基亚砜(dimethyl sulfoxide,DMSO)+7.5%(v/v)乙二醇(ethylene glycol,EG)。
- 玻璃化冷冻液(vitrification solution,VS):以BS为基础液配制15%(v/v)DMSO+15%(v/v)EG+0.5M蔗糖(sucrose)。
(3)冷冻保存载体的标记:在Cryotop上清液楚地标记患者的姓名,冷冻日期,冷冻管的编号以及待冷冻卵母细胞的数目;
(4)在玻璃化冷冻开始前至少30min从冰箱中取出玻璃化冷冻试剂盒,并使其在室温(20~25°C)中平衡待用;
(5)准备一个塑料或者玻璃内壁的液氮容器,加入足够的液氮以便能够完全覆盖Cryotop;
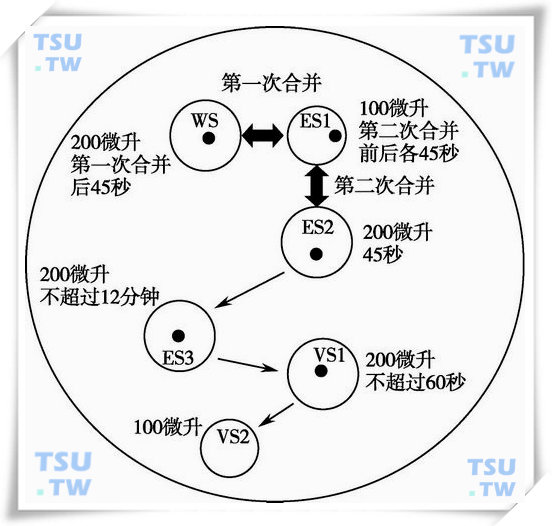
(6)按照图示在Falcon 3003大皿上准备一个200μl大小的BS液滴,靠近其右侧准备一个100μl大小的ES1,然后依次准备200μl大小的平衡冷冻液滴ES2及ES3。
二、预平衡
- 第一次液滴合并:将需要冷冻的卵母细胞转移到BS液滴的中央并停留片刻,然后用移卵针将BS 与ES1合并(BS+ES1,第一次液滴合并),合并后的液滴自行融合,在融合过程中可以观察到含有高浓度DMSO和EG的ES1会将卵母细胞从BS液滴的中央推向左侧;
- 在第一次液滴合并后45s将卵母细胞从BS液滴的左侧转移到ES1的右侧并停留45s;在将卵母细胞从培养皿转移到BS的过程中,移卵针上往往会携带少量的矿物油。为避免矿物油对冷冻过程造成的不良影响,建议从这一步开始换用一支新的移卵针;
- 第二次液滴合并:合并ES1和ES2并让BS,ES1及ES2自行融合(BS+ES1+ES2,第二次液滴合并),第二次合并后卵母细胞继续停留在ES1右侧45s;
- 第二次合并完成后将卵母细胞转移到ES2的底部并停留45s;
- 将卵母细胞转移到ES3液滴的中央继续平衡,卵母细胞在ES3中的停留时间不超过12min;
- 预平衡过程中卵母细胞形态变化及观察:在预平衡的初始阶段,卵母细胞外的高渗ES溶液引起卵母细胞脱水,卵膜出现皱缩现象,随着冷冻保护剂渗透入卵母细胞内皱缩逐步停止,卵母细胞再次膨胀;
- 一旦卵母细胞恢复到预平衡前大小,则表明卵母细胞脱水和冷冻保护剂渗入细胞之间达到动态平衡,平衡过程已经完成,此时卵母细胞可以转移到玻璃化冷冻液中进行下一步的操作。如果同时平衡多个卵母细胞,可以根据其平衡完成的时间对它们进行重新分组,先完成平衡的卵母细胞率先被转移到玻璃化冷冻液中。
三、玻璃化冷冻
- 在等待卵母细胞预平衡的过程中,准备一个200μl大小的玻璃化冷冻液滴VS1及100μl大小的玻璃化冷冻液滴VS2;
- 待预平衡完成后,用移卵针从ES3中吸取卵母细胞及少量的ES3直到卵母细胞到达距离移卵针针尖端约1~2mm处,吸取少量的VS1并将其与ES3混匀,混合过程中注意始终将卵母细胞保持在移卵针内;
- 吐出部分混合液后吸取新鲜的VS1并与移卵针内的残余液体重新混匀,不断改变移卵针在VS1中的位置,多次来回的反复吸入和吐出直至混合过程中产生的液体旋涡完全消失,然后将卵母细胞释放到VS1中远离可能混有ES的区域。吸取新鲜的VS1并将其吹到VS1液滴外以去除残存在吸卵针内的ES,用移卵针反复拨动卵母细胞至新鲜的VS1,此过程约持续30s;
- 将卵母细胞转移到VS2中,在转移过程中注意尽量减少吸入的VS1的量,拨动卵母细胞至新的位置两次以保持其周围新鲜的VS2,吸起卵母细胞并将其放置于离Cryotop末端黑色标记数毫米的塑料载片表面,尽可能多地回吸卵母细胞周围的玻璃化冷冻液VS2,并确保包括卵母细胞在内的液滴的总体积不超过0.1μl,此过程应控制在60s以内;
- 将装载有卵母细胞的Cryotop从侧面倾斜投入到液氮容器中,特别要注意将从卵母细胞开始接触玻璃化冷冻液到投入液氮的总时间控制在60~90s以内;
- 在液氮液面以下用镊子将Cryotop塑料载片扣在塑料盖片上并扭紧,然后将其装载到金属支架中投入液氮罐中保存。
人卵母细胞的预平衡和玻璃化冷冻过程示意图
从原核到囊胚阶段人胚胎的玻璃化冷冻
与成熟卵母细胞相比,人类早期胚胎的玻璃化冷冻相对要简单一些,受精卵和分裂期胚胎的细胞膜对冷冻保护剂和水的通透性以及冷冻解冻过程中细胞外渗透压变化的适应能力都较卵母细胞要强。下面的方案可用于从原核到囊胚阶段人胚胎的玻璃化冷冻。值得注意的是,在进行囊胚的玻璃化冷冻前需要使用激光或者机械法对囊胚腔进行人工脱水。
1.冷冻前准备
(1)冷冻保护液的准备:人胚胎玻璃化冷冻液的配制
- 预平衡液ES:以BS为基础液配制7.5%(v/v)DMSO+7.5%(v/v)EG
- 玻璃化冷冻液VS:以BS为基础液配制15%(v/v)DMSO+15%(v/v)EG+0.5MSucrose
(2)在玻璃化冷冻开始前至少30min从冰箱中取出玻璃化冷冻试剂盒,室温下平衡待用;
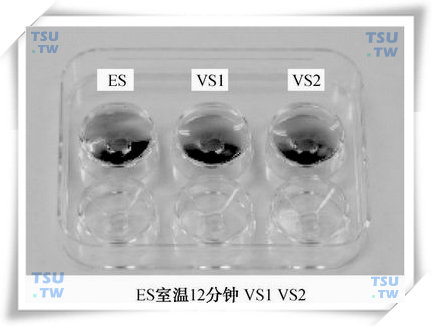
(3)冷冻保存载体的标记:在Cryotop上标记患者的姓名、冷冻日期、冷冻管的编号、待冷冻胚胎的发育阶段和数目;
(4)如下图所示,在六孔皿中依次加入0.5ml的ES,VS1及VS2;
人类胚胎的玻璃化冷冻
2.预平衡
- 从培养皿中吸取待冷冻的胚胎并将其释放到ES中央的液面上,在转移胚胎过程中要尽量减少随胚胎吸取的ES量,一般0.5min内胚胎就会自然下沉。
- 密切观察平衡过程中胚胎形态的变化,一旦皱缩的胚胎卵裂球恢复到预平衡前的大小,提示平衡过程已经完成。胚胎在ES中完成平衡所需要的时间长短取决于其直径大小和胚胎本身的质量,同时冷冻多个胚胎时可以根据平衡完成时间的先后对胚胎进行重新分组。
3.玻璃化:
此过程与卵母细胞的玻璃化基本相同
- 待预平衡完成后,用移卵针从ES中吸取胚胎及少量的ES3直到胚胎到达距离移卵针针尖端约1~2mm处,吸取少量的VS1并将其与ES混匀,混合过程中注意始终将胚胎保持在移卵针内;
- 吐出部分混合液后吸取新鲜的VS1并与移卵针内的残余液体重新混匀,不断改变移卵针在VS1中的位置,多次来回的反复吸入和吐出直至混合过程中产生的液体旋涡完全消失,然后将胚胎释放到VS1中远离可能含有ES的区域。吸取新鲜的VS1并将其吹到VS1液滴外,以去除残存在吸卵针内的ES,用移卵针反复拨动胚胎至新鲜的VS1,此过程约持续30s;
- 将胚胎转移到VS2中,在转移过程中注意吸取尽量少的VS1,拨动胚胎至新的位置两次以保持其周围新鲜的VS2,吸起胚胎并将其放置于离Cryotop末端黑色标记数毫米的塑料载片表面,尽可能多地回吸胚胎周围的玻璃化冷冻液VS2,并确保包括胚胎在内的液滴总体积不超过0.1μl,此过程应控制在60s以内;
- 将装载有胚胎的Cryotop从侧面倾斜投入到液氮容器中,特别要注意将从胚胎开始接触玻璃化冷冻液到投入液氮的总时间控制在60~90s以内;
- 在液氮液面下用镊子将Cryotop塑料载片扣在塑料盖片上并扭紧,然后将其装载到金属支架中投入液氮罐中保存。
玻璃化冷冻胚胎及胚胎的复温
虽然预平衡过程有所不同,但玻璃化冷冻的人胚胎和不同发育阶段胚胎的复温方法基本相同。
1.复温前准备
玻璃化冷冻保存的标本对温度变化非常敏感,一个小小的疏忽就有可能导致卵母细胞或者胚胎的死亡,因此在复温开始前一定要确保各项准备工作就绪。
(1)商品化的玻璃化冷冻复温(Vitrification warming)及复苏液可从厂家直接购买,亦可按照下面的方法自行配制;
(2)玻璃化冷冻复温及复苏液的配制
- 清洗液(Washing Solution,WS):mHTF+20%(v/v)SPS
- 复温液(Thawing Solution,TS):以WS为基础液配制1.0mol/L的蔗糖液;
- 复苏液(Dilution Solution,DS):以WS为基础液配制0.5mol/L的蔗糖液;
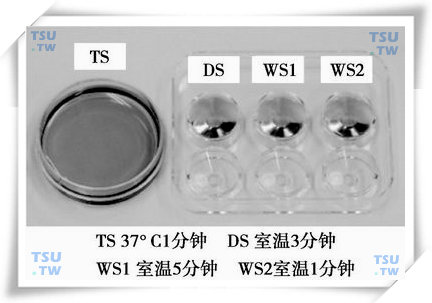
(3)在复温前至少1.5h将5ml TS加到Falcon 3001皿中,无CO2的37°C培养箱中预热并使其温度稳定保持在37°C,待用;
玻璃化冷冻保存人胚胎及胚胎的复温
(4)复温前至少30min从冰箱中取出玻璃化冷冻复温及复苏液,按照上图所示,在六孔皿中分别加入0.5min的复苏液DS及清洗液WS1、WS2,室温下(20~25°C)平衡待用;
(5)仔细核对患者的姓名、冷冻时间及冷冻标本的时期和数目,将装载有待解冻标本的金属支架从液氮罐中移出并存放于盛装液氮的塑料或者玻璃内壁保温盒中,注意确保始终有足够多的液氮完全浸没Cryotop。
2.快速复温
在液氮液面下用镊子将塑料盖片从Cryotop移走,然后非常快速地将塑料载片直接浸入到装载有37°C TS溶液的Falcon 3001皿中,此过程非常关键且需在1s内完成。为了确保快速复温的顺利进行,建议将装载有冷冻标本的液氮容器放置于显微镜近旁,以方便快速操作;
以塑料载片末端的黑色标记为参照,调节解剖显微镜的焦距并对卵母细胞或者胚胎进行定位。一般情况下卵母细胞或者胚胎会在30s内从塑料载片上脱落到ES中。如果1min时卵母细胞或者胚胎仍然没有脱落,则需要用移卵针将他们从塑料载片上吹下来。
3.复苏和清洗
在塑料载片浸入TS后1min用移卵针将卵母细胞或者胚胎轻轻吸起,随后吸取少量TS直到卵母细胞或者胚胎到达距离移卵针针尖端约2mm处,将TS缓慢地吹到DS的底部,轻轻地将卵母细胞或者胚胎释放到底层的TS中,停留3min。此为逐步稀释法,旨在防止稀释过程中跨膜渗透压差变化过大,水分进入细胞过快而引起细胞膨胀破裂;
同样的方法吸取DS直到卵母细胞或者胚胎到达离移卵针针尖端约2mm处,将DS缓慢地吹到WS1的底部,然后将卵母细胞或者胚胎轻轻地释放到底层的WS1中,停留5min。
吸取卵母细胞或者胚胎及尽量少的WS1,将其释放在WS2中央的液面上待其自然沉降到皿底部,然后吸取卵母细胞或者胚胎及尽量少的WS2,重复上面的过程,此过程持续1min。
清洗完毕后将卵母细胞或者胚胎转移到相应的培养液中,37°C 5%CO2培养箱中培养。
慢速冷冻法
慢速冷冻法是依靠冷冻保护剂,慢速降温速率以及置冰来减少和避免细胞内冰结晶的形成,以及渗透压变化和温度变化对胚胎的打击。
慢速冷冻法目前在临床上的运用较为广泛。可用于胚胎发育的各个阶段,如受精卵、分裂期和囊胚期。目前,受精卵和分裂期的胚胎慢速冷冻效果较为稳定,而囊胚慢速冷冻仍在不断改进之中。
下面简单地介绍几种慢速冷冻方法供参考。
人类受精卵(2PN)至4细胞分裂期胚胎的冷冻及解冻
配制冷冻保护剂的溶液为20%血清的缓冲液。
1.冷冻
(1)脱水程序:
- 1.5mol/L PROH,10~15min室温;
- 1.5mol/L PROH0.1mol/L Sucrose 15min室温(注意:这里所说的15min包括将胚胎装入冷冻管或麦管并放进生物冷冻仪);
- 将胚胎装入麦管或已装有0.3ml 1.5mol/L PROH0.1mol/L Sucrose冷冻保护剂的冷冻管中,然后放进生物冷冻仪,开始冷冻降温程序。
(2)降温程序:
- 起始温度20℃;
- 停留在20℃等待样品上机;
- 样品上机后开始降温,-2℃/min直至-6℃;
- 停留在此温度5min,作为soaking;
- 人工置冰(manual seeding);
- 继续停留在-6℃(Holding),5min;
- 继续降温-0.3℃/min直至-30℃;
- -50℃/min直至-150℃;
- 停留在-150℃,2h;
- 样品下机,直接快速地放入液氮中,然后转入液氮罐中保存。
2.解冻
(1)快速解冻:麦管:室温30~40s→30℃水浴40~50s至冰融化;冷冻管:30℃水浴1~1.5min直至冰全融化。
(2)寻找胚胎:用吸管将冷冻管中的全部溶液转入培养盘中,镜下寻找胚胎,或将麦管中的全部溶液释放入培养盘中,镜下寻找胚胎。
(3)反脱水:
- 1.0mol/L,PROH/0.2mol/L,sucrose,5min,室温;
- 0.5mol/L,PROH/0.2mol/L,sucrose,5min,室温;
- 0.2mol/L,sucrose,10min,室温;
- 20%血清缓冲液,10min,室温;
- 将胚胎转入培养液中,放进37℃、5%CO2培养箱培养。
人类胚胎4~8细胞分裂期的冷冻及解冻
此方法是目前NYU正在使用的方法,由L.chi修改。
配制冷冻保护剂的溶液为含10%人血浆蛋白的mHTF。
1.冷冻
(1)脱水程序:
- 0.5mol/L,PROH,5min,室温;
- 1.0mol/L,PROH,5min,室温;
- 1.5mol/L,PROH,10min,室温;
- 1.5mol/L,PROH/0.1mol/L sucrose,10min,室温。
- 将胚胎装入已装有0.3ml 1.5mol/L PROH0.1mol/L sucrose冷冻保护溶液的麦管中,装管时间应不超过5min。装好样品后上机。
(2)降温程序:
- 起始温度:+22℃;
- 停留在+22℃,等待样品上机;
- 样品上机后开始降温:-2℃/min直至-7℃;
- soaking:5min;
- manual seeding;
- holding:5min;
- 继续降温:-0.3℃/min直至-32℃;
- 样品下机,直接快速地放入液氮中,然后转入液氮罐中保存。
2.解冻
(1)快速解冻:将冷冻管从液氮取出后直接放入31℃水浴1~1.5min,直至冰全部融化。将冷冻管静置于室温下5min。
(2)寻找胚胎:用吸管将冷冻管中的全部溶液转入培养皿中,镜下寻找胚胎。
(3)反脱水:
- 1.25mol/L,PROH/0.2mol/L,sucrose,5min,室温;
- 1.0mol/L,PROH/0.2mol/L,sucrose,5min,室温;
- 0.75mol/L,PROH/0.2mol/L,sucrose,5min,室温;
- 0.5mol/L,PROH/0.2mol/L,sucrose,3min,室温;
- 0.25mol/L,PROH/0.2mol/L,sucrose,3min,室温;
- 0.2mol/L,sucrose,3min,室温;
- 6%血清培养液,清洗4次(在4个培养液小滴中轻柔地漂洗);
- 将胚胎转入干净的6%血清培养液中,放进37℃、5%CO2培养箱培养。
人类胚胎囊胚期的冷冻及解冻
此方法是目前NYU正在使用的方法,来源于D.Gardner的实验室,配制冷冻保护剂的溶液为10%人血浆蛋白的mHTF。
1.冷冻
(1)脱水程序:
- 5%glycerol,10min,室温;
- 9%glycerol/0.2mol/L sucrose,10min,室温;
- 将胚胎装入已装有0.5ml 9%glycerol0.2mol/L sucrose冷冻保护溶液的冷冻管中。装好后样品上机。
(2)降温程序:
- 起始温度:+20℃;
- 停留在+20℃,等待样品上机;
- 样品上机后开始降温:-2℃/min直至-6.5℃;
- soaking:5min;
- manual Seeding;
- holding:5min;
- 继续降温:-0.3℃/min直至-37℃;
- 样品下机,直接快速地放入液氮中,然后转入液氮罐中保存。
2.解冻
(1)快速解冻:31℃水浴1~1.5min快速解冻。
(2)寻找胚胎:将冷冻管中的全部溶液转入培养皿中,镜下寻找胚胎。
(3)反脱水:
- 5%glycerol/0.1mol/L,sucrose,5min,室温;
- 0.1mol/L,sucrose,5min,室温;
- 10%人血浆蛋白mHTF,5min,室温;
- G2培养液中清洗4次(在4个培养液小滴中轻柔地漂洗);
- 将胚胎转入干净的G2培养液中,放进37℃、5%CO2培养箱培养。
