细胞核
人精子头部呈扁卵圆形,长3.7~4.7μm,宽2.5~3.2μm,厚1.0μm。正面观呈卵圆形,侧面观呈梨形,头部的主要结构为细胞核和核前的顶体。在顶体尾部还存在与受精密切相关的顶体后环和核后环。
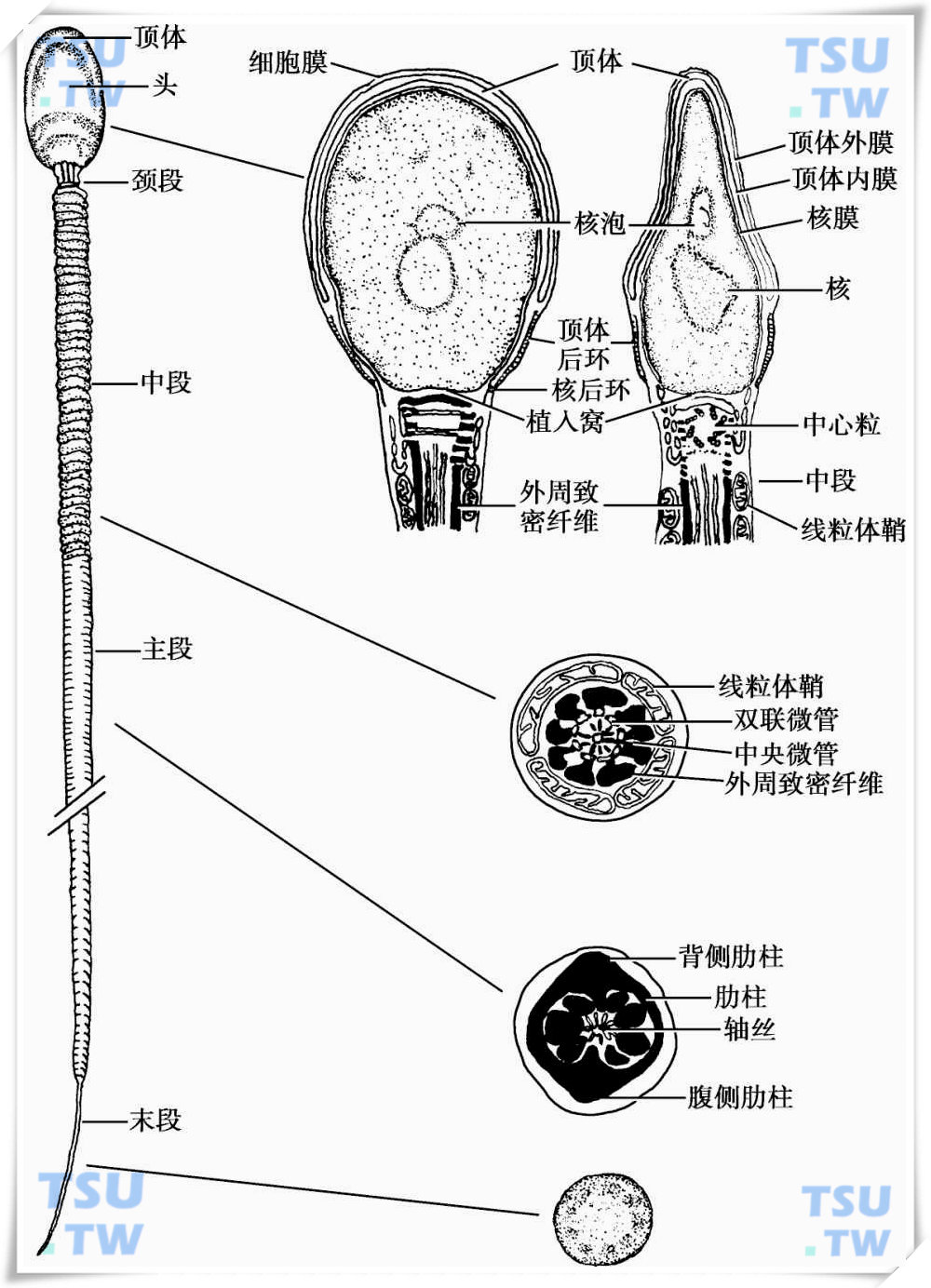
人精子超微结构模式图
精子细胞核位于精子头部的中央偏后,表面包有核膜,其内为核质,核质主要为高度浓缩的染色质。电镜下核内染色质呈不规则的纤维颗粒状,在浓密的核染色质中,可常见不规则的透亮区,称为核泡(nuclear vacuole),核泡是在染色质浓缩过程中形成的,较大的核泡可能是染色体排列发生畸变引起的,正常精子的顶体区没有大的核泡,并且不超过2个核泡,核泡大小不超过头部的20%,顶体后区部不含任何核泡。核染色质主要由DNA和精核蛋白组成,和体细胞相比,精子的DNA和核蛋白的组成有其独特性。这种差异主要表现在两个方面:
- 由于精子是单倍体,故DNA量仅是体细胞的一半,同时由于精子除合成少量功能蛋白外,基本上处于休止状态,故其染色质的致密度明显高于体细胞,体积也很小,有利于精子的穿透功能。
- 体细胞的核蛋白主要是组蛋白,而精子的核蛋白主要是精核蛋白,后者为一种富含精氨酸和半胱氨酸的碱性蛋白。
精核蛋白(protamine)是精子细胞中特有的一种低相对分子质量的碱性蛋白质,最早由鱼类精子的头部分离所得,所以又称为精核蛋白,以后发现人类精子的核蛋白也以精核蛋白为主。人精子核内的精核蛋白分为两大类:一类为P1精核蛋白,存在于所有哺乳动物精子核中,人精子核中的称HP1(human protamine 1);另一类为P2族精核蛋白,由P2、P3和P4组成,P2族精核蛋白只存在于人类及很少几种哺乳动物中(如小鼠、仓鼠等)。人精核蛋白是在精子发生过程中形成的。在精原细胞和精母细胞的核中仍以组蛋白为主,因此在精子形成过程中,核内蛋白质经历了组蛋白被精核蛋白取代的过程。在精子细胞的变形过程中,核内的组蛋白首先转换成两种过渡蛋白,称TP1和TP2(transition protein,TP),接着精子细胞新合成的TP3和S12取代了TP1和TP2,形成成熟精子内的精核蛋白。
研究发现HP1由50个氨基酸残基组成,哺乳动物的P1结构均相同,整个P1含有3个结构区域:
- 从N末端开始的顺序为丙、精、酪、精、胱,为一高度保守区;
- 中央区域含有4个精氨酸丛,也为高度保守区;
- C末端为高度可变区,此外P1的第8、10和12位为丝氨酸和苏氨酸。P2除含有丰富的精氨酸外,还有许多组氨酸残基。
人精子中已发现有P2a和P2b两种变异体,P2a 为57个氨基酸,P2b为54个氨基酸,N末端比P2a少3个氨基酸,其余的氨基酸序列相同。P2a有可能是P2b的前体分子。在细胞核内,精核蛋白主要和DNA结合,关于结合方式,有二种假设:一种认为精核蛋白分子位于DNA双螺旋的大沟内,蛋白分子中央区的精氨酸丛能与DNA分子上的磷酸基相互作用,而蛋白分子的N端和C端则充填在DNA双螺旋的小沟内,与邻近的DNA或精核蛋白发生作用;另一种假设是,精核蛋白分子位于DNA螺旋的小沟内,暴露部分则镶嵌在邻近DNA螺旋的大沟内,蛋白质N端和C端的一个精氨酸,可与邻近DNA螺旋大沟内的基团形成氢键,同时蛋白分子上的半胱氨酸可形成分子间的二硫键,使平行排列的染色质丝更趋于稳定。与组蛋白相比,精核蛋白与DNA的这种结合方式更为紧密。
电镜观察,未染色的标本,精核蛋白区的密度高于组蛋白,但用重金属离子(如铀)染色后,则结果相反。这是由于组蛋白区内,核DNA上的负电荷与离子结合,使电子密度加大,而在精核蛋白区由于DNA的负电荷被中和了,无法与金属离子结合,故电子密度低。精核蛋白的主要作用是通过精氨酸上的正电荷与DNA的负电荷相吸引,加上半胱氨酸间的二硫键,使核染色质高度浓缩,即缩小了精子头的体积,有利于精子穿入卵细胞,又抑制了染色质的转录活性,使精子的核物质更趋于稳定,核物质密度的增加也保护了核内遗传物质免受外界因素的影响。精核内精核蛋白量的多少也成为衡量精子成熟程度的一个指标。已经发现,精子核蛋白的缺乏与不育相关,而少精子症患者有精核蛋白含量的下降,亦已证明抗精核蛋白抗体可以抑制精子与卵的结合,证明了精核蛋白与精子受精能力的关系。此外,精核蛋白亦与胚胎发育有关,精核蛋白的转化障碍,可能引起胚胎发育异常。
核的表面为核膜,为类脂双层结构。精子的核膜较体细胞的核膜薄,厚7~10nm,大部分核膜无核孔,但在核后环处,精子变态过程中,核染色质浓缩,核体积缩小,多余的核膜形成一下垂的皱褶,一直延伸到颈段,此处的核膜较厚,同体细胞的核膜一样厚40~60nm,膜上有孔。核膜的内表面有一层蛋白质形成的网,称核板(nuclear lamina),主要由3种层粘连蛋白(laminin)A、B、C组成,起支撑核膜的作用,并可固定染色质。
顶体
顶体(acrosome)为覆盖于精子细胞核前2/3的扁囊状结构,光镜下,精子未染色时较透亮,用瑞-吉染液为9∶1的混合液进行染色,可观察顶体形态,正常精子顶体面积约占头部面积的40%~70%;电镜下,顶体由顶体外膜、顶体内膜和顶体腔三部分组成。顶体外膜与细胞膜之间有薄层的细胞质,顶体内膜与核膜间也有一间隙,称顶体下间隙。内、外膜在顶体后缘相互延续。顶体反应时,顶体外膜具有与细胞膜融合的功能,使得顶体酶释放,同时,顶体内膜暴露出来,位于顶体内膜上的特异分子参与精子和透明带的二次识别。顶体腔内容物呈均质状,含多种与受精有关的化学物质。
顶体又可分为顶体前区和赤道部两部分,前者位于精子的前部,构成顶体的大部分,后者较短,位于头部较宽处。
顶体是一个特化的溶酶体,其内含有多种与受精相关的水解酶,如顶体蛋白酶(顶体素)、透明质酸酶、乙酰氨基葡萄糖苷酶、酸性磷酸酶、芳基硫酸酯酶A、胶原酶样多肽酶、磷脂酶、放射冠穿透酶等,总称为顶体酶系,其中顶体蛋白酶和透明质酸酶尤为重要。
顶体蛋白酶又称为顶体素(acrosin),是一种丝氨酸蛋白溶解酶(serine proteinase,SP),主要位于精子头部的顶体基质或顶体内膜上,本质为糖蛋白,用去垢剂(detergent)、超声处理和低pH值等方法提取,并用凝胶过滤、离子交换层析、等电聚焦、亲和层析和电泳等技术,可获得纯顶体素。但不同物种和用不同方法分离所得到的顶体素,相对分子质量差异较大。人的顶体素相对分子质量为30 000~70 000。Klemn报道,顶体素分子由酶原区(zymogen domain,ZD)、催化区(catalytic domain,CD)和尾区(tail domain,TD)三部分组成,ZD 和CD区的氨基酸顺序无种属差异,但TD有种属差异且在受精过程中起重要作用。顶体素的合成是随着顶体的形成而进行的,在单倍体的精子细胞阶段就开始出现丰富的前顶体素(proacrosin,PA)mRNA,但直到获能前,85%~90%的顶体素仍以酶原形式存在,这对于防止精子的自溶极其重要。多种因素可导致顶体素的活化,特别是pH的变化,在环境pH为5.0时,PA和顶体素均较稳定,但在获能和顶体反应时,顶体内的pH升高,当pH达到8.0~8.5时,PA即自动活化,降解为相对分子质量较小的α、β和γ三种有活性的顶体素。活化的顶体素一方面可通过透明带上的顶体素受体溶解卵细胞表面的透明带,另一方面又可激活更多的PA活化为顶体素。此外,白蛋白和卵泡液也可激活顶体素。顶体素的作用是溶解透明带中的蛋白质,使精子得以穿过透明带,同时还可能与精卵的识别有关,顶体素的活性与精子的顶体反应也密切相关,顶体反应时,顶体素原释放,并转化为顶体素,反过来,顶体素又进一步促进顶体反应。顶体内容物中还含有前顶体素结合蛋白,在碱性环境中能激活顶体素。已发现顶体素活性降低或消失可导致受精能力丧失。体外给予一些蛋白酶抑制剂或给予抗顶体素抗体可抑制精子穿过透明带,从而为寻找对精子顶体特异抑制的避孕药打下了理论和实验基础。
顶体透明质酸酶为透明质酸酶的同工酶,存在于顶体基质中。在酸性环境中(pH 5.0)活性最高,pH高于7时,则失去活性。顶体反应时,该酶释放出来,分解卵丘细胞之间的透明质酸,使卵丘细胞消散,精子得以穿过放射冠。抗透明质酸酶的抗体和透明质酸酶抑制剂可抑制精子的受精能力。
顶体酶发生作用的前提之一是精子发生获能和顶体反应,获能是精子表面的去能因子丢失过程,获能后,精子进一步发生顶体反应,表现为顶体外膜与细胞膜发生间断性融合,融合后的细胞膜和顶体外膜形成囊状小泡,最终囊状小泡消失,顶体内膜暴露。此间,顶体内各种酶释放或暴露出来,并转化为活性形式,发挥各自的作用。因此通过抑制获能和顶体反应,阻止顶体酶的释放也可抑制受精。
顶体内容物中还含有识别透明带的蛋白,SP56位于精子胞膜上,也存在于顶体内,参与精子与透明带的识别。NPTX2、Zonadhesin、SP10等也是位于顶体内的蛋白,参与精子的受精过程。
顶体后环和核后环
顶体尾侧处细胞质局部浓缩,特化成一薄层环状增厚的致密带,紧贴于细胞膜下,称为顶体后环(postacrosomal ring)。受精时,覆盖于此处的细胞膜首先与卵膜融合,因此此处为精卵识别部位,顶体后环的缺乏可导致不育。在顶体后环的尾侧,细胞膜与核膜紧贴,形成一环状线,称核后环(postnuclear ring)。核后环尾侧,细胞膜又和核膜分离,多余的核膜在此形成下垂的皱褶。在核的后极,有一浅窝,称植入窝,与尾部颈段起始端嵌合,加强头与尾的连接。
精子头部特别是顶体的形态与精子的受精能力密切相关,已发现缺乏顶体的圆头精子无受精能力,透明带与精子的结合也对精子形态有很大的选择性。顶体前区较大、两侧对称性好和颈部没有畸形的精子容易与透明带结合。
