体外观察动物精子与卵子膜的融合过程,当活泼的精子与卵膜接触5~15s,精子尾部摆动就突然减慢,接触15~25s以后,精子完全丧失运动能力。精子与卵子接触30min时,即可见卵子膜上的微绒毛将精子头部抱合,并使之定向地躺在卵膜表面,卵子表面大量微绒毛在融合过程中有重要作用,可使精子头定向与卵子膜贴合。由于其曲率半径小,可以克服两层膜之间同性相斥的作用而有利于融合。顶体反应后暴露出来的顶体内膜并不与卵膜融合,顶体内膜流动性很差,而顶体后膜的流动性极大,膜的流动性是发生膜融合的先决条件。观察发现,融合发生于卵子膜与精子的顶体后膜之间。在融合的同时,卵细胞质伸出舌样突起覆于精子头部上方,然后以吞噬的方式将精子全部包入卵子胞质内,此时约为受精开始后15min(下图)。值得指出的是,精子与卵子膜的融合无严格的种族特异性,而精子与卵子透明带的识别则有严格的种族特异性。
长期以来,许多科研工作者致力于寻找参与精卵质膜融合的候选分子。早期的研究主要通过使用抗精子单克隆抗体抑制精卵融合的方法来寻找候选分子,目前基因功能研究技术如转基因和基因打靶技术已经被证明是一个能够揭示细胞间相互作用候选分子功能的有效工具,以前通过抗体抑制试验认为介导了精卵融合的若干关键性分子,因为基因功能的深入研究而被一一否定,如整合素、ADAM1、ADAM2和ADAM3。近年来对精卵融合的分子机制有了许多新的认识。
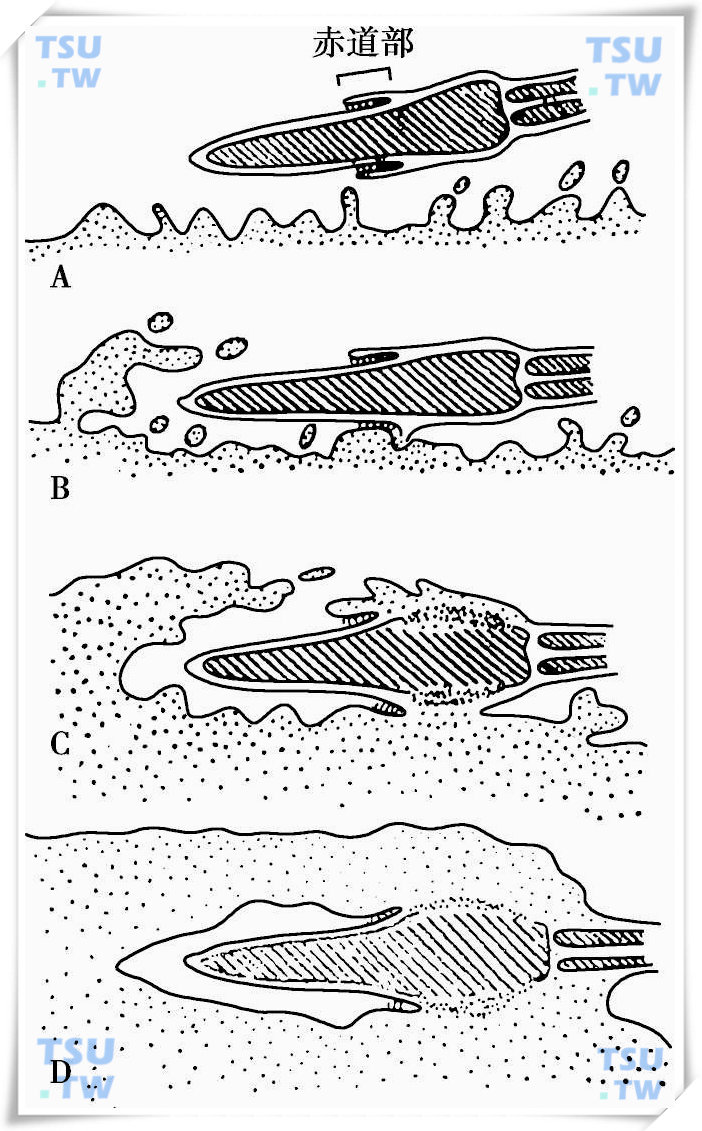
A→D精卵融合过程图解
精子表面参与精卵融合的候选分子
Izumo
Izumo的表达具有睾丸组织特异性,然而其不能在新鲜的精子表面被检测到,仅在发生顶体反应后才暴露于精子表面。免疫细胞化学实验证实,Izumo定位于顶体反应后精子的顶体内膜而非赤道段。Izumo蛋白的相对分子质量在小鼠为56 400,在人类为37 200,属免疫球蛋白超家族成员,是Ⅰ型跨膜蛋白,含有一个胞外免疫球蛋白结构域,该结构域可能包含一个糖基化位点。Izumo单克隆抗体能够明显地抑制精卵融合,且多克隆抗体能够阻止精子与去透明带的金黄地鼠卵母细胞的结合和融合。此外,将合成的Izumo肽段注射至雌性小鼠体内可致其免疫性不孕,受精率显著降低。这些结果似乎提示了Izumo具有介导精卵融合的作用。进一步研究揭示,将Izumo基因敲除后,Izumo-/-雌鼠能够正常生育,Izumo-/-雄鼠能够发育成熟并正常射精,且Izumo-/-雄鼠的精子不论形态还是运动能力都正常,而且可以穿越卵丘细胞层和透明带并与卵母细胞膜表面结合,但这种精子不能和卵母细胞融合,因而导致雄性不育。体外授精实验也证实,Izumo-/-雄鼠的精子能与去透明带的卵母细胞正常结合,但精卵融合发生障碍。
附睾糖蛋白DE
附睾糖蛋白DE为富含半胱氨酸分泌蛋白家族的成员,分泌到附睾腔的附睾糖蛋白DE覆盖在精子的表面,并且随着精子的成熟从精子顶体的顶部迁移到赤道部,随后发生顶体反应,DE位于赤道部,提示该蛋白可能具有介导精卵融合的作用。去透明带的卵母细胞在经纯化的DE作用下,精子的穿透率明显减少,但精子和卵母细胞的结合并未受影响,提示DE蛋白通过与卵母细胞表面的互补位点结合,参与了精卵的结合并导致精卵的融合。DE的结合位点位于卵母细胞表面的融合区,并且其在卵子发生过程中短暂的表达与卵母细胞融合能力的获得有关。
卵母细胞表面参与精卵融合的候选分子
CD9
CD9特异性表达于卵母细胞微绒毛表面。基因敲除实验确定,CD9分子具有介导精卵融合的功能。CD9基因敲除小鼠能够健康生长,但雌性小鼠的生育力急剧下降,产仔率不及野生小鼠的2%。CD9基因敲除的纯合子(CD9-/-)雌鼠与雄鼠交配后,精子都位于卵周间隙,提示精子与透明带的相互作用是正常的,不育的原因可能在于两性配子质膜的结合或融合异常。体外受精实验证实了精卵融合过程中的缺陷:精子能够与去透明带的CD9-/-卵母细胞结合,但不能融合。抗CD9单克隆抗体在体外也能够抑制精卵融合。
糖基磷脂酰肌醇锚定蛋白
糖基磷脂酰肌醇锚定蛋白由位于脂质双分子层的蛋白质和与之共价结合的糖基化磷脂酰肌醇两部分构成,磷脂酰肌醇磷脂酶C(PI.PLC)或血管紧张素(ACE)能够将该蛋白从细胞表面释放出来。Coonrod等证实卵母细胞经PI.PLC处理后,与精子结合和融合的能力显著减弱,提示卵母细胞上的GPI锚定蛋白参与了精卵融合。
