睾丸是男性生殖腺,其发生过程可分为未分化期和性分化期两个阶段。人胚第5周,生殖腺开始形成,第6周时原始生殖细胞迁移至此,此时的生殖腺尚无性别分化,称为未分化性腺。人胚第7周,生殖腺开始性别分化,在男性个体其逐渐分化形成睾丸。随着睾丸的分化发育,原始生殖细胞分化形成精原细胞,此时直至青春期前睾丸的发育均很缓慢。
生殖腺嵴
人胚发生早期呈盘状,由内胚层、中胚层和外胚层三层细胞组成,其中中胚层又分为轴旁中胚层、间介中胚层和侧中胚层,胚胎发育第4周时,间介中胚层逐渐向腹侧移动,形成一对纵行的索条状结构,称生肾索(nephrogenic cord)。以后,生肾索体积不断增大,从胚体后壁突向体腔,沿脊柱两旁形成两条左右对称的纵行隆起,称尿生殖嵴(urogenital ridge)。接着,嵴的中部出现一条纵沟,尿生殖嵴被分成外侧部分长而粗的中肾嵴(mesonephric ridge)和内侧部分短而细的生殖腺嵴(gonadal ridge)。
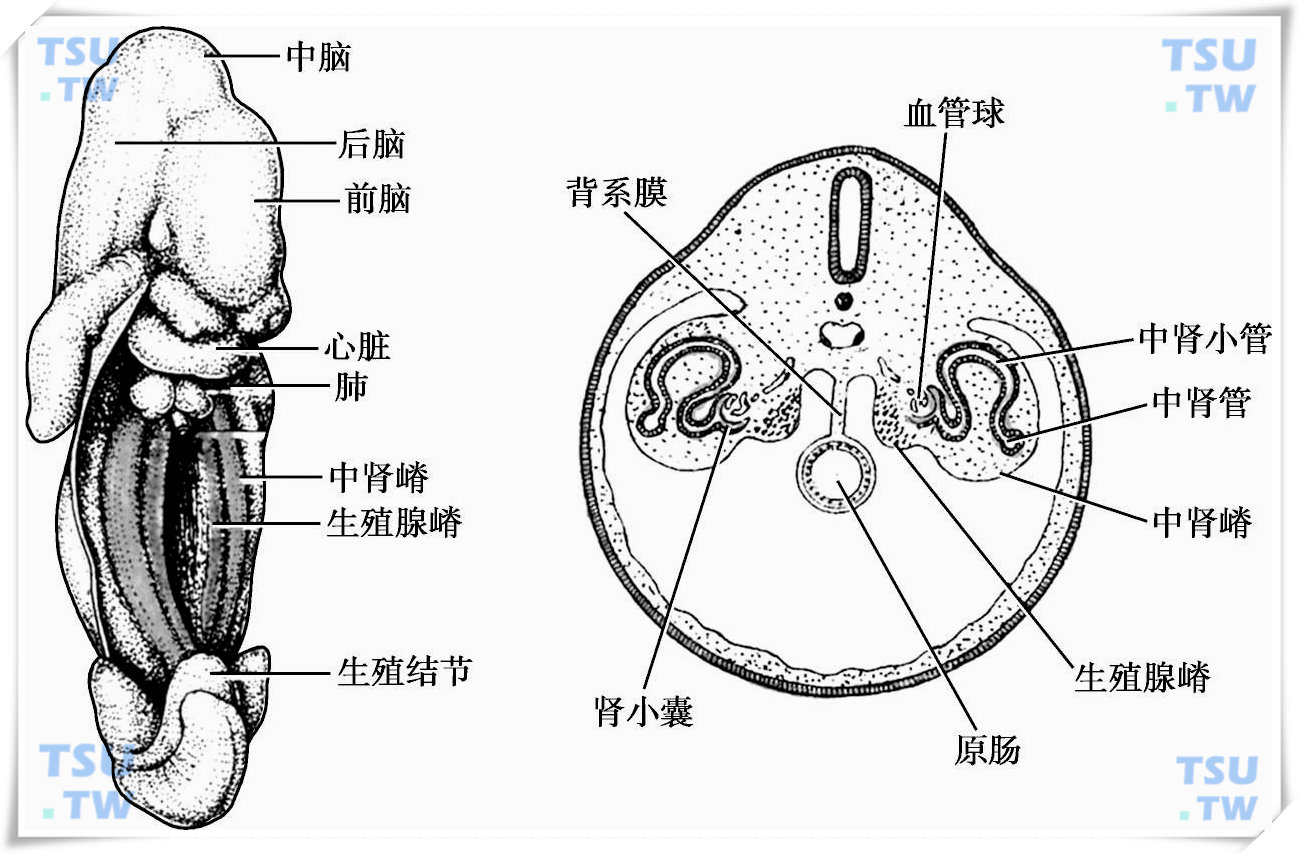
中肾嵴和生殖腺嵴发生模式图
生殖腺嵴就是睾丸和卵巢发生的原基,其表面覆有体腔上皮,深部为间充质。人胚第6周时,原始生殖细胞(primordial germ cells,PGCs)逐渐进入生殖腺嵴的间充质和增厚的上皮内(下图)。生殖腺嵴表面上皮受PGCs的刺激,日益增厚,并向上皮下方的间充质内呈条索状的增殖,从而形成初级性索(primary sex cord)。此时为未分化性腺,由外部的皮质和内部的髓质构成。
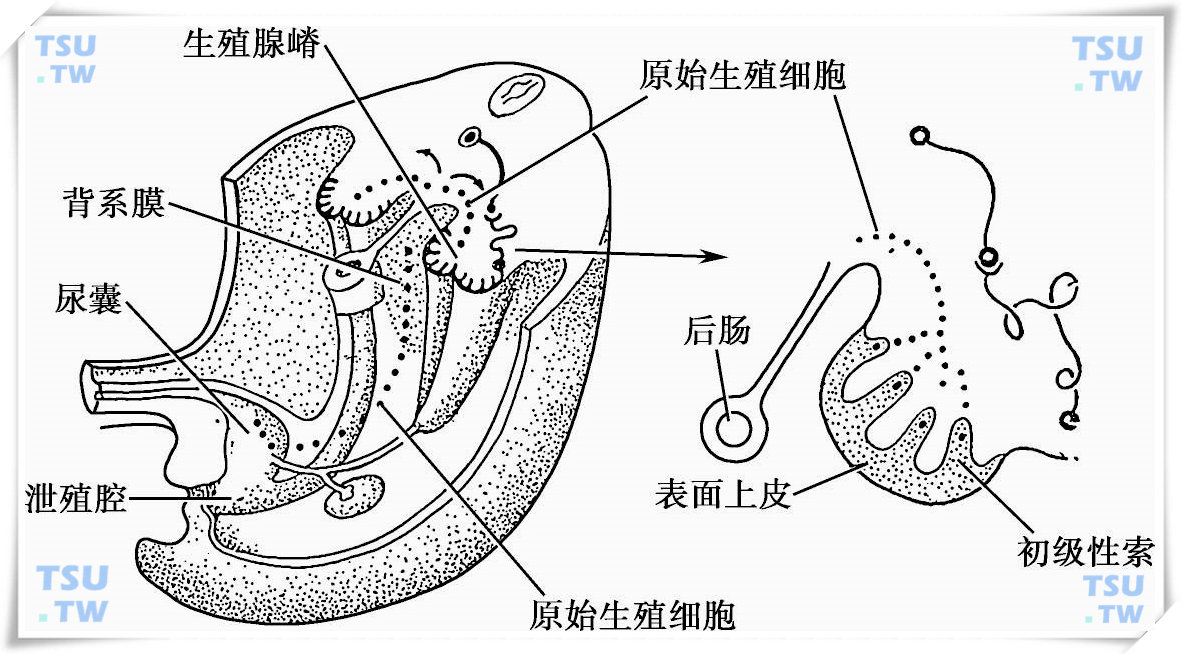
未分化性腺示意图
原始生殖细胞的发生和迁移
原始生殖细胞的发生
性别分化以前的生殖细胞,称为原始生殖细胞(primordial germ cells,PGCs),是一种具有多向分化潜能的干细胞。这些细胞大而圆并能够游走,在运动时可出现伪足。形态学观察显示PGCs核染色质分布均匀,有1~2个核仁;胞质呈嗜碱性,含有核糖体、中心粒、高尔基复合体、内质网等细胞器,并富含碱性磷酸酶和糖原;细胞边界清晰,表面有一层细纤维衣,特别在细胞运动时伪足表面更为明显,推测其可能与细胞迁移有关。
PGCs是如何产生的,历来有不同的意见。目前普遍认为,在脊椎动物中,只有生殖质(germ plasm)的参与,才有可能产生PGCs。生殖质是脊椎动物卵母细胞在发育过程中分化出来的部分细胞质,可能含有mRNA和蛋白质。当卵母细胞受精后,生殖质经卵裂分配到一些卵裂球中,随胚胎发育导致PGCs的产生。PGCs起源部位依动物种类不同可能存在着差别,目前说法不一。在小鼠,有报道PGC的前体细胞存在于早期胚胎的外胚层(epiblast),此后随外胚层细胞的增殖向原条后端移动,并于原肠胚形成早期通过原条进入胚外中胚层,靠近尿囊芽处,在此于胚胎大约7.5d被决定形成PGCs,然后向生殖腺嵴迁移;另有报道则认为PGCs首先来自卵黄囊内胚层,然后迁移到后肠的内胚层,进而进入生殖腺嵴。在人类,研究显示胚胎第19~21d,在卵黄囊后壁近尿囊处的内胚层最早出现PGCs。目前,PGCs的产生机制尚不清楚,最近有研究通过比较小鼠PGCs和其邻近的、具有相同祖先的体细胞发现,决定PGC形成的蛋白质为fragilis,他是跨膜蛋白家族的一个新成员,表达fragilis最多的一组细胞分化为PGCs。
原始生殖细胞的迁移和增殖
很多动物的原始生殖细胞都不是直接在生殖腺原基中形成的,而是在生殖腺以外的区域起源,然后沿着一定的路线迁移到生殖腺中,人和小鼠的生殖细胞均是如此。人胚从第25d开始,PGCs由发源地沿背侧肠系膜向生殖腺嵴迁移;至第6周,PGCs进入生殖腺嵴。在小鼠胚胎7.5~8.5d,PGCs从原条后端,也是正在形成的后肠所处的区域,随着后肠的内卷被带进胚胎内部,并到达后肠内胚层;此后PGCs离开后肠内胚层,沿着背侧肠系膜运动,于胚胎第10.5~11.5d到达生殖腺嵴,第12d时几乎所有的PGCs迁移完毕,这个时期的PGCs具有伪足等特征结构,是以变形虫样运动的方式主动地向生殖腺嵴迁移。
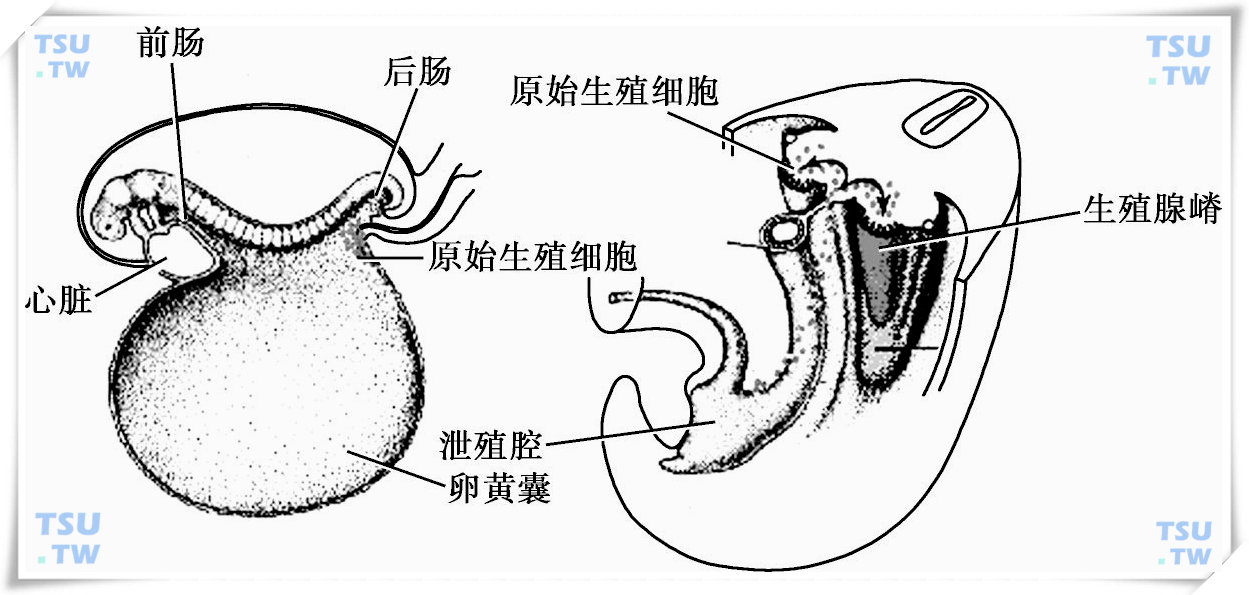
原始生殖细胞迁移示意图
PGCs的迁移受多种因素影响。调节、引导生殖细胞迁移的因素有以下几个方面:①生殖腺嵴可以释放某些趋化性物质,具有吸引PGCs的能力。例如,生殖腺嵴能释放转化生长因子β-1(transforming growth factorβ-1,TGFβ-1),他们形成特定的浓度梯度,吸引具有TGFβ-1受体的PGCs沿着其浓度梯度进行迁移。②PGCs迁移路径上的体细胞及周围的胞外基质对PGCs具有影响。如PGCs内的c-kit基因编码酪氨酸激酶受体(c-kit受体),而迁移路径上体细胞内的steel基因编码steel因子(steel factor,SLF),该因子是酪氨酸激酶受体的配体,在小鼠胚胎中沿PGCs的迁移路径呈梯度表达,到生殖腺嵴表达最高,因此SLF能通过与c-kit受体相互作用,从而指引PGCs沿正确路径向生殖腺嵴迁移。又如,迁移路径中背侧肠系膜的细胞外基质(纤连蛋白、层黏连蛋白、Ⅳ型胶原等糖蛋白类)能增加PGCs的黏附力,并且通过浓度梯度方式来正确指导PGCs的迁移方向。③PGCs相互接触,形成广泛的信号网络,对迁移也起促进作用。近年来,在不同的物种中,指导PGCs迁移的相关分子陆续被报道。例如在斑马鱼(zebrafish)中,沿着PGCs迁移线路表达的基质细胞衍化因子-1α(stromal cell derived factor-1α,SDF-1α)及其受体CXCR4b可能是指导PGCs定向迁移的关键因子,抑制SDF-1α或CXCR4b,或者使SDF-1α过表达,都导致PGCs迁移的严重异常。而在哺乳动物中,myc、jun、fos和mos等基因被报道与PGCs的发生和迁移有关。
研究表明,并非所有的PGCs都能正确迁移到目的地,部分停留在迁移途中,例如小鼠仅有60%的PGCs迁移到生殖腺嵴。如果PGCs由于迁移障碍而没有到达生殖腺嵴,则可分化为其最终到达的那个胚层的细胞,或者退化死亡而消失。在男性,若未分化性腺没有得到PGCs,会导致一种先天性异常,称唯支持细胞综合征(Sertoli-cell-only syndrome);患者睾丸生精小管上皮仅有支持细胞而没有生殖细胞,将来必将导致无精症和不育。
在迁移过程中以及进入生殖腺嵴后,PGCs进行了大量的有丝分裂增殖。在小鼠,PGCs从胚胎7.5d 的45个,到8.5d增殖为约100个,然后快速增殖到13.5d约25 000个,13.5d后停止增殖。PGCs的增殖受各种因子的调节,目前对于影响PGCs增殖和存活的分子机制研究主要是通过体外培养实验来进行的。研究显示,白血病抑制因子(leukemia inhibitory factor,LIF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、干细胞生长因子(stem cell factor,SCF)、白介素-2和白介素-4等均参与调控PGCs的增殖和生存。
