许多病原微生物侵入人体后,在引起炎症或感染过程中,能使红细胞生成减少,破坏增加或失血,由此产生的贫血称感染性贫血。这种贫血临床可分两大类:一类是感染后迅速发生,常以急性溶血性贫血表现为主;另一类是在慢性感染或炎症时逐渐发生,表现为慢性病贫血。
病因和发病机制
感染性贫血的发病机制可分失血、红细胞生成减少、红细胞破坏增加三种,见下表。
感染性贫血的发病机制

失血
胃肠道感染合并出血常见钩虫病,志贺痢疾杆菌所致细菌性痢疾,伤寒,幽门螺旋杆菌致胃和十二指肠溃疡引起出血。细菌感染引起膀胱炎常有血尿。肺内结核杆菌和曲霉菌感染可产生肺空洞引起咳血。感染引起失血临床表现常为急性,部分患者表现为慢性失血,其症状与缺铁性贫血相同。
红细胞生成减少
许多感染性疾病可对骨髓造血祖细胞产生不同程度的抑制作用。如这种抑制作用主要针对红细胞系,即产生贫血;如累及髓系细胞或巨核细胞系,可导致白细胞及血小板减少。感染导致红细胞生成减少的机制可分以下三种:
(1)再生障碍性贫血:
感染所致的再生障碍性贫血(再障)又分为:
1)肝炎和其他病毒感染后再生障碍性贫血:
临床罕见。0. 1%~0. 2%的肝炎患者可发生再障,而再障中约5%有近期肝炎病史。丙肝后再障比乙肝后再障多见。肝炎后再障常发生在肝炎恢复期,其发生与肝炎严重程度无关,预后较差。除肝炎病毒外,人类免疫缺陷病毒(HIV)、EB病毒、B19微小病毒等感染后亦可引起再障。溶血性贫血患者病毒感染后较正常人易发生再障。病毒感染后再障发生机制与病毒对造血细胞的直接或间接抑制有关。实验证明,肝炎病毒有嗜血细胞性;B19微小病毒对造血细胞有直接抑制作用。此外,病毒感染患者血清对其自身BFU- E和CFU- E抑制作用,可能与病毒微生物能激活巨噬和淋巴细胞释放干扰素-γ和肿瘤坏死因子而抑制造血细胞增殖有关。
2)骨髓正常组织被取代及骨髓坏死:
结核和组织胞浆菌病可在骨髓内形成肉芽肿,取代正常组织,引起骨髓病性贫血;革兰阳性和阴性细菌感染,毛霉菌、风疹、沙门菌均可引起骨髓坏死,导致全血细胞减少和骨髓功能衰竭;病原微生物可刺激单核-巨噬细胞系统吞噬血细胞;感染引起神经性厌食症导致营养缺乏使造血原料缺乏。
(2)慢性病贫血:
指伴随某些感染、自身免疫病如类风湿关节炎等发生的贫血,具有类似的临床表现和发病机制。贫血常为轻至中度,血红蛋白在70~110g/L,无明显症状,一般不需治疗。许多慢性感染常常合并慢性病贫血。贫血一般在感染持续1~2个月后发生。最常见的慢性感染有:亚急性细菌性心内膜炎、肺结核、脓胸、慢性支气管扩张、慢性骨髓炎、蜂窝织炎、慢性腹膜炎、慢性肝脓肿、膈下脓肿、慢性胆囊胆道炎、慢性肾盂肾炎、慢性盆腔炎、波状热、肠伤寒、溃疡性结肠炎、慢性深部真菌感染及其他各种化脓性疾患。
慢性病贫血发病机制复杂,主要有以下3种原因:红细胞生成受抑;红细胞破坏增多、寿命缩短;铁代谢障碍。
1)骨髓造血功能受抑:
主要与红系造血祖细胞对红细胞生成素(EPO)反应相对减低有关。次要原因为慢性感染患者EPO分泌相对减少。慢性病贫血患者EPO水平低于相应程度贫血的缺铁性贫血患者,实验证明TNF-α和IL- 1可以抑制EPO生成,这种抑制作用通过转录因子(GATA- 1)作用于EPO基因启动子而产生,抑制GATA- 1可增加EPO生成。红细胞动力学和造血祖细胞培养研究证明,红系祖细胞对于EPO相对性反应降低是贫血主要原因。用慢性感染患者分离出的巨噬细胞和贴壁细胞与正常骨髓混合培养,则会对正常红系祖细胞增殖产生抑制作用;此外,在正常骨髓红系祖细胞培养体系中加入慢性感染患者血清,亦会使红系祖细胞增殖减低;说明患者细胞和体液免疫可产生造血抑制因子。进一步研究证明,造血抑制因子产生与干扰素-γ、白介素- 1、肿瘤坏死因子(TNF)有关。感染可刺激干扰素-γ产生增加,干扰素-γ及其他淋巴因子、病原菌内毒素等可使单核巨噬细胞活化和增殖,粒细胞的增殖和破坏释放出大量细胞因子主要是干扰素-γ和TNF、白介素-6,这些因子本身在体外可直接抑制造血祖细胞增殖,同时这些因子可刺激免疫活性细胞分泌抑制红系造血的因子,使骨髓造血功能受抑。
慢性感染患者血清铁降低亦可使骨髓造血功能减低。血清铁不但是血红蛋白分子的重要组成部分,也是细胞内的细胞色素C、过氧化氢酶、细胞色素氧化酶、琥珀酸脱氢酶的必需辅基。血清铁降低影响了有核红细胞内血红蛋白的合成及新陈代谢酶的活性,使红系造血细胞对EPO的反应下降,红细胞增殖减少。
2)铁代谢紊乱:
铁代谢障碍是感染性贫血发病的重要原因之一。血清铁和血清总铁结合力降低,血清铁饱和度亦降低,是慢性病贫血的一个主要特点。虽然有人报告部分患者小肠的铁吸收有中度减少,但大部分患者小肠细胞摄取铁和细胞内的铁蛋白与铁结合均无障碍。血清铁下降是由于铁的释放障碍所致,即由体内主要的铁储存区——单核-巨噬细胞、肝细胞摄取铁后不易被释放出来再利用,证明存在着铁从细胞内释放障碍。这种释放障碍在炎症和感染后迅速发生,导致血清铁迅速降低。其机制与铁调素(hepcidin)分泌增高有关。感染时粒细胞破坏释放大量细胞因子IL-6、IL- 1和TNF-α。而血清铁浓度在正常情况下的维持依赖巨噬细胞和肝细胞释放铁,每日20~25mg铁释放入血浆铁-转铁蛋白池,只有1~2mg来自肠道吸收的食物铁,2~4mg与转铁蛋白结合,因而血浆铁主要由巨噬细胞和肝细胞释放储存铁。IL-6、IL- 1和TNF-α等炎症细胞因子,主要是IL-6利用肝细胞分泌铁调素。铁调素可直接与巨噬细胞和肝细胞膜上膜铁转运蛋白结合,而膜铁转运蛋白为细胞内铁释放入血的唯一通道,铁调素结合膜铁转运蛋白后,诱导其内置细胞后降解,导致膜铁转运蛋白的减少,抑制铁从细胞内释放入血浆,同时其还可以抑制小肠吸收铁,造成血浆铁降低。注射IL-6给健康志愿者,铁调素在12小时后升高,伴血浆铁下降,说明感染时IL-6与铁调素是铁代谢障碍所致贫血的主要原因。
3)蛋白质代谢异常:
慢性感染患者常有蛋白质摄取、吸收、合成障碍,而氮的负平衡可使珠蛋白合成下降或影响其他器官组织功能,进而影响血红蛋白合成及造血细胞的功能。这种因素在感染性贫血不占主要地位。
(3)急性感染性贫血:
常见于儿童,如嗜血杆菌脑膜炎,儿童感染后网织红细胞减低,提示骨髓造血功能受抑。类似情况也见于成人严重感染。其发生机制与慢性病贫血似不完全一样,但多为可逆性,感染痊愈后造血功能恢复正常。
红细胞破坏增多
当机体受到细菌、病毒或原虫的侵袭而发生感染性疾病时,由于机体产生干扰素-γ、IL- 1、IL-6、TNF等细胞因子,可使单核-巨噬细胞活化,巨噬细胞吞噬能力增强时,红细胞在脾、肝脏破坏过多,可产生血管外溶血。此外,由于病原体本身或其分泌的毒素及其他产物的直接作用或刺激机体免疫反应引起的间接作用,使红细胞迅速破坏而发生急性溶血性贫血。很多病原微生物可引起溶血性贫血。但它们引起贫血的机制不尽相同,可分为以下几种情况:
可引起溶血性贫血的病原微生物
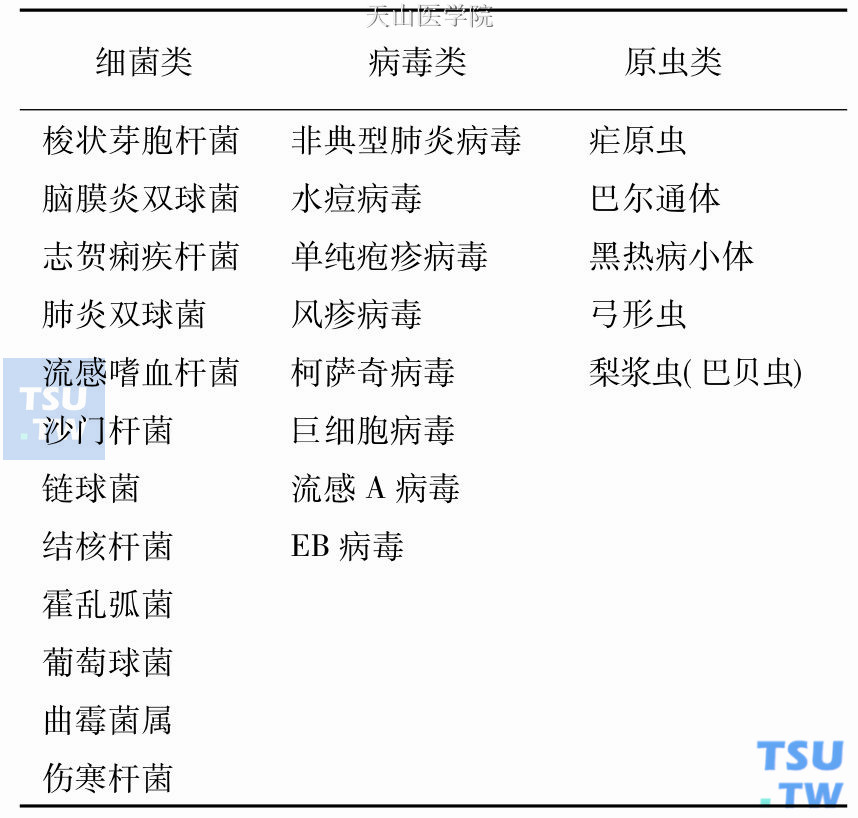
(1)细胞内的病原微生物对红细胞的直接破坏作用:
常见的病原微生物为:
1)疟疾:感染人体的疟原虫有4种,即间日疟、三日疟、恶性疟及卵形疟原虫。它们均能生成裂殖体通过红细胞表面特殊抗原黏附到红细胞上,穿过细胞膜进入细胞内。裂殖体在细胞内代谢产物可使红细胞产生突起、变形,很容易与血管内皮细胞和其他红细胞黏附,在脾脏被单核-巨噬细胞识别而被吞噬破坏。同时,长期感染疟原虫,可刺激脾脏肿大。恶性疟感染时偶可发生黑尿热,即急性溶血合并血红蛋白尿,发生肾功能衰竭。
2)梨浆虫(巴贝虫)病:属在红细胞内寄生的动物传染病。本病由硬蜱传播,偶可感染人类而寄生于人红细胞内。引起高热、溶血性贫血、血红蛋白尿、黄疸及肾功能衰竭。脾切除患者感染后死亡率高。
3)巴尔通体病:巴尔通体通过白蛉传播,进入人体后吸附在红细胞表面,亦可穿透红细胞膜,使红细胞变形性降低,脆性增加,在肝、脾被单核-巨噬细胞吞噬破坏。
4)严重细菌感染:例如梭状芽胞杆菌性脓毒血症常发生严重急性溶血性贫血。这种细菌可分泌α溶血素,其中卵磷脂酶可水解红细胞表面的卵磷脂蛋白,使细胞膜脂质破坏,膜变形性降低,红细胞形成球形,易在脾脏内被单核-巨噬细胞吞噬破坏。其他严重的革兰阳性和阴性细菌所致的败血症,细菌性心内膜炎也可引起急性血管内溶血。
(2)免疫机制参与的溶血性贫血:许多与感染有关的溶血性贫血有免疫机制参与,常分为以下3种:
1)自身免疫性:病原微生物或其产物刺激机体产生特殊抗体,与红细胞表面的某种蛋白结合,导致自身免疫溶血性贫血。刺激抗体产生的因素不需要持续存在。溶血性贫血可分为IgM型血管内溶血,为冷抗体型;IgG型血管外溶血型,多为温抗体型。大部分感染诱发的自身免疫溶血性贫血为冷抗体型,又称冷凝集素病。最常见冷凝集素病的原因为支原体肺炎和EB病毒感染所致传染性单个核细胞增多症,二者分别针对红细胞表面I、i抗原的IgM型抗体,抗原抗体结合后,固定补体,产生溶血。其他可以引起冷凝激素病的感染包括腮腺炎、巨细胞病毒、军团菌等。
阵发性寒冷性血红蛋白尿:见于先天性和后天性梅毒,可产生当-兰(Donath- Landsteiner)抗体,为针对红细胞表面P抗原的IgG型抗体,在寒冷环境下发生阵发性寒冷性血红蛋白尿。患者常生活在温暖气候地区,到寒冷地区环境下发病,临床上突然出现苍白、黄疸、血红蛋白尿、脾大。其他可引起寒冷性血红蛋白尿的感染包括麻疹、疫苗注射、腮腺炎、传染性单核细胞增多症等。
2)“无辜旁观者”型:其发生机制是感染的病原微生物或抗感染药物作为抗原刺激机体,抗原抗体结合后吸附在红细胞表面,固定补体产生溶血。可发生在儿童流感嗜血杆菌引起的脑膜炎,此外,抗感染的药物如奎尼丁、奎宁、磺胺、吡哌酸等药物亦可引起此型贫血。
3)多凝集素性:正常红细胞上T抗原被糖原所掩盖,感染后红细胞上糖原被细菌产生的酶水解,使T抗原暴露出来,可与血浆中的多种抗体结合,如IgG型抗体可使红细胞聚集最终发生溶血。
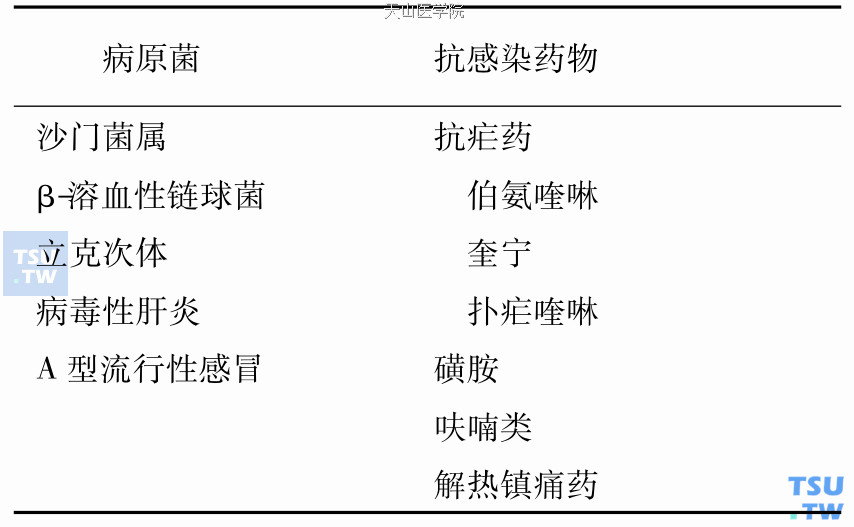
(3)感染加重红细胞内酶缺乏所致溶血:红细胞依靠还原酶来对抗病原微生物和药物氧化作用。而葡萄糖-6-磷酸脱氢酶(G6PD)是红细胞内主要的对抗氧化作用的还原酶,参与红细胞内葡萄糖磷酸戊糖旁路代谢,使细胞内生成的还原型谷胱甘肽(GSH)维持在稳定水平。GSH具有保护血红蛋白不被氧化作用。G6PD缺乏患者感染时,中性粒细胞产生大量过氧化物及抗感染的一些药物的直接氧化作用,均可使血红蛋白变为正铁血红蛋白;由于G6PD缺乏,正铁血红蛋白与过氧化氢作用,珠蛋白与血红蛋白分离形成Heinz小体。Heinz小体吸附于红细胞膜上,使膜变僵硬,易在脾脏被单核-巨噬细胞破坏发生血管外溶血。常见G6PD缺乏患者感染时诱发溶血性贫血的病原菌和药物见下表。
G6PD缺乏患者感染时诱发溶血性贫血的病因
(4)病理改变所致溶血性贫血:
见于感染直接或间接所致的组织损伤和变性,如溶血尿毒症、弥散性血管内凝血、细菌性心内膜炎、脾功能亢进。溶血尿毒症综合征常发生在年轻人和儿童、婴幼儿。常在患非特异感染后发生急性溶血、尿毒症和血小板减少。病原菌常为分泌血管毒素的大肠杆菌、志贺痢疾杆菌和肺炎链球菌。
在人工心脏瓣膜置换术后,风湿性心瓣膜病、弥散性血管内凝血、脾功能亢进等病理时均可使红细胞破坏增加。
发病情况和临床表现
1.发病情况
感染性贫血的发生率依病原微生物种类不同,感染轻重不同及病程长短报告不一。急性感染性贫血其发生机制主要为急性溶血性贫血,其发生因病原微生物不同,机体有无自身红细胞结构、功能缺陷而不同。但在目前抗生素普遍应用的情况下,急性感染所致的溶血性贫血发生率已明显下降。慢性感染所致贫血国外报告发生率在22%~50%,国内缺乏系统统计资料,但据近10年主要内科杂志报告不同病种分别占16%~65%。
2.临床表现
(1)急性感染合并的贫血其症状和体征与一般贫血症状类似,但溶血与失血常是突然发作,溶血发作有时呈暴发型。由于大量的红细胞在血管内破坏,患者贫血可非常严重,常有明显的腰痛及肢体酸痛、头痛、胸痛、憋气、寒战、高热、明显血红蛋白尿。体检可发现明显黄疸,脾脏可肿大。血清呈深红色。严重者可发生休克、少尿甚至无尿。上述贫血症状常与急性感染症状合并存在。
(2)慢性感染合并的贫血其临床表现常被原发病掩盖,贫血本身并无特殊症状,其症状轻重与贫血程度有关。常有疲乏、心悸、气短、纳差、面色苍白等。此外,感染本身可引起发热、恶寒、肝脾肿大等。
实验室检查
急性感染所致的贫血
(1)血常规:据感染轻重不同贫血程度不一,可以从轻度贫血至严重贫血。贫血为正细胞正色素性贫血。外周血涂片据感染不同可能有不同血细胞形态特点,如:疟疾可在血片中找到疟原虫;溶血发作时可见有破碎红细胞、小球形等异形红细胞。白细胞计数常增高,但亦有减低者。中性粒细胞可有核左移,细胞出现中毒颗粒、空泡、Dohle小体等。血小板计数可正常或减少。
(2)溶血有关检查:血清总胆红素和间接胆红素增加,游离血红蛋白增加,结合珠蛋白减少,在有免疫机制参与的溶血性贫血者Coombs试验可阳性,可分IgG和IgM两型。亦可Coombs试验阴性,如抗感染药物所致溶血性贫血。
慢性感染所致贫血
(1)血常规:虽然贫血分类为正细胞、正色素性贫血,但许多患者表现为低色素性贫血,血片中红细胞轻度大小不等,中心淡染,红细胞平均血红蛋白低于31pg,平均红细胞体积低于80fl。白细胞、血小板值不恒定。
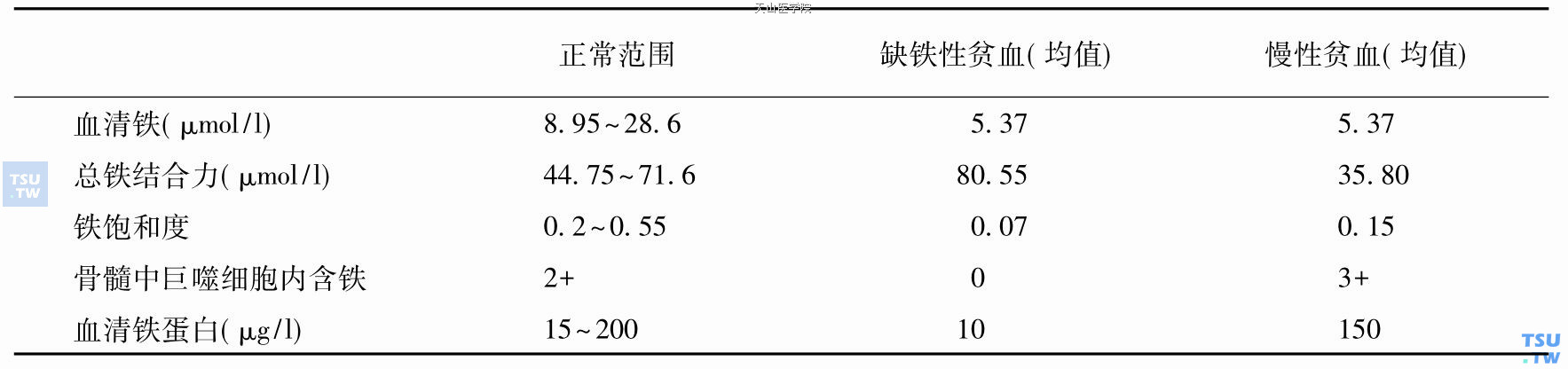
(2)铁代谢:慢性感染性贫血机制属慢性病贫血,其铁代谢特点为血清铁,铁饱和度降低,总铁结合力下降,血清铁蛋白正常。其与缺铁性贫血的鉴别见下表。感染发生后,血清铁迅速下降,而总铁结合力则在8~12天后开始下降。血清铜则升高,有一定辅助诊断价值。
铁代谢特点
(3)骨髓:有核红细胞及骨髓粒/红细胞比例大致正常,无明显红系增生表现。铁粒幼细胞减少,单核巨噬细胞内铁储存量增加。
(4)红细胞寿命缩短:用51铬标记红细胞测定其寿命缩短。
诊断与鉴别诊断
感染性贫血的诊断除具备上述有关的贫血诊断依据外,必须除外其他原因所致的贫血,如肿瘤、慢性肾功能衰竭所致贫血等,最关键是具备引起贫血的原发感染性疾病的诊断。以下几种疾病需要与本病鉴别:
1.稀释性贫血:骨髓瘤和巨球蛋白血症患者,其血浆容量增多,可导致稀释性贫血。
2.非感染性慢性失血和铁吸收不良:除感染引起失血外,感染性贫血与慢性失血及铁吸收不良的鉴别依靠以下几点:①转铁蛋白:前者下降,后者升高;②血清铁蛋白:前者正常或增加而后者减少;③试验性补充铁剂:对于慢性感染性贫血无效,对缺铁性贫血有明显疗效。
3.慢性肾衰所致贫血:血清铁正常或升高,血清尿素氮和肌酐升高。
治疗
最重要的治疗方法为 消除病原体,治疗原发感染性疾病,如原发病治愈,贫血可自然逐渐纠正。如在病原体治疗中贫血无明显改善或病人有明显贫血产生的并发症,如冠心病患者心绞痛发作、严重乏力和体力下降,可采用以下治疗:①红细胞输注,适用于中、重度贫血患者;②EPO适用于慢性感染不易治愈及伴有溶血,血红蛋白低于100g/L者,50%以上患者可使血红蛋白升高20g/L以上。用法:开始150U/kg,每周3次,应用4周以上,如无效可加至300U/kg,每周3次,如再用6~8周无效,继续加量大多无效。待血红蛋白升至120g/L以上可减量维持。长效EPO,可每2~4周1次,减少注射次数;③注意合并其他原因所致贫血:如缺铁、尤其EPO应用后可使血清铁进一步下降,注意补充。
预后
感染性贫血预后取决于原发病,如原发病治愈,贫血常能自行纠正,预后良好。但如慢性感染长期不愈,贫血常不能完全纠正,其预后取决于原发疾病的预后。
