卵巢肿瘤可发生于正常情况下无内分泌功能的间胚叶组织,如结缔组织、脉管组织或肌细胞,更可来源于卵巢的激素分泌细胞,如粒层细胞、卵泡膜细胞、Sertoli细胞、Leydig细胞、无性细胞、生殖细胞、性腺母细胞、Walthard细胞残余、妊娠黄体化的卵泡膜细胞及卵巢甲状腺组织等。这些肿瘤细胞除可存留正常细胞时的激素合成、分泌功能外,还可表达一些非生理性激素性物质,称激素分泌性卵巢肿瘤。
卵巢中激素分泌性肿瘤主要为性索间质肿瘤、生殖细胞肿瘤和性母细胞瘤等。多数情况下,肿瘤的组织学特征与来源组织的形态相似,但往往出现与胚胎期类似的性腺胚芽内的某些结构成分,有些具有性激素或胎盘激素分泌功能。例如,来源于卵巢特殊间叶组织的肿瘤具有分泌性激素功能,出现女性性早熟、女性性腺功能减退或男性化的临床表现。
单凭形态学特征往往不能反映卵巢激素分泌性肿瘤其激素分泌的生物学行为,需结合其他的一些方法协助诊断:
- 特异性抗体标记细胞:如用抗抑制素/活化素的βA亚基抗体、抗抑制素α亚基抗体和抗CD99单克隆抗体可标记卵巢粒层细胞,协助卵巢性索-间质细胞肿瘤的诊断,其中以检测抑制素α亚基的特异性最高。如与CD99单克隆抗体联合应用,可提高鉴别诊断效率。
- LOH检测:遗传性卵巢肿瘤与X染色体的基因丢失(杂合子)有关,约4%的卵巢癌细胞发生X染色体的杂合子缺失(loss of heterozygosity,LOH)。肿瘤细胞Xp22.2-3区LOH发生率可达40%。
- AFP测定:原发性肝细胞癌和生殖细胞癌常伴血清α-胚胎蛋白(AFP)升高。卵巢的双重分泌性肿瘤偶可分泌大量AFP。
- 其他方法:有很多,如卵巢肿瘤相关性癌基因和抑癌基因检测,APUD细胞生长抑素受体标记,LH、FSH、雌激素受体(ERα 和ERβ)、雄激素、孕激素、生长因子受体及其基因检测和G蛋白α亚基突变检测等。
性索间质肿瘤由卵巢颗粒细胞和卵泡膜细胞及间质细胞构成
细胞成分单一或混合出现,常具有激素分泌功能,出现雌激素过多或雄激素过多的临床表现(约占1%~5%)。α-抑制素(alpha-inhibin)可作为性索间质肿瘤的标志物,协助诊断。钙视网膜蛋白(calretinin)也是卵巢性索间质肿瘤的一种新的标志物,它能补充、但不能取代α抑制素在卵巢性索间质肿瘤诊断中的作用。
颗粒细胞瘤可分为幼年型及成年型两类。幼年型者,有非典型性卵泡结构、无Call-Exner小体;成年型粒层细胞瘤细胞可表达波形蛋白,而不表达角蛋白。所有的颗粒细胞瘤具有恶性潜能,10%~50%的患者可复发。因此,需长期随访。单一性卵泡膜细胞瘤仅见于单侧卵巢,苏丹Ⅲ染色有橘红色类脂质小滴,无成纤维细胞。粒层细胞瘤或卵泡膜细胞瘤均可有程度不等的黄素化(luteinization),类似于正常的黄体细胞,苏丹Ⅲ染色胞质内有类脂质小滴,黄素化粒层细胞或卵泡膜细胞可产生大量雄激素(引起男性化表现)及一定量的孕激素。瘤细胞产生大量雌激素,刺激子宫内膜,导致内膜增殖甚至子宫内膜癌。
硬化性卵泡间质细胞瘤(SST)少见,主要见于年轻女性,临床上没有特异性症状。组织学上可见肿瘤的细胞组成不一,血管丰富,有被假小叶分隔的多细胞区和少细胞区,局部有硬化。肿瘤中含有黄素化卵泡膜样细胞(luteinized thecalike cells)、梭形成纤维细胞和原始间叶细胞。
支持细胞-间质细胞肿瘤(SLCT),亦称睾丸母细胞瘤或男性母细胞瘤(arrhenoblastoma),罕见,多发生于生育年龄女性,偶见于儿童和绝经后妇女。临床表现为继发性闭经及多毛等男性化症候群。SLCT的激素分泌功能可能有下列数种情况:
- 无性激素分泌功能;
- 仅分泌雄性激素,出现女性男性化表现;
- 仅分泌雌性激素,无症状或有女性性早熟表现;
- 雌激素、雄激素均分泌,有或无临床表现;
- 单纯性Leydig细胞瘤(亦称门细胞瘤,Hilus cell tumor)。
SLCT可分为高分化型、中等分化型、分化不良型、分化不均一型和网状型等五种组织学类型。但在形态学上,仍约有10%的SLCT很难归入上述五种类型中。Seidman等建议将这些SLCT粗略地分为两大类:①主要由原始梭形细胞组成;②主要由性索细胞、粒层细胞和Sertoli-Leydig细胞组成。这些细胞的分化程度可不一致。SLCT的治疗和预后主要取决于患者的年龄、肿瘤的分期及分化程度。
无性细胞瘤具有假两性畸形伴雌激素降低或血清抑制素升高表现
无性细胞瘤(dysgerminoma)是比较常见的卵巢恶性生殖细胞肿瘤,好发于年轻女性(10~25岁),预后较好。患者可表现为女性假两性畸形,雌激素水平正常或降低,血清抑制素升高,染色体核型为46,XX、46,XY或46,XY/46,XX嵌合体,可发生于同胞姊妹或母女两代。
病理特点:瘤细胞常排列成巢状、片状或索状,分为大细胞型及小细胞型两类。前者为形态较为一致、胞质丰富的大圆形细胞;后者为密集的核圆、深染、胞质少的小圆形细胞。无性细胞瘤本身无激素分泌功能,合并绒毛膜癌时,血HCG升高;合并内胚窦瘤时,血AFP增高。
恶性卵黄囊瘤多见于婴儿及青少年
恶性卵黄囊瘤亦称内胚窦癌(endodermal sinus tumor),为生殖细胞肿瘤的一种,多见于婴儿及青少年,恶性度高,易转移,预后差。该肿瘤主要发生于性腺,亦可发生于性腺外组织,如前列腺、后腹膜、纵隔、松果体、盆腔、肝脏和骶尾部等处。绝大多数患者无内分泌功能障碍。病理诊断应以出现疏松网状结构、透明小球、基膜样物质、腺泡状或囊状结构为主要依据,AFP明显升高,其滴度可达到原发性肝癌水平。
绒毛膜癌分泌大量HCG
卵巢的绒毛膜癌起源于生殖细胞,恶性程度高,常早期转移。发生于青春期前的患者有性早熟及类似于异位妊娠的表现,血HCG明显升高。癌细胞除表达HCG外,还可有角蛋白、LK26阳性反应。生殖细胞来源的绒毛膜癌极少为单纯性的,多数混合着其他肿瘤性生殖细胞成分如不成熟性畸胎瘤和无性细胞瘤等。
性腺母细胞瘤影响性腺发育
多发于儿童或年轻患者,临床上出现性发育异常、原发性闭经和不育等,个别病例可表现为性早熟或间歇性阴道流血。染色体检查示多数患者存在Y染色体,半数病例的核型为46,XY,少数为46,XY/45,XO,或其他不同组合的嵌合体,故可合并隐睾或尿道下裂。
镜下肿瘤细胞呈巢状分布,其特点为:
- 生殖细胞呈大圆形,胞质丰富透明,核深染、圆形居中,似无性细胞瘤的肿瘤细胞;
- 支持或颗粒样细胞排列呈滤泡状,腔隙内含有嗜酸性透明物质,似Call-Exner小体;
- 肿瘤内含多量典型的巨大钙化灶。
性腺母细胞瘤常伴发无性细胞瘤,10%的病例伴恶性生殖细胞瘤的成分。在一定条件下,性腺母细胞瘤可转型为无性细胞瘤。
围绝经期及绝经后黄体瘤合成雄激素
因闭锁卵泡中黄素化卵泡膜细胞增生所致。瘤细胞可合成雄激素,一般无临床表现,卵巢肿块增大迅速者应早期手术治疗。
卵巢甲状腺肿
甲状腺组织异位于卵巢与其他部位的异位甲状腺肿有本质上的区别。卵巢甲状腺肿(struma ovarii)多发生于育龄女性,一般无症状,少数可合并颈部甲状腺肿大,约15%有甲亢表现,可先用重组的人TSH(rhTSH)刺激肿瘤细胞,然后用131I治疗(包括原发灶和转移灶)。
卵巢甲状腺肿多为单发,肿瘤为实体性,包膜完整。肿块内可部分或全部为甲状腺组织,偶可囊性变、出血、坏死或纤维化。镜下所见的甲状腺组织较成熟,滤泡大小不一,滤泡腔内类胶质物多,PAS染色阳性。有时可见滤泡上皮增生或腺瘤样结构,有些瘤组织中可有硬化性甲状腺炎样病变或自身免疫性甲状腺炎样改变。
卵巢甲状腺肿多为良性病变,偶为恶性(卵巢甲状腺癌),并易发生早期转移。
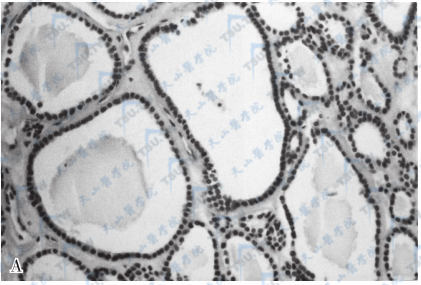
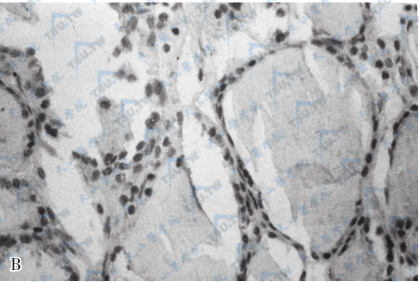
卵巢甲状腺肿
注:A:卵巢内含甲状腺滤泡,大小不一,滤泡腔内含胶质(HE,×200)。B:切片的甲状腺球蛋白染色阳性(SP,×200)
多囊卵巢综合征伴有白膜增厚/纤维化/囊肿
多囊卵巢综合征(poly cystic ovary syndrome,PCOS)以慢性无排卵、高雄激素血症、闭经、多毛、肥胖、卵巢增大和卵巢多发性小囊肿形成为特征。卵巢较正常增大2~5倍,表面多隆起,灰白色,切面见卵巢白膜明显增厚,卵巢内有多个大小不等的囊腔(图2-9-14),内含清亮液体。镜下可见白膜明显增厚、纤维化,白膜下方有多发性囊肿,皮质内可见多数闭锁卵泡,卵泡膜内层细胞显著增生,黄素化,一般无黄体,白体较多。用免疫组化方法可鉴定出卵泡膜内层细胞可产生大量雄激素。
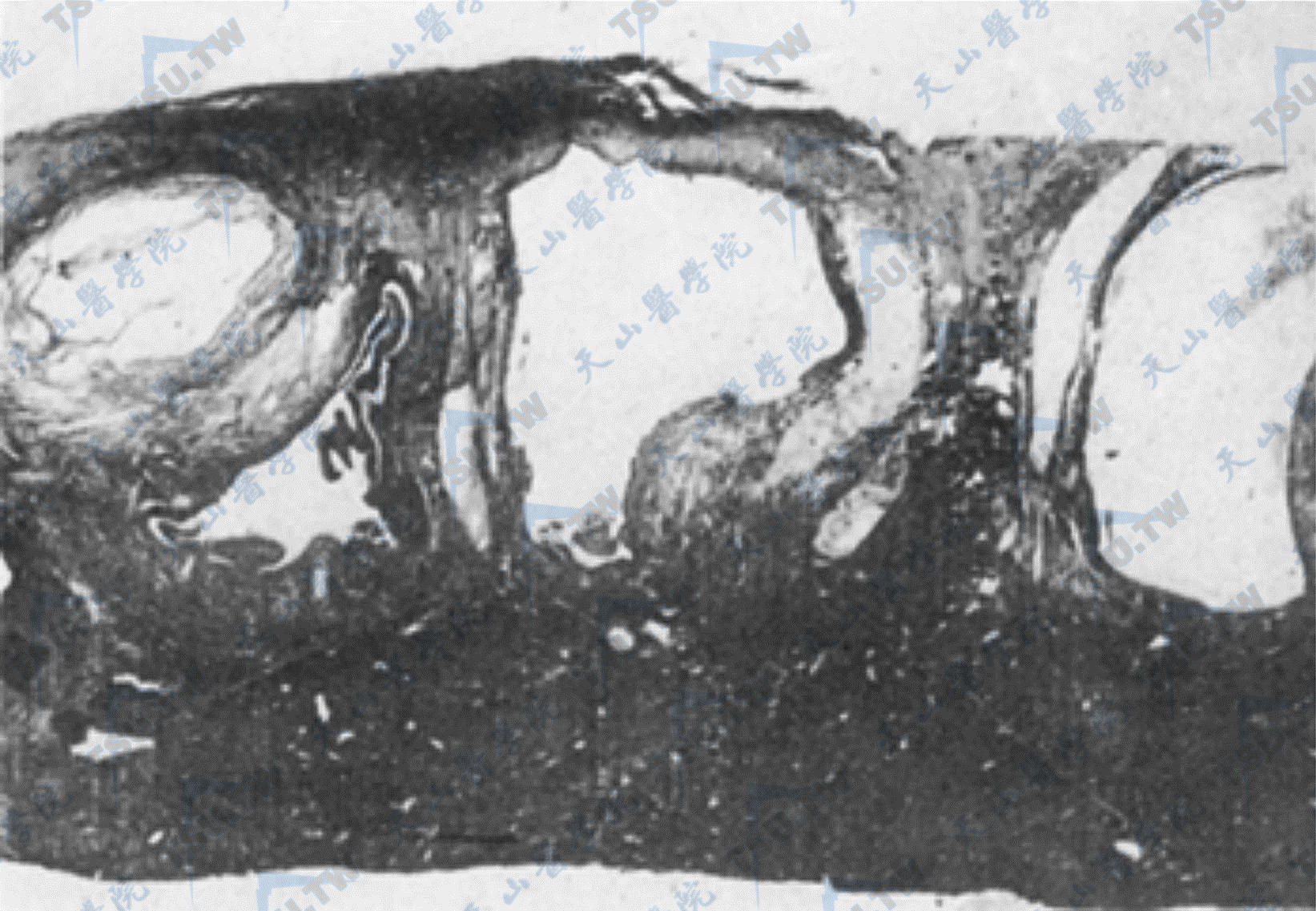
多囊卵巢综合征
注:显示卵巢内多个大小不等的囊腔
