按病因分类毛发增多症
毛发增多症的病因分类见下表,涉及遗传因素、感染因素、营养因素、内分泌因素和环境因素等。毛发的异常表现在外观、数量、粗细和质地等方面。女性多毛主要见于以下几种情况。
毛发增多分类

- 雄激素依赖性多毛:雄激素依赖性多毛(androgendependent hirsutism)的特点是毛发粗,色素深,位于男性毛发分布区。且多伴有皮肤痤疮、多皮脂和秃顶;如PCOS、先天性肾上腺皮质增生(11β-和21-羟化酶缺陷症)、肾上腺雄性化肿瘤、Cushing病、表观皮质素还原酶缺陷症、卵巢分泌雄激素瘤、肢端肥大症、胰岛素介导性假肢端肥大症和儿童型甲减(多在背部,病因不明)等。
- 内分泌代谢疾病引起的多毛:常见于肢端肥大症、Cushing综合征、先天性肾上腺皮质增生症、分泌雄激素的肾上腺皮质肿瘤或卵巢肿瘤、血卟啉病、甲减等。
- 非内分泌代谢疾病所致的多毛:主要有先天性毳毛增多症、先天性毛痣(congenital hairy naevus)、先天性脊柱裂、Hurler综合征、Cornelia de Lange综合征和慢性皮肤炎症。
- 药物性多毛:引起多毛的药物主要有雄激素、ACTH、糖皮质激素、口服避孕药、苯妥英钠、二氮嗪(diazoxide)、长压啶(minoxidil)等。药物性多毛:较常见,如苯妥英钠、丹那唑、环孢素等。
- 特发性多毛:病因未明,以前臂、小腿、上唇两外侧、下腹正中线、乳晕等处的毛发增多为主,偶在下颏也有少数终毛。
- 生理性多毛:如妊娠期、慢性营养不良症、低体重儿等,一般为一过性,无重要临床意义。
- 局限性毛发增多:主要见于胫前黏液性水肿、A型胰岛素不敏感综合征及其变异型(黑棘皮病,acanthosis nigricans)。
综合分析女性多毛的病因
女性多毛症的诊断和鉴别程序见下图。首先,多毛和男性化的发病年龄与进展速度能提供有价值的鉴别依据。例如,肾上腺雄激素分泌瘤和卵泡膜细胞增殖症(hyperthecosis)的病情进展迅速,男性化明显;而一般PCOS、先天性肾上腺皮质增生症、Cushing综合征、糖皮质激素抵抗综合征的病情进展缓慢,男性化持续多年并无明显加重。在实验室检查方面,应先测定血睾酮总量,如血睾酮总量<0.6ng/ml,且月经正常,没有必要做进一步检查。如血睾酮总量≥0.6ng/ml,伴闭经或月经稀少,应先测定血TSH和PRL,以排除高PRL血症,并用B超进一步排除PCOS。高度怀疑先天性肾上腺皮质增生症时,应加测血17-OHP或做进一步的肾上腺影像检查。如果除血睾酮轻度升高外,其他检查均正常,则PCOS的诊断基本成立。
卵巢雄激素分泌瘤
引起多毛的卵巢疾病的共同特点是卵巢分泌的雄激素增多;主要见于3类疾病:①PCOS:有多毛、月经不调、肥胖和不排卵,严重者可发展为滤囊泡膜细胞增殖症(hyperthecosis,sclerocystic ovarian polycystic ovarian syndromes),阴蒂增大与严重胰岛素抵抗有关;②分泌过多雄激素的卵巢肿瘤:如粒层-泡膜细胞瘤、卵巢男性细胞瘤、门细胞瘤、卵巢肾上腺细胞瘤和性腺母细胞瘤等;③绝经后高雄激素血症:伴多毛的绝经后妇女如果检查不出雄性化肿瘤,其最大可能是门细胞增生。
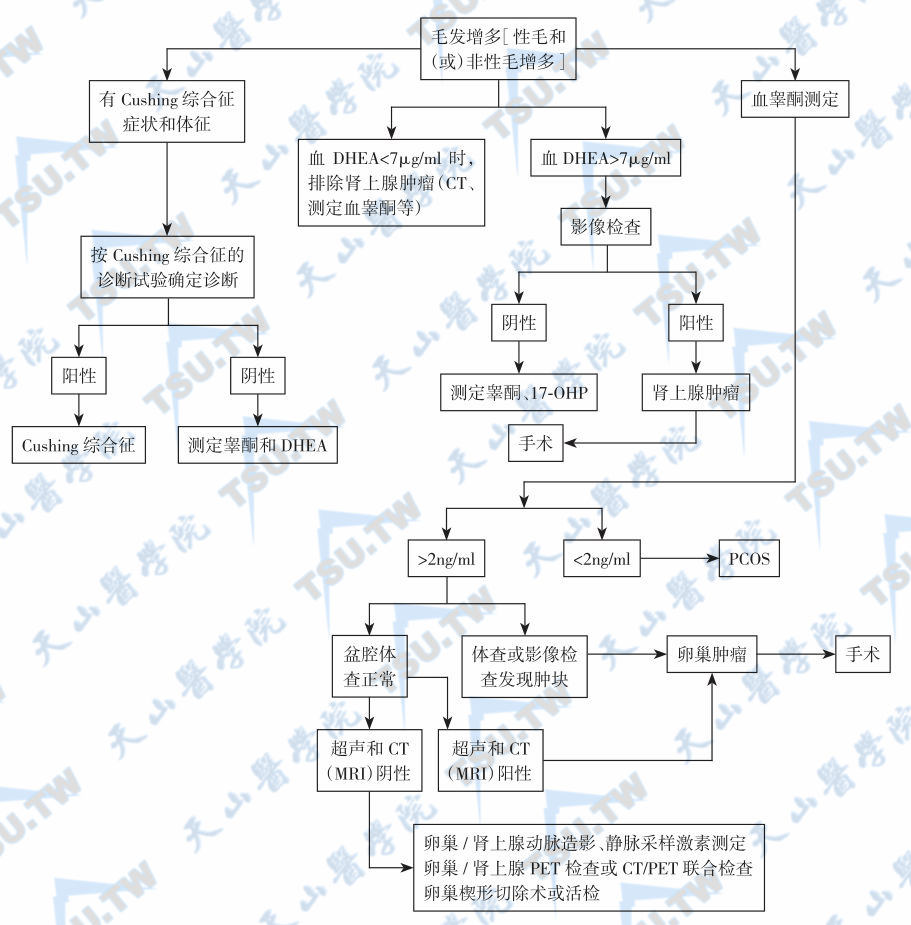
女性多毛和毛发增多症的诊断和鉴别程序;注:DHEA:脱氢异雄酮;17-OHP:17-羟孕酮;PCOS:多囊卵巢综合征;PET;正电子发射断层扫描
一般认为,血睾酮明显升高(≥3倍或≥2ng/ml)或血DHEAS≥8μg/ml是提示卵巢和肾上腺的雄激素分泌瘤的有力依据。但应注意以下3点:①肿瘤的雄激素分泌为阵发性的,故最好多次测定;②多种雄激素同时升高是卵巢与肾上腺的雄激素分泌瘤的重要特点,因而应同时测定睾酮、DHEA、DHEAS和雄烯二酮;③仅雄激素轻度升高更支持PCOS的诊断,而卵泡膜细胞增殖症(hyperthecosis,即重型PCOS)可伴有多种雄激素显著升高。引起雄激素分泌的卵巢肿瘤主要有Sertoli-Leydig细胞瘤(高发年龄为30~40岁,体积大)、门细胞瘤(主要见于绝经后妇女,体积小)或类脂质细胞瘤(lipoid cell tumor),偶尔见于粒层细胞瘤(granulosa-theca tumors),这些肿瘤的病理本质是上皮源性囊腺瘤(epithelial cystadenomas)或囊腺癌(cystanocarcinomas),其分泌的细胞因子刺激邻近的非肿瘤细胞,产生大量的雄烯二酮(约5%转化为睾酮)。经阴道B超有助于发现卵巢肿瘤。
肾上腺雄激素分泌瘤
罕见。其功能与卵巢门细胞瘤相似,而形态特征类似于Leydig细胞;这种肿瘤可为恶性及良性,多毛症及雄性化明显。多发生于2岁以后,新生儿少见。女孩于青春期前阴毛发育、阴蒂肥大,青春期无月经,乳腺不发育。成年女性发病者以多毛为主,嗓音变粗,前发际后退,阴蒂肥大,性欲亢进。血与尿雄激素及其代谢产物增高。少数肿瘤亦分泌去氧皮质酮,患者有低血钾和高血压。因受LH与HCG的调节,因此外源性LH可抑制睾酮的分泌而HCG能刺激其分泌。此外,肾上腺雄激素分泌瘤可分泌大量去氢异雄酮(DHEA)、去氢异雄酮硫酸盐(DHEAS)和雄烯二酮,而睾酮是由外周组织生成的,因而测定血DHEAS对诊断有重要意义。同时也是其与PCOS鉴别的要点,如果血DHEAS≥8μg/ml,即使患者的病程长或缺乏男性化表现,亦强烈提示肾上腺雄激素分泌瘤而非PCOS。经腹腔B超、肾上腺CT和MRI有一定的鉴别意义,如仍为阴性,可考虑做碘标NP-59(iodomethylnorcholesterol,碘化去甲胆固醇)扫描检查。
垂体肿瘤
垂体肿瘤引起的毛发增多主要见于GH瘤、PRL瘤和ACTH瘤。
产生过多雄激素的非肿瘤性肾上腺疾病
主要包括各种类型的先天性肾上腺皮质增生症、Cushing综合征和糖皮质激素抵抗综合征等,见第17章第160节。
- 21羟化酶缺陷症和11β-羟化酶缺陷症:在先天性肾上腺皮质增生症中,21羟化酶缺陷症占90%。本病属常染色体隐性遗传,其突变基因定位于6号染色体与HLA-B紧密联系。由于21羟化酶缺陷,17α-羟孕烯醇酮和17α-羟孕酮不能转变为皮质醇,而孕烯醇酮和孕酮不能转化为醛固酮。由于皮质醇缺乏,垂体分泌ACTH增多,从而导致肾上腺皮质增生。雄激素合成不需要21羟化酶参与,因而雄激素过多。因ACTH分泌增多而有色素沉着,外阴色素加深。女孩于2~3岁时发现有多毛、阴蒂肥大或两性畸形及色素沉着。男孩有多毛、阴茎肥大及色素沉着。5~6岁时,上述症状更为明显,并且对生活、心理和行为有明显的负面影响。雄激素过多引起异性好感与追求、甚至发生性冲动和性行为。
- 11β-羟化酶缺陷症:因11-去氧皮质醇和去氧皮质酮不能羟化引起皮质醇不足、ACTH分泌过多、肾上腺皮质增生、肾上腺雄激素过多、皮质酮和醛固酮过少和去氧皮质酮过多。本病亦有多毛及雄性化。由于去氧皮质酮增多,起保钠排钾作用,故有高血压与低钾血症。
- Cushing综合征:以肾上腺分泌皮质醇为主,但也分泌雄激素,故有多毛。皮质醇过多致向心性肥胖、满月脸、多血质、皮肤紫纹。也可伴有高血糖和低血钾。
- 表观皮质素还原酶缺陷症:表观皮质素还原酶缺陷症(apparent cortisone reductase deficiency)表现为阴毛初现和骨龄提前,血清雄激素升高,但可被DXM抑制。因皮质素不能还原为皮质醇,皮质素明显升高,而血皮质醇降低,刺激垂体分泌过多的ACTH,故患者有肾上腺皮质增生和慢性原发性ACI表现。
PCOS
是引起育龄妇女多毛的常见原因。随着检测技术的发展,人们认识到多囊卵巢并非一种独立的疾病,而是一种多病因且表现极不均一的临床综合征。PCOS的主要临床表现为月经失调、多毛、肥胖及不育。多数月经不规则、经量稀少或闭经,少数月经正常但无排卵,而个别出现功能性子宫出血。痤疮与多毛一般自青春期开始,部分病例在肥胖和胰岛素抵抗基础上并发代谢综合征、血脂异常、阻塞性睡眠呼吸暂停、心血管事件。但是,非典型PCOS可能只有闭经、肥胖和多毛表现;有时,患者仅有多毛而无PCOS的其他相关表现,这些病例往往处于PCOS的早期阶段,随后出现月经失调及不育。
特发性多毛
多见于某些人种(如地中海居民),月经正常,血睾酮正常,缺乏男性化的症状与体征,多毛的原因主要与皮肤的5α-羟化酶活性增强有关。特发性多毛的判断标准是:①多毛;②血睾酮正常;③排卵正常,时间在进入月经黄体期的第7天(如按24天计算,相当于月经期的第17天;如月经周期为35天,则为月经期的第28天),其血孕酮水平在5ng/ml以上。如多毛女性伴有月经稀少或闭经,并排除了甲减或高PRL血症,那么最大的可能性即是PCOS。如诊断PCOS仍有疑问,应测定卵泡期的基础血17-羟孕酮水平,以排除非典型肾上腺皮质增生症(主要是21-羟化酶缺陷症)。
其他疾病
- 低体重儿:Neville等总结89例(女性7~9岁)阴毛早现的病因时发现,35%伴有低体重(smallness for gestational age,SGA),24%伴有性早熟、91%的体重增加,90%的阴毛早现者存在以上3个危险因素中的1个。因此,性早熟和SGA伴阴毛早现、超重/肥胖,而与出生时的体重或孕龄无关。
- 肢端肥大症和假肢端肥大症:由于垂体生长激素细胞瘤分泌过多生长激素而引致皮肤毛生长旺盛。生长激素亦可引致肾上腺皮质增生分泌雄激素而多毛。此种多毛用糖皮质激素治疗无效。胰岛素介导性假肢端肥大症表现为颌骨肥大、凸颌(prognathism)、肢端肥大、多汗、皮肤色素加深而粗糙(黑棘皮病,acanthosis nigricans)与声调低沉,但血清GH和IGF-1正常,而胰岛素、睾酮明显升高。
- 妊娠多毛:妊娠时由于胎盘激素作用可有多毛,但于分娩后多毛全部或大部分消失。再次妊娠多毛再现,并与上次妊娠残留多毛累积而更显著。如产后多毛仍明显,应排除肾上腺及卵巢疾病。
针对原发病和临床表现进行治疗
病因治疗是处理多毛症的基本原则(如治疗肾上腺或卵巢肿瘤,分别见第15章第115节和第116节及第17章第160节),其中PCOS的治疗见本章第153节。有人比较了二甲双胍与达因-35(Diane-35)对PCOS多毛的疗效,认为达因-35的降雄激素作用优于二甲双胍,而后者抑制胰岛素的作用优于前者。药物(如苯妥英钠、二氮嗪、类固醇雄激素,达那唑等)引起的多毛在停药后自然消退。
药物治疗对已经存在的毛囊增生、终毛与男性化无明显退化作用,因此不能凭此判断为无效。需在有效抑制雄激素分泌至少3个月后,用机械方法(如电溶)去除终毛,并做阴蒂肥大切除术。
口服避孕药
口服避孕药可抑制LH的分泌,增加TBG合成,从而降低血睾酮水平和雄激素前体的分泌量。一般应用含30~35μg的炔雌醇(ethinyl estradiol),以达到对LH的有效抑制。由于毛发的生长周期为3~6个月,短于半年的治疗不能获得明确疗效。
螺内酯
其结构与孕酮相似,可抑制性类固醇激素的合成,拮抗雄激素的作用,对5α-还原酶的抑制特别明显。螺内酯与口服避孕药的作用机制不同,如两药合用,对PCOS和特发性多毛有较好疗效;剂量50~400mg/d,一般100mg/d。如效果不佳,可每3个月(毛发的生长周期为3~6个月)增加25mg/d,直至最大量。如患者的肾功能正常,极少发生高钾血症;但肾衰者要密切观察血钾变化。
抑制雄激素活性的药物
- 醋酸环丙孕酮:醋酸环丙孕酮(cyproterone acetate)为17-羟孕酮(17-OHP)的衍生物,可与二氢睾酮(DHT)竞争雄激素受体,抑制雄激素的活性。如与炔雌醇合用,可明显抑制皮肤内的5α-还原酶活性。一般在月经周期的5~15天使用,每天50~100mg。炔雌醇应在月经周期的5~26天使用(30~35μg/d)。有时,重型病例亦可考虑苯氯孕酮、螺内酯和口服避孕药3药合用,而轻型患者用低剂量苯氯孕酮(2mg/d)和炔雌醇(35~50mg/d)治疗即可。
- 非那雄胺:非那雄胺(finasteride)抑制2型5α-还原酶活性,但对1型5α-还原酶无作用,主要用于治疗前列腺增生,亦可治疗多毛症(因对1型5α-还原酶无作用,其疗效较差)。一般用量为5/mg/d,治疗6个月后可见效。
- 非那甾胺与氟他胺:长期服非那甾胺(finasteride)可降低秃顶头皮中的二氢睾酮含量,1998年被美国FDA批准用于雄激素性脱发。临床研究证实,男性秃顶者口服非那甾胺1mg/d,连续12个月,头发生长状况明显改善,但局部给药显然优于全身给药,刺激秃顶头皮头发生长的作用可能更强。氟他胺(flutamide)拮抗雄激素的作用较强,主要用于治疗前列腺癌。治疗多毛症时可有相当效果,但可能诱发肝损害,全身给药可引起性欲减退、生精障碍和男胎女性化等。因此,局部给药具有重要意义。
- 其他治疗:激光脱毛可能有短期疗效,或用机械方法(如电溶)去除终毛,并做阴蒂肥大切除术。
