生精细胞凋亡的检测方法主要包括形态学检测、琼脂糖凝胶电泳、流式细胞术(FCM)、瑞-吉染色法、DNA切口标记法和DNA末端标记法(TUNEL)等。两种原位检测手段得到广泛应用,即DNA切口标记法和TUNEL法,两者的建立都有赖于凋亡细胞中DNA裂解片段的出现,前者是用末端转移酶,而后者应用DNA聚合酶,将生物合成的核苷酸序列连接到DNA链的断裂处,标记的DNA通过免疫组化的方法转为可视。值得一提的是,DNA链断裂也可能发生于坏死和自溶的过程中,综合检测以避免假阳性是必要的。
一、形态学检测
用光镜可观察到凋亡细胞体积缩小,染色质致密聚集成斑块状,细胞周围有环状带,细胞内出现凋亡小体。研究发现,热诱导大鼠生精细胞凋亡时,生精细胞内出现空泡,染色质边缘成月牙状,细胞中央呈现空白。电镜观察可见热诱导大鼠凋亡生精细胞胞质空泡化,核膜增厚,核周隙增宽,染色质浓缩附着于核边缘呈新月形图。严重者染色质固缩﹑断裂凋亡小体出现。
二、琼脂糖凝胶电泳
通过观察DNA梯状电泳带或定量检测DNA片段,可测定凋亡细胞DNA在核小体连接处规律性降解形成以180~200bp为最小单位的寡聚体片段,琼脂糖凝胶电泳时呈典型的梯状带,但有研究用琼脂糖凝胶电泳检测到青年男性生精细胞DNA迁移呈圆形,老年男性凋亡生精细胞DNA迁移呈彗星状。
三、FCM
可根据DNA、RNA含量分析细胞周期细胞表面标志和细胞受体,分析凋亡细胞的DNA裂解,FCM 的DNA图上呈亚二倍体核型峰特点,应用DNA染色剂穿透正常和凋亡细胞膜的能力及其与凋亡细胞DNA结合能力的不同以区分正常细胞﹑凋亡细胞,FCM还可定量检测凋亡标记蛋白的表达,吞噬凋亡细胞和未吞噬凋亡细胞的巨噬细胞群可利用带有荧光染料反应物的FCM区分。
四、瑞-吉染色法
瑞氏染料(伊红美蓝)是由伊红和美蓝混合组成的中性盐染料,其中伊红是酸性染料,其有色基团为阴离子,美蓝是碱性染料,有色基团为阳离子。这两种有色离子可以与细胞蛋白质选择性的吸附,进而使细胞呈现不同的着色,其中胞质中的碱性蛋白与伊红结合,称嗜酸物质,胞核的核蛋白等酸性蛋白质与美蓝结合呈紫红色,称嗜碱物质。吉姆萨染料由天青、伊红组成,其染色原理和瑞氏染色基本相同。吉姆萨染色法对细胞核着色较好,结构显示更清晰,而胞质和中性颗粒则染色较差,两者混合染色可兼两者之长。
试剂:
(1)瑞氏染液:每0.1g瑞氏染料加甲醇(AR)60ml,将瑞氏染料放在清洁干燥的研钵中,加少量甲醇,边加边磨,使染料溶解,如此反复,直至染料溶尽,置于棕色瓶中室温下保存一周后备用。
(2)吉姆萨染液:吉姆萨染料0.5g,甲醇33.0ml,纯甘油33.0ml,将染料先放入甘油中水浴2h,使其溶解,加入60℃预热的甲醇,混合后置于棕色瓶中室温下一周后备用。
(3)pH 6.4~6.8磷酸盐缓冲液
- 磷酸二氢钾 0.3g
- 磷酸氢二钠 0.2g
- 蒸馏水加至 1000ml
步骤:
- 检测对象用手淫法留取全部精液于清洁容器中,37℃恒温水浴30min,待精液液化后,1500r/min离心5min,弃去精浆,沉淀用生理盐水洗涤3次,离心涂片,晾干;用95%乙醇固定10min。
- 瑞氏-吉姆萨染液临用前按9∶1的比例新鲜配制。
- 将固定的涂片用瑞-吉染液染色30~60s,加等量磷酸盐缓冲液,染色10min。
- 镜检计数凋亡的生精细胞,依据以下标准判别凋亡细胞:细胞核染色质固缩,在核周聚集,呈境界分明的新月形或块状小体;胞膜皱摺或起泡(blebbing);出现界限分明的含或不含核物质的凋亡小体。依据文献所描述的特征区分生精细胞。观察全片,计数凋亡的精母细胞(包括初级精母细胞与次级精母细胞)、精子细胞,并计算其占同类细胞的百分比。
五、TUNEL法
DNA裂解为许多单或寡核苷酸片段是细胞凋亡的主要生化标志之一,这些离断的DNA序列可以通过末端核苷酸转移酶在其3′-OH末端结合上标记有荧光素的dNTP,然后通过荧光显微镜直接观察,或用标记有辣根过氧化物酶的抗荧光素抗体与其二次结合后和底物进行显色反应,用普通显微镜进行镜检。
操作步骤:
目前已有商品化的TUNEL检测试剂盒,其检测的特异性和敏感性都很好。其操作步骤如下:
- 检测对象用手淫法留取全部精液于清洁容器中,37℃恒温水浴30min,待精液液化后,1500r/min离心5min,弃去精浆,沉淀用生理盐水洗涤3次,离心涂片,晾干;用95%乙醇固定10min。
- 将固定的涂片用3%H2O2甲醇溶液封闭30min;
- 用TritonX-100通透细胞;
- TUNEL混合液孵育60min;
- POD转换液孵育30min;
- 加DAB底物显色;
- 镜检计数细胞凋亡率:观察全片,计数凋亡的精母细胞(包括初级精母细胞与次级精母细胞)及精子细胞(DAB着色的细胞为凋亡细胞),计算其占同类细胞的百分比。
结果分析:
20例正常生育男性检测结果如下:
- 瑞-吉染色法: 精母细胞凋亡率(
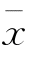 ±SD)%:1.4±0.9
±SD)%:1.4±0.9 - 精子细胞凋亡率(
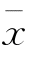 ±SD)%:1.7±0.8
±SD)%:1.7±0.8 - TUNEL法: 精母细胞凋亡率
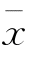 ±SD)%:4.3±1.8
±SD)%:4.3±1.8 - 精子细胞凋亡率(
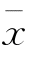 ±SD)%:4.3±2.6
±SD)%:4.3±2.6
引起细胞凋亡的原因很多,细胞生存与繁殖的必要信号的缺乏可引起细胞自杀,如生长因子的缺乏等。Shetty等用抗FSH血清免疫中和大鼠FSH,检测不同阶段细胞凋亡特征性的DNA片段表明,粗线期精母细胞对缺乏FSH最为敏感,精原细胞和精子细胞也出现不同程度的细胞凋亡,免疫中和LH则发现凋亡只出现于粗线期精母细胞和精子细胞,而精原细胞不出现凋亡。Mikim等利用GnRH拮抗剂处理成年雄性小鼠,发现细线前期、粗线期的精母细胞和精子细胞出现凋亡特征的形态学指标。上述研究从不同的角度说明了凋亡在抑制精子发生的过程中充当了重要的角色,同时也用凋亡作为一项指标来说明各种激素在精子发生过程中是如何发挥作用的。
Kenth等用乙基二甲基磺酸盐(EDS)通过杀伤成年老鼠Leydig细胞使精浆睾酮和睾丸内睾酮下降到不可检测的水平,生精细胞凋亡几乎涉及精子发生的各个阶段,而对处理组进行T治疗后凋亡显著受到抑制,说明T作为Leydig细胞的分泌产物,对于精子发生具有重要的作用。戈一峰等用超生理剂量的十一酸睾酮(TU)降低生育男性睾丸内睾酮的浓度,引起生精细胞的凋亡,使生精过程受阻于中晚期,即减数分裂和精子形成阶段,从而达到商学军抑制精子发生的效果。
