出生后乳腺的发育稍有不同,因为在此期间,它受全身类固醇激素和肽类激素的影响,同时也受局部生长因子的影响。这一部分着重叙述乳腺上皮细胞以及上皮细胞与基质的旁分泌相互作用。出生后乳腺的发育由4个阶段组成:导管形态发生(从第3~9周龄开始);妊娠期小叶和腺泡的增殖、分化;哺乳期合成和分泌乳蛋白和脂质;在断奶后分泌腺上皮细胞的复旧。每个阶段都依赖增殖、分化和凋亡的平衡。随着基因敲除和转基因小鼠模型的出现,激素、生长因子及细胞信号转导途径等在乳腺发育诸多阶段中的特殊作用逐渐清晰。
导管的形态发生
从出生到大约3周龄,动物乳房的原始导管树随着体重的增加而缓慢地等比例增长(图1-13F)。3周龄时,导管树尚未到达腹股沟淋巴结,脂肪垫的前1/3尚未形成。此时如果切除内生上皮,将导致脂肪垫被清除,这样就为乳腺上皮细胞的移植提供一个特别的场所。
青春期开始(约3周龄)时,由于垂体和卵巢合成的雌激素、孕激素和生长激素增加,导致原始导管上皮细胞迅速发育(图1-13G)。终端胚芽(terminal end bud, TEB)为多层棒状结构,其细胞增殖和凋亡的平衡调节着导管的形态发生(图1-13G、图1-14)。
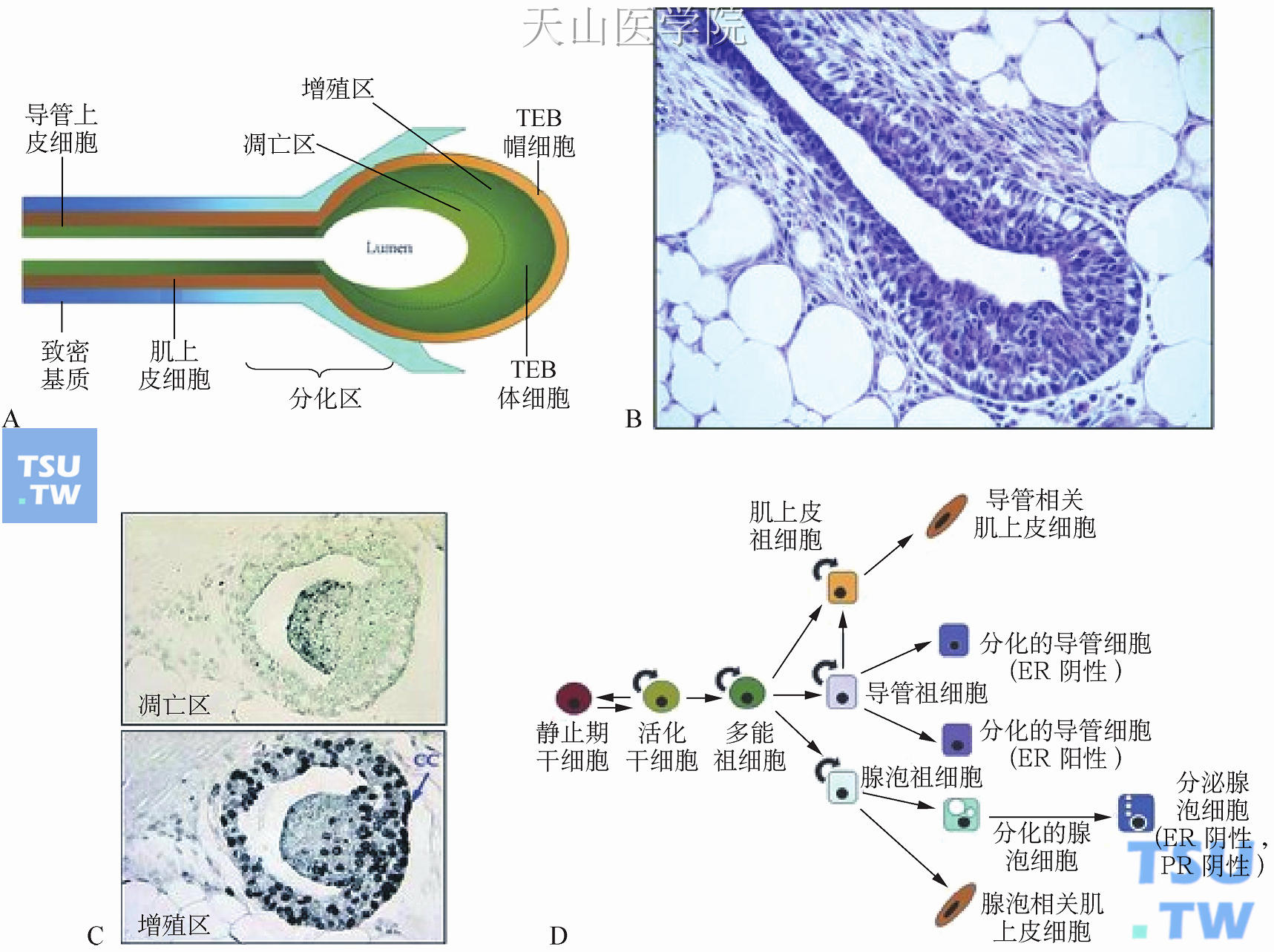
图1-14 终端胚芽和上皮细胞分化
注:A.终端胚芽和导管构成示意图。可见典型的细胞层,增殖区、凋亡区和分化区均可以辨认。B.终端胚芽的组织结构。C.凋亡区(上图)和增殖区(下图)分别通过原位末端标记法(Tunel染色法)和溴脱氧尿苷流式细胞动力学检测方法(BrdU染色法)进行鉴别(资料来源:Humphreys RC, et al. Development,1996,122:4013)。D.乳腺上皮细胞分化的假设模型。箭头标明了分化过程;圆箭头标明了自我更新能力。
TEB由两种上皮细胞构成(图1-14A、B)。最外层是帽状细胞,与位于终端胚芽末梢部分的基膜紧密相连。帽状细胞是TEB的祖细胞,可以分化为前导管上皮细胞(preluminal cell)和肌上皮细胞(图1-14C、D)。细胞增生主要发生在末梢细胞层(图1-14C、D)。帽细胞缺乏表达ER、PR、泌乳素受体(PRLR)及细胞间连接,因此它们没有极性。TEB最内层的细胞是体细胞,分化为导管上皮细胞。
体细胞可分为2个区域,即增殖区和凋亡区(图1-14A、C)。目前认为体细胞最内层区域发生凋亡是主要机制,从而形成只有一层导管上皮细胞的中空导管,bim1、bcl2、ptch1也参与此过程。这3个基因的突变会导致靠近TEB颈部细胞的不恰当阻截。8~9周龄时,这些导管延伸至脂肪垫的边缘,TEB消失,标志着导管形态发生结束(尽管在某些大鼠腺体中还可以看到一些终端胚芽,图1-13H)。
原始的腺体仍保持相对静止,直到开始妊娠或给予外源性激素如雌激素或孕激素。应用三维细胞培养模型,在富含层粘连蛋白的人工细胞外基质(extracellular matrix, ECM)中培养恶性或非恶性的乳腺导管上皮细胞,可能用于模拟导管腔的形成,并研究癌基因及其介导的信号与细胞凋亡调节的规律。三维细胞培养模型对研究某一特定系统的信号途径提供了一种有价值的手段,但是其导管管腔形成的机制是否与实际的导管形态发生相一致,仍需进一步明确。
局部生长因子和导管的形态发生
局部生长因子如EGF、IGF-1和转化生长因子-β(TGF-β)均受激素的调控,在导管形成过程中发挥了关键的作用。许多实验通过在紧靠TEB的乳腺脂肪垫中放置缓释生长因子来验证生长因子对乳腺的作用。这些实验利用重建的基因敲除和野生型上皮细胞和基质,如用野生型围生期关键性EGFR敲除小鼠进行移植实验研究,发现由基质EGFR介导的信号转导为导管发育所必需。
另外一个例子,即生长激素对乳腺基质中IGF-1表达的调节,后者可作用于乳腺上皮细胞的IGF受体(IGFR),这也说明上皮与基质间的相互作用。敲除IGFR会导致胚胎死亡。但是,将胚胎发育第17~18天的关键性IGFR敲除小鼠的乳腺始基移植到野生型受体小鼠的缺失脂肪垫部位后,发现TEB导管的生长和增殖可能需要乳腺上皮细胞中IGFR的表达。
一种新型的Rho蛋白——RhoGAP,即p190-B,其活性和分布可能同时受整联蛋白和IGFR信号途径的调控。已有研究表明,RhoGAP能够调节IGF信号转导通路,影响导管的生长。野生型和p190-B杂合型及敲除裸鼠的乳腺始基移植研究再次证明了p190-B的重要性。这种作用至少部分归结于胰岛素受体底物分子(insulin receptor sustrate molecular, IRS),即IRS-1和IRS-2。有趣的是,IRS-2在TEB的帽细胞和体细胞都有表达,而IRS-1只在体细胞有表达。
采用未成年小鼠乳腺组织进行的研究表明,间质而非上皮的ERα是导管生长所必需的,这表明基质-上皮信号转导通路的重要性。然而,这些上皮重建实验是将野生型和ERα敲除小鼠(ERKO)的新生上皮和间质重组体移植到肾囊中完成的。已知雌激素能够增强IGF-1对TEB增殖和导管形成的刺激作用。ERα、PR和PrlR在TEB的体细胞上均有表达,因此可能对上皮细胞直接表现出某些类雌激素效应。从成年ERKO或者野生型对照小鼠中分离获得乳腺上皮细胞,然后注射到3周龄雌性ERKO或野生型鼠的无上皮乳房脂肪垫中,结果显示间质和上皮ERα均为完整乳腺腺体发育所必需。但是,当给予小鼠大剂量的雌激素和孕激素后,基质的ERa足以引起完整的乳腺腺体生长,并且原始ERKO等位基因保持ER功能在某种水平。Mallepell等利用一种新的缺乏ER功能大鼠系实施了一系列简单的移植实验,证明雌激素可以通过旁分泌机制促使上皮增殖和成形,也明确阐释了乳腺导管形成对上皮ERα的绝对依赖。下游、双向调节因子似乎是ERα功能的必要旁分泌介导者。另外,已知雌激素能够增强IGF-1对终端胚芽的增殖和导管形成的刺激效应。
TGF-β是已知的另一种局部生长因子,它能介导腺体导管发育中上皮-基质的相互作用。当腺体基质中TGF-βII受体表达占优势时,可以引起乳腺上皮分支增多,说明TGF-β信号转导在乳腺形态形成中有重要的负性调节作用。另外,有研究表明TGF-β的活性受卵巢激素的调节。通过移植实验比较野生型和杂合型乳腺上皮细胞TGF-β的表达水平,结果显示脂肪垫缺失者中TGF-β表达降低90%,表明该生长因子以一种自分泌或旁分泌的方式抑制上皮细胞的增殖。最近的研究表明,TGF-β能够防止ER表达细胞的增殖,后者在正常成年大鼠和女性是不增殖的。另外,调节导管延伸和单向分支的非经典Wnt家族成员——Wnt-5a与TGF-β之间的相互作用也有报道。
目前已发现一些涉及神经发育的信号通路在乳腺发育中也起着重要的作用,如纺锤蛋白-1(netrin-1)与再生蛋白(neogenin)之间的相互作用。这两种分子最早被认为在神经系统轴突的引导中起重要作用,现在发现它们还与乳腺的形态形成有关。纺锤蛋白-1在导管的体细胞中有表达,它的受体再生蛋白则相应地在TEB邻近的帽细胞中有表达,其中任何一种基因缺失都会造成TEB结构变异。所以,在乳腺的形成过程中,纺锤蛋白-1及其受体再生蛋白可能起一种黏附作用,而非引导作用。最近研究也确立了SLIT-2的一个新角色——黏附信号,与纺锤蛋白-1共同作用,在双层管形成过程中沿着导管产生细胞界限。
乳腺腺泡的发育
妊娠可诱导乳腺分泌单元即腺泡的增殖。腺泡起源于导管的祖细胞(图1-14D),经过不断增殖,最终占据整个间质脂肪垫(1-13I)。在妊娠早期,即胚胎第3天,便可以观察到导管上皮细胞的DNA合成速度最快。开始减慢前,在发育的腺泡中仍可见到DNA的高速合成。比较而言,在妊娠第6天,在乳腺上皮细胞可以看到明显的成簇腺泡的二级和三级导管。到妊娠第10天,腺泡开始均匀地分布于导管系统。到妊娠第18天,乳腺上皮细胞大约占所有细胞的90%,整个脂肪层几乎被腺泡所填充(1-13I)。在增生的同时,通过测定乳蛋白合成基因,如β-酪蛋白(β-casein)和乳清酸性蛋白(whey acidic protein, WAP)等,发现在妊娠中期腺泡便开始功能上的分化。
除了组织学特征和作为分化标记的乳蛋白基因外,3种新的蛋白标记已经被确定,它们可以鉴别不同的乳腺CK8/CK18阳性的导管上皮细胞。钠-钾-氯转运载体1(NKCC1)和水通道蛋白5(aquaporin 5,AQP5)在未孕小鼠的乳腺导管上皮细胞中均有表达,但在妊娠小鼠乳腺导管上皮细胞中却没有发现AQP5。有趣的是,在TEB中也发现了AQP5的存在。NKCC1在未孕和妊娠小鼠乳腺导管上皮细胞基底部和侧壁有表达,但这种表达在妊娠期间降低,在腺泡中检测出的量很少。相反,Ⅱb型磷脂酸钠载体Npt2b首先在妊娠第15天和哺乳期乳腺腺泡细胞膜的顶端被发现。这3种载体为区分导管上皮细胞的变化提供了新的标记,它们的抗体为识别不同的基因敲除小鼠乳腺表型提供了非常有用的试剂。
乳腺腺泡发育中激素受体表型的重要性
孕激素和泌乳素是乳腺腺泡发育的主要递质。缺乏泌乳素、PRLR或PR可完全抑制腺泡发育和侧支导管的形成,但是,并不显著影响主导管的生长和二级导管的形成。外源性的孕激素和泌乳素可以部分刺激ERKO小鼠乳腺小叶的发育。两种不同的PR类型PR-A和PR-B源于同一基因,在乳腺中均有表达。对PR-A或PR-B表达缺失小鼠的研究表明,仅PR-B就足以诱导正常细胞增殖分化。
类固醇激素受体的空间分布对人类和啮齿类动物乳腺的发育至关重要。例如,尽管PR和ERα存在于96%的正常乳腺上皮细胞中,但增生细胞的PR和ERα为阴性。在成年未婚女性中,大约25%的导管上皮细胞类固醇激素受体阳性,这种分布可能是由于孕激素水平升高引起的。PRLR的分布也不均匀。因此可以推测,ER、PR和PRLR同时存在于同样的细胞。应用PR特异性抗体进行免疫染色,或用原位杂交技术标记PR mRNA,甚至应用特殊的LacZ报告基因小鼠直接观察PR启动因子的转录活性,这些研究均表明PR沿乳腺导管不均匀表达,甚至可以在包埋的整个乳腺标本中观察到反映PR活性的LacZ阳性细胞分布。等焦距显微镜下研究提示PR阳性细胞并不总是与增生的细胞直接相邻,通常是相隔不多于两三个细胞,这提示旁分泌机制可能在调控乳腺上皮细胞增殖中发挥一定作用。关于ERKO和PRLRKO小鼠的分析研究提示,在导管上皮细胞的ER、PR和PRLR的表达中可能有一种自动调控途径。在特定的基因敲除小鼠中,类固醇激素和PRLR表型的破坏可以抑制乳腺腺泡的发育。
乳腺腺泡发育的旁分泌递质
局部生长因子刺激邻近类固醇激素受体阴性乳腺上皮细胞的增殖及促进正常乳腺腺泡的发育,需要乳腺导管中建立类固醇激素和PRLR的正确表型。PR或PRLR敲除的表型结果很相似,提示它们的信号转导途径可能在下游的某一点重合。为支持这一假设,对这些敲除模型进行了基因阵列研究,已经发现双调蛋白(amphiregulin, AR)、IGF-2、Wnt-4和核转录因子-κB(NF-κB)配体(RANKL)的受体激活剂是这两条路径潜在的下游靶点。
EGF家族成员在乳腺小叶发育中的重要性是在分析TGF-α、EGF和双调蛋白3基因敲除鼠中发现的。在3个基因同时敲除的鼠腺体中,腺泡未分化,排列结构不良,乳蛋白基因表达减少。由于其他家族成员的代偿作用,这些单一家族成员的缺失所造成的影响很小。雌激素已经被证明可调节TGF-α的转录,孕激素却被证明可调节双调蛋白的表达。
IGF-2也被证明是一种泌乳素诱导乳腺小叶发育的媒介,异常的IGF-2表达可以恢复PRLR阴性上皮细胞的腺泡发育。IGF-1和IGF-2也在乳腺基质中表达,并部分地代偿乳腺上皮细胞中IGF-2的缺失。CCAAT增强子结合蛋白(CCAAT/enhancer binding protein, C/EBP)-P缺失小鼠由于IGF信号轴的改变,导致类固醇激素和泌乳素基因表达出现异常模式和乳腺小叶发育缺陷。
许多其他转录因子,尤其是GATA-3和Elf-5也被证明可以调节导管上皮细胞。例如,GATA-3已经被证明对导管上皮细胞的分化至关重要,而泌乳素调节的转录因子Elf-5对妊娠期建立分泌腺泡是必需的。
哺乳期乳腺发育的调节因素
断奶后乳腺可以发生一系列变化。首先,乳汁淤积,导致腺泡上皮的局部因子增多,并诱发乳腺上皮细胞凋亡。其次,由于婴儿不再吸吮,母体血液循环中的泌乳素水平降低,促使乳腺发生形态学(非遗传学)改变,维持一种“处女般”的状态。
Janus激酶(Jak)/Stat途径的泌乳素调节作用,尤其是Stat-5的活化作用,对于哺乳期乳腺的发育和乳汁蛋白基因表达的调节都十分关键。在乳腺退化开始时,Stat家族的Stat-3被激活,而Stat-5却失活。这一转化似乎是被乳汁淤积所触发,且不依赖血泌乳素水平的变化,提示其可能是被另外一种生长因子或细胞因子调节。
Neville等总结了哺乳期激素的调节,将其分为两大类:一类是生殖激素,如雌激素、孕激素、泌乳素、胎盘泌乳素和氧化毒素;另一类是代谢激素,如生长激素、类固醇激素、甲状腺激素和胰岛素。这些激素都可影响乳腺的发育和哺乳。例如,在妊娠末期,由于孕激素撤退,导致乳腺泌乳,分泌乳蛋白和液体等。有趣的是,PR在哺乳期的乳腺中事实上并不表达,而是由刺激乳腺分泌的激素如胰岛素、泌乳素和糖皮质激素调控乳蛋白基因的表达。在哺乳期,催产素刺激乳腺肌上皮细胞使之收缩而排出乳汁。催产素的缺乏可减少腺泡的泌乳,导致发育不全,乳汁淤积,诱导细胞凋亡。甲状腺激素和生长激素的水平也通过各自的直接和间接机制影响哺乳,例如调控营养物质的摄取和增加基质中IGF-1的分泌。
作为哺乳期的关键调控因素,乳腺对营养物质的摄取已经被阐明,缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)可以抑制乳腺腺体的分化和脂质分泌,最终导致哺乳期结束和乳汁成分的显著改变。这些影响的产生似乎部分由于HIF-1α调控葡萄糖载体GLUT-1表达的需要。在哺乳期,糖酵解产生的能量和乳糖的合成需要有效的葡萄糖摄取。出乎意料的是,HIF-1α的缺失似乎并没有影响妊娠期和哺乳期血管的密度。
展望
基因工程鼠结合某些特殊信号途径的原位分析,对研究调控乳房发育的分子机制提供了新的认识。因此,人们现在可以更好地理解调控胚胎乳腺腺体发育的分子机制以及体内激素和局部生长因子调控出生后乳房腺体发育的分子机制。近期,证实老鼠和人乳房中的干细胞功能的研究已经获得进展,发现两者存在许多相似之处。新技术如RNA干扰技术、活细胞光子成像技术及高通量微阵列技术等,是未来大有希望的研究手段。根据乳腺癌出现变化的特定前体细胞类型和信号转导途径,有可能设计靶向治疗方案,这是未来乳腺肿瘤治疗的方向。
