目前已应用核素标记技术成功检测的物质多达300余种,核素标记是测定各种微量物质和受体分析最常用的手段。常用的放射性核素有125I、131I、3H、14C、35S和32P等,内分泌临床和科研领域内以125I、35S 、32P和3H更为常用,从本文开始将分别做介绍。
蛋白质/多肽可用氯胺T法标记
氯胺T是氯代酰胺类氧化剂,在水溶液中易分解形成次氯酸,将125I-氧化成放射性单质碘(125I2),然后取代酪氨酸残基苯环上的氢原子,或与组氨酸残基的咪唑环共价连接,使蛋白质或多肽发生碘化反应。目前,多种蛋白质、内分泌激素、多肽均采用了氯胺T标记法。Rissler 等采用氯胺T法成功标记生长激素抑素-14用于RIA和受体结合分析,而胰岛自身抗原采用该方法标记却因检测抗体灵敏度不理想而限制了其临床应用。125I标记技术步骤见下表。
氯胺T-125I标记步骤
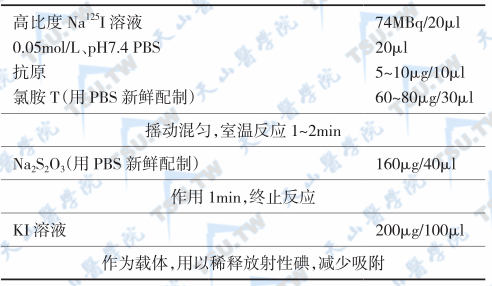
将结合物通过Sephadex G-50凝胶柱层析,用0.05mol/L,pH7.4 PBS洗脱。收集第1峰洗脱液,合并。加入等量1% BSA及0.1%NaN3,小量分装,低温冻存或冷冻干燥。
放射性碘的选用
无载体的131I或125I均可用于碘化标记,但应尽量选用新鲜的、比放射强度高的、含还原剂量少的放射性碘源。碘源的比放射强度≥1.85×1010~3.7×1010Bq/ml,至少>1.11×1010Bq /ml,否则加入碘的容量要增加,碘源中的还原剂(为放射性碘运输保存所需加入)量也增加,这将显著降低碘利用率及标记蛋白比放射强度。放置较久的放射性碘,因衰变而引起比放射强度降低和辐射化学产物增多(主要是131I源)都会降低标记时的碘利用率。放射性碘源含还原剂(如Na2S2O5等)量多时,会抵消氯胺T的作用,降低碘利用率。放射性碘要用无载体的,标记所用全部用具和试剂必须不含碘;只要有极少量的碘污染,放射性碘会被稀释,使放射性碘利用率显著降低。为了便于放射性防护和消除污染,减少射线对蛋白质分子的损伤,标记投入的放射碘量不宜过大,一般以<185MBq为宜。
放射性碘与多肽、蛋白质的用量比
对标记结果的影响很大。一般标记时放射性投入量不宜过多,常规示踪的用量为每次37~74MBq。放射性碘与多肽、蛋白质用量的比值主要靠标记时投入的多肽、蛋白质用量来控制。当投入的放射碘量一定时,多肽、蛋白质用量多(即125I/多肽、蛋白质比值低),能获得高碘利用率,但所得标记的蛋白比放射强度低;相反多肽、蛋白质用量少(即125I/多肽、蛋白质比值高),碘利用率降低。
氯胺T与Na2S2O3的用量及碘化反应时间
氯胺T是氧化剂,早期采用氯胺T法做碘化标记时氯胺T用量都比较大,或碘化反应时间较长,结果导致蛋白质结构和活性的严重损伤。当用不含还原剂或还原剂很少的放射性碘源标记各种蛋白质(如ACTH、胰岛素等)时,当氯胺T用量为20μg/0.1ml反应液,0~20℃反应20秒,碘利用率都已接近或达到最大峰,再加大氯胺T用量和延长反应时间无必要。故决不应盲目加大氯胺T用量和延长碘化反应时间(通常不超过1分钟),否则会导致标记多肽、蛋白质严重失活。当然,减少氯胺T用量要在了解放射性碘源还原剂含量的基础上,否则碘源中还原剂量较多,盲目减少氯胺T用量,就会使标记失败。加入氯胺T后必须迅速混匀,以防标记不均匀。氯胺T与Na2S2O3溶液要新鲜配制。为保证按时终止碘化反应,实验时加入Na2S2O3一般都是过量的。某些蛋白质或多肽对氯胺T较敏感,还可进一步减少氯胺T用量,缩短碘化反应时间,降低反应温度,以保护蛋白质的活性。这对一些较容易丧失活性的蛋白质或多肽的碘标记十分重要。
碘化反应体积
系指加入Na2S2O3终止反应前液体的总量。碘化反应体积愈小,局部反应物的浓度愈高,所得碘利用率和标记多肽、蛋白比放射强度就愈高。当反应液量少(<0.2~0.3ml)时,反应体积对碘利用率和标记多肽、蛋白质比放射强度的高低影响较大;当反应液量大(>0.5~1.0ml)时则影响较小。微量氯胺T法放射碘标记时,一般多控制碘化反应体积<100μl。
碘化反应温度
温度升高,碘化反应速度加快,碘利用率增加。但总的来看,反应温度的影响并不显著,一般从0~20℃碘利用率相差不大,故一般在室温下进行标记操作。有些蛋白质或肽类极易丧失活性,应在0℃进行碘化反应。
碘化反应pH值
经氧化生成的活性碘,对多肽链的酪氨酸基苯环羟基邻位的碘化作用,最适pH 7.3~7.8。当pH变化时,碘化位置也会发生变化。例如pH较高时,组氨酸的咪唑环也可被碘化;当pH 4~5时,活性碘能迅速氧化色氨酸基生成羟基吲哚,导致肽链断裂。这些都会影响蛋白质或多肽的放射性碘化反应,或引起降解或失活。因此做放射性碘化标记时,除放射性碘源外,所有的试剂都应用适当的缓冲液配制,保证碘化反应在最佳pH条件下进行。
微量蛋白质或多肽的吸附损失
在使用大量蛋白质或多肽类时,界面的吸附损失可以忽略,但做微量法标记时投入的蛋白质或多肽类只在微克甚至毫微克水平,界面吸附导致的损失就不能忽略。例如,当制备131I-ACTH所用ACTH浓度低到50pg/ml时,表面吸附可损失10%~30%,甚至高达75%。改变pH,加入非特异性载体蛋白或使用聚苯乙烯、聚乙烯容器时,能减少吸附,但不能完全消除。一般残留在反应管和滴管上的放射性为投入总放射性的2%~8%,而残留在层析柱上的则占5%~10%。
不同蛋白质与多肽碘化标记的差别
由于不同的蛋白质和多肽分子中含有的酪氨酸数目不同,而且其空间结构也不相同,分子中的酪氨酸残基碘化反应有差异,因此,同样条件下进行碘化标记,不同蛋白质或多肽对碘的利用率是不相同的。不同蛋白质经碘化标记后的生物活性受损程度也不相同。ACTH、GHRH、LHRH等碘化标记后,容易丧失与受体结合的活性,而HCG等的碘化标记较易保存良好的免疫化学活性。
过氧化物酶标记的比度较高
过氧化物酶与H2O2先形成络合物,将125I-氧化成125I2。在LPO催化下,将蛋白质碘化。此法反应温和,对抗原的免疫活性损伤小,标记物可达到高比度。其缺点是标记蛋白溶液中引入了另一种蛋白质——LPO,此酶本身亦可能发生碘化反应。酶促反应的温度和pH值影响标记率,一般以25℃和pH 5.5~6.0为宜。
乳过氧化物酶(LPO)法的反应液组成是:蛋白质2~5μg溶于磷酸缓冲液10~25μl中,加入125I标记的NaI 37MBq (10μl)、乳过氧化物酶溶液25ng(10μl)、H2O2 200ng(10μl)。在室温保温7分钟,加入H2O2 200ng(10μl)。过7分钟再加入H2O2 3μl。保温7分钟后,加入0.5ml、10mmol/L巯基乙醇以停止反应。10分钟后加入NaI载体溶液1ml。将结合物通过Sephadex G-50凝胶柱层析,分离纯化。
乳过氧化物酶(LPO)法的标记质量受许多因素的影响,操作时要注意以下几点:
- LPO的质量好坏可直接影响标记率,LPO应在使用前新鲜配制,以防酶活性降低;
- LPO的用量应小于总蛋白质用量的1%,以减少酶自身碘化而带入的放化杂质;
- 酶的催化速度很快,碘化反应在pH4.0~8.5较宽范围内均可进行,最适pH值应依据蛋白质本身性质而定;
- H2O2应保持低浓度,如高于0.1mmol/L,对酶的活性有抑制作用。
iodogen碘化反应对抗原损伤小而标记率高
氯甘脲(iodogen)的化学名称为1,3,4,6-四氯-3α,6α-二苯基乙二醇脲,和氯胺T同属于氯酰胺碘化反应类型,是一种不溶于水的固相氧化剂,能将125I-氧化成125I2,从而与蛋白质或多肽分子中酪氨酸残基上羟基邻位的氢发生置换反应。此法反应温和,操作简便,对抗原的损伤小,标记率高。涂布试管:将含0.02%氯甘脲的二氯甲烷或氯仿溶液50μl,加至玻璃或塑料反应管底部,用氮气吹干或减压抽干,低温干燥保存。用前以少量0.05mol/L(pH 7.4 PBS)洗涤数次,去除未黏附管壁的试剂。
iodogen碘化法标记步骤

同前法,将结合物通过Sephades G-50凝胶柱层析,分离纯化。
涂有iodogen的反应管在氮气中密封,并贮存在-20℃条件下,至少可用3个月。而打开反应管后则稳定性降低。碘化反应时间以7分钟时标记率达最高,10分钟时略有减少。pH 6.0~8.5时的标记率最高。
连接标记适用于氧化敏感蛋白和不含酪氨酸的多肽
连接标记法(Bolten和Hunter法)先用125I标记一个带有可与蛋白质或多肽交联的活性基团小分子物质,然后再将其与抗原连接。在结合反应中,无须再加入氧化剂和还原剂,不存在损伤被标记物的免疫活性。因此适用于标记对氧化敏感的蛋白质和多肽,以及碘化某些不含酪氨酸,而只有脂肪族氨基的半抗原和酪氨酸残基末端未暴露在表面的化合物。其缺点是添加基团可能改变被标记蛋白质或多肽的某些性质,对抗原的免疫活性产生不利影响,且操作较复杂,标记率低。标记步骤如下:
- 取HPNSE溶液10μl(0.4μg)加入反应瓶底部,在真空或干燥N2气流中蒸发干;
- 搅拌下依次加入Na125I 20μl(74MBq),氯胺T溶液10μl(50μg),Na2S2O3溶液10μl(120μg),KI或NaI溶液10μl(2mg),二甲基甲酰胺(DMF)2μl及苯250μl。HPNSE被碘化后提取至苯溶剂内;
- 减压抽干,除去苯;
- 置冰浴内(0℃),加入纯化抗原5μg/25μl,反应15~30分钟;
- 加入0.2mol/L甘氨酸(溶于0.1mol/L,pH 8.5硼酸盐缓冲液)500μl,在0℃反应5分钟,使其与过剩的碘化酯结合;
- 加入含0.25%明胶的0.05mol/L、pH7.5的PBS至总量1ml;
- 通过Sephadex G-50凝胶柱层析,分离碘化酯连接的蛋白质(第一洗脱峰)和小分子碘化产物。
碘标记半抗原能与任何蛋白质或含氨基半抗原连接
半抗原碘标记可采用以下两种方法:
- 直接碘标法是先在甾体激素等半抗原分子上连接芳香族胺、组氨酸甲酯或酪氨酸甲酯,然后用氯胺T法标记上125I。此法的主要缺点是标记时易使半抗原丧失反应性。
- 间接碘标记先用氯胺T法将125I标记在酪氨酸或酪胺、组氨酸或组胺等衍生物上,经纯化后再将其与类固醇衍生物反应。
与前述Bolten-Hunter法相似,利用组胺的氨基与类固醇衍生物的羧基反应而连接。此外,酪氨酸或组氨酸衍生物的碘化作用能制备反应灵敏的标记物,它能与任何蛋白质或含氨基的半抗原连接。
游离125I含量小于5%是成功标记的基本要求
取少量标记物,加入适量BSA或正常兔血清为载体,用5%三氯醋酸沉淀蛋白质。离心沉淀后,测总放射性及上清液放射性。标记物游离125I百分率(%)=上清液放射性/总放射性×100%,一般应小于5%。
免疫反应活性结合率和放射性强度越高越好。取少量标记抗原,加过量的抗体,反应后分离结合抗原(B)和游离抗原(F),分别测定放射性。计算结合率(B/B+F×100),此值应在80%以上,最大可超过90%。数值越大,说明标记后抗原的免疫反应活性保存越好。如结合率较低,应经过提纯去除损伤的抗原后再使用。
放射性强度是指单位重量抗原的放射性强度,以比放射性(或比度)表示。125I标记抗原的比度一般应大于1.85MBq/μg,其计算方法是

