促性腺激素释放激素(GnRH)前激素(Prepro-GnRH)
是由位于染色体8p11.2-1lp21的 GnRH基因编码的92个氨基酸组成的多肽,其分子量为10kD,多肽的氮端是由23个氨基酸组成的信号肽,其后有一个甘-赖-精序列,在甘-赖-精序列后是一个由56氨基酸组成的称之为GnRH相关肽(GnRH-associated peptide,GAP)。GAP的主要功能是抑制泌乳素的释放。在所研究的动物中,免疫细胞化学方法可发现GnRH前体分子、GAP、GnRH定位于视前区内侧和下丘脑前区周围的大部分神经元中。但是在灵长类动物的弓状核中可发现GnRH神经元存在,而噬齿类动物则没有这种现象。GnRH前激素由神经内分泌细胞释放后,先以大颗粒沿轴突转移过程中裂解成信息肽、GnRH和GAP。
GnRH的分子结构与功能的关系
GnRH是十肽激素,它的10个氨基酸形成U字形排列,一端为焦谷氨酸,另一端为氨。
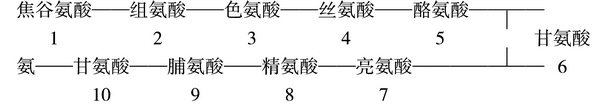
此10个氨基酸中第1~3位是与效应细胞上的受体结合点,并经过细胞膜的Ca2+通道进入细胞。第8位氨基酸(精氨酸)为GnRH调控促性腺激素合成及释放的关键,第6位甘氨基酸与第5及第7位氨基酸被称为无功能的三肽裂解点,易被内肽酶所破坏,第9与第10位氨基酸的连接又易被羧基酰胺肽酶所断裂,故GnRH在血液循环中留存的半衰期甚短,仅约5~6分钟。
GnRH分子中第2和第6位氨基酸是决定GnRH功能的主要活性基团。将第二位的组氨酸换成其他氨基酸,GnRH将失掉其刺激促性腺激素(GnTH)释放的生理作用,但仍能同促性腺细胞的受体结合而抑制GnTH的分泌,成为拮抗性类似物,第6位甘氨酸被芳香类氨基酸取代后变为GnRH激动剂类似物。
GnRH的释放
GnRH是以间断的脉冲方式释放入垂体门脉系统与腺垂体促性腺细胞膜受体结合,刺激GnTH的基因(LH-β、FSH-β和α-亚单位)的转录过程。灵长类及人类GnRH脉冲分析研究证明,GnRH释放频率和幅度对调节性腺轴功能极其重要。GnRH的释放与LH完全同步,故可利用周边血中LH释放脉冲来测定GnRH的脉冲释放频率。正常情况下,男性的GnRH释放频率各家报告不一,决定于取周边血标本的频率,一般每隔10~20分钟取血1次,但是每10分钟取血测LH也只能捕捉90%的释放脉冲,取血间隔时间>10分钟,捕捉到的脉冲数明显减少。根据这些测定,人的GnRH脉冲频率波动在90~180分钟之间。一项研究结果表明,由精索静脉每10分钟取血1次,同时测定血中α-亚单位,比单独测LH更能准确地反映垂体GnTH的释放频率,用此方法对6例正常男性测定的24小时内LH及α-亚单位脉冲释放频率,分别为23.7±3.2和31±1.2脉冲/24h。
因为GnRH对垂体GnTH的合成与释放的调节是分离的,而且都作用于GnTH的基因转录水平上,所以释放频率与幅度的不同都影响GnTH的合成与分泌。羊卵巢切除和切断下丘脑与垂体间的解剖与门脉血管联系,导致血中LH-β、FSH-β和α-亚单位的mRNA水平下降到极低的水平。给这种羊以生理脉冲频率与幅度的GnRH,使这三种mRNA水平恢复到去卵巢的极高水平。连续灌注GnRH不仅失掉其生理活性,而且LH停止释放。25ng(低于正常脉冲幅度10倍)的GnRH可维持LH-β mRNA的水平,但不能维持LH的分泌。说明低幅度的GnRH脉冲可刺激LH的合成,而不能刺激其释放,至少对羊LH的释放需250ng/脉冲。另一研究表明慢频率主要刺激FSH的释放,从而导致LH/FSF_I比值降低,而高频与高幅的GnRH脉冲主要刺激LH的释放,引起LH/FSH比值升高。
这些结果说明,不仅GnRH缺如,而且任何脉冲频率与幅度异常均可引起生殖内分泌功能紊乱。现已知至少四类疾病发病机制与GnRH缺如、频率和(或)幅度异常有关。因此了解这些同GnRH及其分泌特点有关的男女生殖内分泌病的发病机制,选择符合生理的治疗方法,有重要的指导意义。
GnRH的神经内分泌调节
GnRH神经元定位、神经纤维投射
人和猴的GnRH主要集中在弓状核、视前区与室旁核。除下丘脑外,GnRH及其受体也存于垂体、卵巢、睾丸(大鼠)、胎盘与边缘系统等组织中。GnRH神经元细胞体主要存在于下丘脑视前内侧区和视交叉上区,促性腺激素的周期分泌中枢在视前及视交叉上区,而持续分泌中枢是在下丘脑后方弓状核、腹内侧核区。用电损伤方法证实影响排卵功能的下丘脑区域定位是在视前及视上区。用免疫荧光法实验证实上述区域的GnRH神经元发出两个主要神经纤维束,即下丘脑-漏斗束和视前终板束,后者终止于终板血管器(OVLT),这提示下丘脑分泌的GnRH可经脑脊液作用于其他远距离的脑区。而位于第三脑室管膜细胞间的GnRH神经元可发出下丘脑外纤维。
性激素的反馈调节
卵巢或睾丸既接受下丘脑和垂体的正调节,又通过其分泌的性激素对下丘脑和垂体的功能产生反馈调节,以此来保证正常的生殖周期与生殖功能。雄激素本身可对下丘脑-垂体起负反馈调节,但主要通过其在周边组织及脑组织内转换成雌二醇(E2)起负反馈作用。雌激素促进中枢神经系统阿片类物质的合成,又通过阿片类物质抑制GnRH脉冲的幅度从而抑制垂体GnTH的释放。黄体酮协同雌激素抑制垂体功能,它也通过阿片类物质抑制GnRH的分泌调节。另外垂体所分泌的LH与FSH对下丘脑亦有反馈调节作用,称为短反馈。
神经递质的调节
因为GnRH神经元细胞内本身无性腺激素和促性腺激素受体,因此性激素对下丘脑反馈调节作用不是直接作用,而是以神经递质为介导。用免疫化学和激光共聚焦显微技术发现,与GnRH细胞密切接触的神经细胞及其纤维可含有多种神经递质,如去甲肾上腺素(NE)、组胺(histamine)、β-内啡肽(β-EOP)、γ-氨基丁酸(GABA)及多巴胺等神经递质,其中后三种神经递质细胞具有性激素受体。上述多种神经递质对GnRH细胞调节是促进作用,少数神经递质起抑制作用。但是其功能比较复杂,因为在某些情况下,两种功能可以相互转化,导致功能的改变。
免疫产物的调节
近年来,大量资料及实验证明免疫和生殖有着多方面联系。各种应激、炎症、感染性疾病、外伤及精神刺激等状态下,免疫系统功能增强,而相应的因素则引起生殖功能明显抑制。这一现象提示免疫对下丘脑生殖功能具有调节作用。
总之,由神经介质、性激素、细胞因子组成一个复杂的神经-内分泌-免疫调节网络。对GnRH的合成、分泌,进行了准确地调控,维持其动态平衡与周期性变化。其中神经介质的调控具有直接作用,而其调控方式程序,却有赖于激素与免疫产物的变化,三者之间密不可分,组成一个完善的调节系统(下图)。
GnRH作用机制
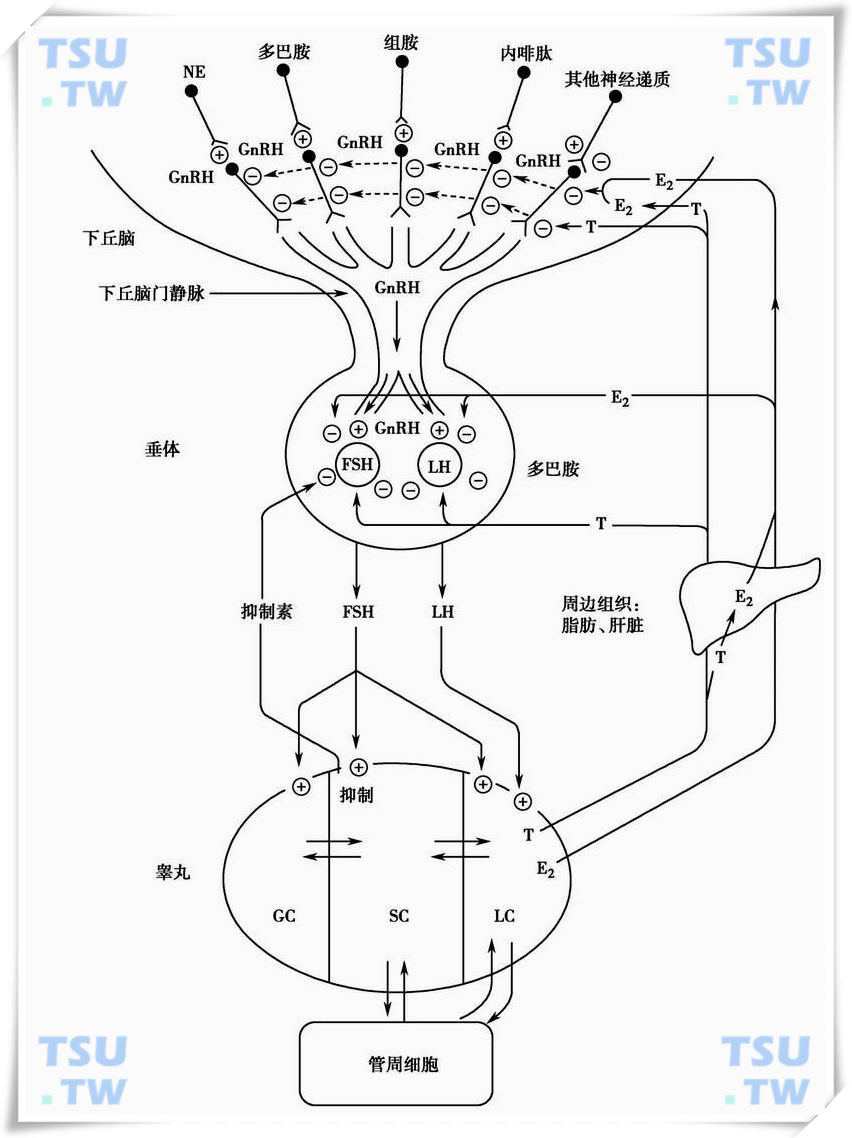
下丘脑-垂体-睾丸轴调节系统示意图
位于促性腺细胞膜上的GnRH受体属Ca2+动员受体。当GnRH与其受体结合后引起细胞膜磷脂水解,水解产物诱导细胞内Ca2+浓度升高。故GnRH生物作用中磷脂水解产物和Ca2+为第二信使,后者激活蛋白激酶C引起新蛋白质的合成而出现生物效应的三种反应:首先在数分钟内储存的FSH和LH先释放,持续约30~60分钟。随着第二次GnRH峰的到来,分泌反应要强于第一次反应(释放储存),这称之为GnRH的自预激(self-priming)作用。使用电镜免疫细胞化学技术,可以发现引发促性腺激素细胞的第一次GnRH脉冲引起分泌颗粒向质膜下边缘区移动,颗粒的体积也变小,可能是颗粒成分发生成熟变化,但有少部分消失了。GnRH的持续作用可以引起LH的释放和小的分泌颗粒的显著减少。其次经过数小时或数天后,促性腺激素细胞又开始合成分泌颗粒,以维持它的分泌状态。
GnRH与受体结合后,一些GnRH-受体复合物保留在质膜上,而其他的则经过包被小窝进入脂质结构中,发生降解或经过其他多肽的处理后进入胞浆中。如果GnRH继续作用或注射长效GnRH类似物使受体被持续占领,最终将引起垂体中LH和FSH的含量和分泌减少,即促性腺细胞的脱敏现象。这表明受体的持续被占领使其不能完成随后发生的涉及信号传递的生化反应。这也是在临床上早期连续性注射GnRH或企图加强其生物性效应而改用GnRH激动剂后引起GnRH明显减少,甚至抑制精子发生,从而发现了一种新的男性避孕途径的生化基础和一系列临床应用长效GnRH类似物治疗青春期早熟、晚期前列腺癌等疾病的新途径。
