1993年,Lee等在线虫中首次发现miRNA——lin-4。2000年,Reinhart BJ等再次在线虫中发现第二个miRNA即let-7。在2004年,Calin等研究发现miR-15和miR-16与慢性B细胞淋巴瘤发生有关,首次揭示miRNA与肿瘤发生相关。越来越多的证据表明miRNA参与肿瘤细胞增殖、分化和凋亡,血管新生,侵袭转移,物质代谢等过程。目前发现约50%的miRNA基因位于肿瘤相关基因组区域或其脆性位点,不同肿瘤的miRNA表达谱有明显的不同。根据miRNA在肿瘤发生发展中的不同作用,可将其分为致癌miRNA(oncomirs)和抑癌miRNA(tumor suppressor miRNAs)两种类型。
致癌miRNA在肿瘤中表达上调,能够抑制那些抑癌基因或调控肿瘤细胞增生、分化、凋亡的基因,促进肿瘤细胞增殖、血管新生等来增强肿瘤侵袭性。例如:Myc是一种能调控细胞增殖和死亡来调控细胞生长的转录因子,它常在肿瘤中突变或激活。miR-155与Myc的过表达协同参与慢性B细胞淋巴瘤的发生。进一步研究发现miR-155的表达在小儿伯基特淋巴瘤、霍奇金淋巴瘤和B细胞淋巴瘤的特定亚型中的表达显著增高。此外,miR-155还在结肠癌、肺癌、乳腺癌和甲状腺癌中表达上调。Brueckner B等研究提示let-7a-3前体miRNA可以调节肺腺癌发生,具有原癌基因的潜能,该基因甲基化,促进肿瘤发生。He等研究发现miR-17-92基因簇衍生出来的前体和成熟miRNA在慢性B细胞淋巴瘤中的表达明显高于正常组织,推测其可能作为癌基因促进肿瘤生成。多项研究发现miR-21在实体肿瘤如胃、结直肠、肺、乳腺、前列腺、恶性胶质瘤、子宫平滑肌瘤和卵巢等肿瘤中均表达明显上调。miR-21位于染色体17q23.2上的空泡膜蛋白基因的3′UTR。在恶性胶质瘤细胞中,敲除miR-21可诱导肿瘤细胞凋亡;另外在乳腺癌中使用Anti-miRNA-21也可诱导肿瘤细胞凋亡,这些证据更加支持miR-21作为癌基因的作用。miR-21作为癌基因可通过调节Bcl-2来调控肿瘤的发生,因此可以作为抗肿瘤治疗的靶点。
另一类抑癌miRNA在肿瘤中表达下调,它可以负性调节癌基因或者是负性调控抑制细胞分化或凋亡的基因,发挥抑制肿瘤细胞的作用。例如:Ciafre等的研究发现胶质细胞瘤中miR-128、miR-181a、miR-181b、miR-181c表达均下调。多项研究发现miR-143和miR-145在直肠腺瘤和腺癌、乳腺癌、前列腺癌、子宫癌和淋巴瘤等中表达明显下调。Cimmino等研究发现miR-15和miR-16均与Bcl-2蛋白表达水平呈负相关,两者都在转录后水平负性调节Bcl-2,诱导肿瘤细胞凋亡。O'Donnell等在Hela细胞中研究发现miR-17-5p和miR-20a负性调控E2F1的表达发挥抑制细胞增殖的作用。E2F1可通过调节DNA复制、细胞分裂和凋亡相关的基因来调节细胞周期从G1期向S期的转变。Welch等研究发现miR-34a抑制靶mRNA翻译成为E2F3,降低E2F3蛋白表达水平,抑制神经细胞瘤的发生。早期研究发现Let-7对于诱导细胞周期的退出和终末分化是必需的,Let-7在肿瘤中经常缺失,直接导致肿瘤细胞无限增殖且分化程度低。Akao等研究发现let-7在结肠癌中起着肿瘤抑制因子的作用。Takamizawa等发现let-7在肺癌中表达降低,let-7表达水平越低,其预后越差。体外实验证实肺癌细胞株高表达let-7可以抑制细胞的增殖,提示let-7可能是一个抑癌基因。Eder等研究发现肺癌组织中miR-155过度表达和let-7a-2低表达提示患者预后不良。深入研究发现let-7家族通过与Ras基因的3′UTR区中多个let-7补充位点结合,负性调节Ras信号转导通路,发挥抑癌作用。
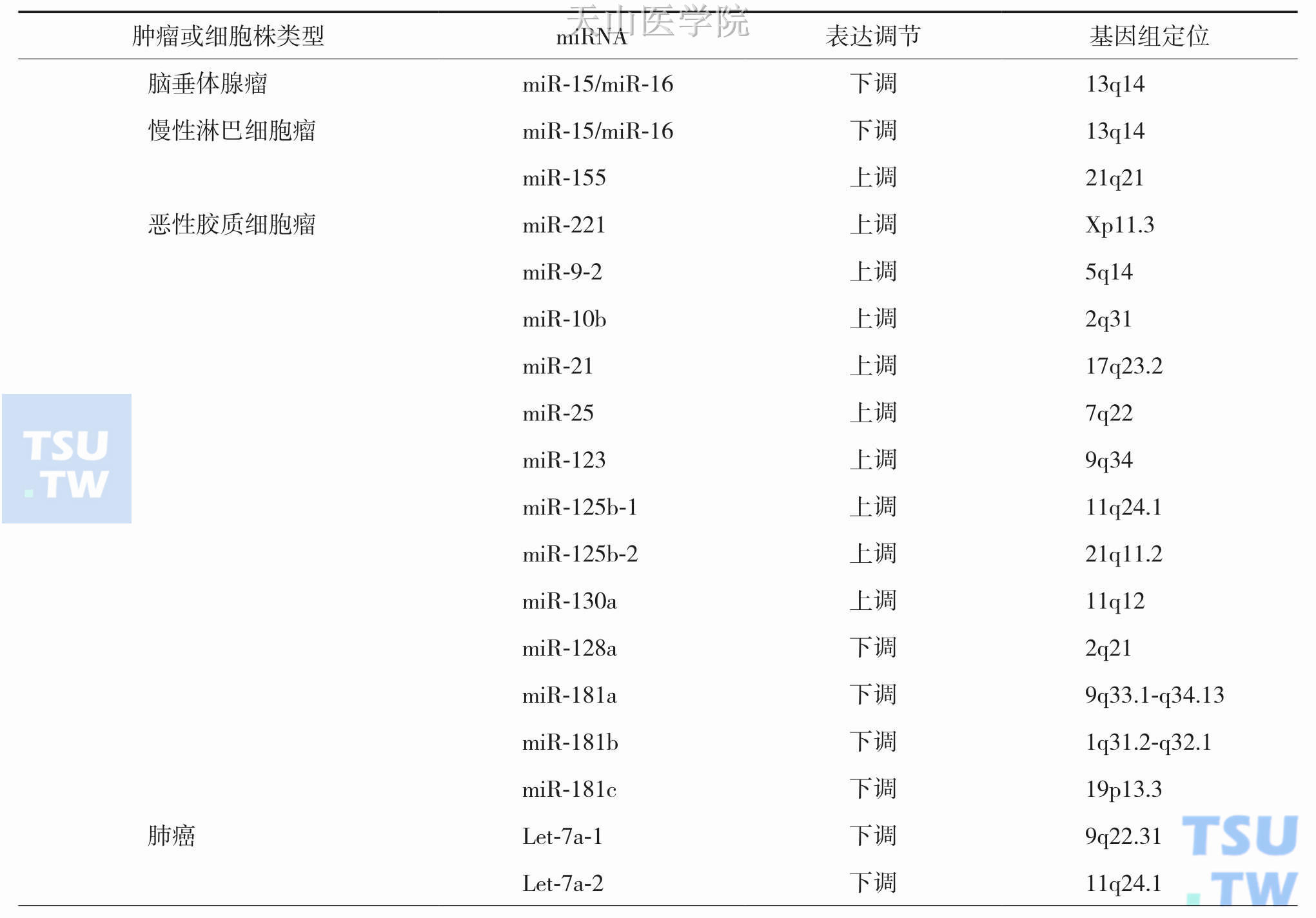
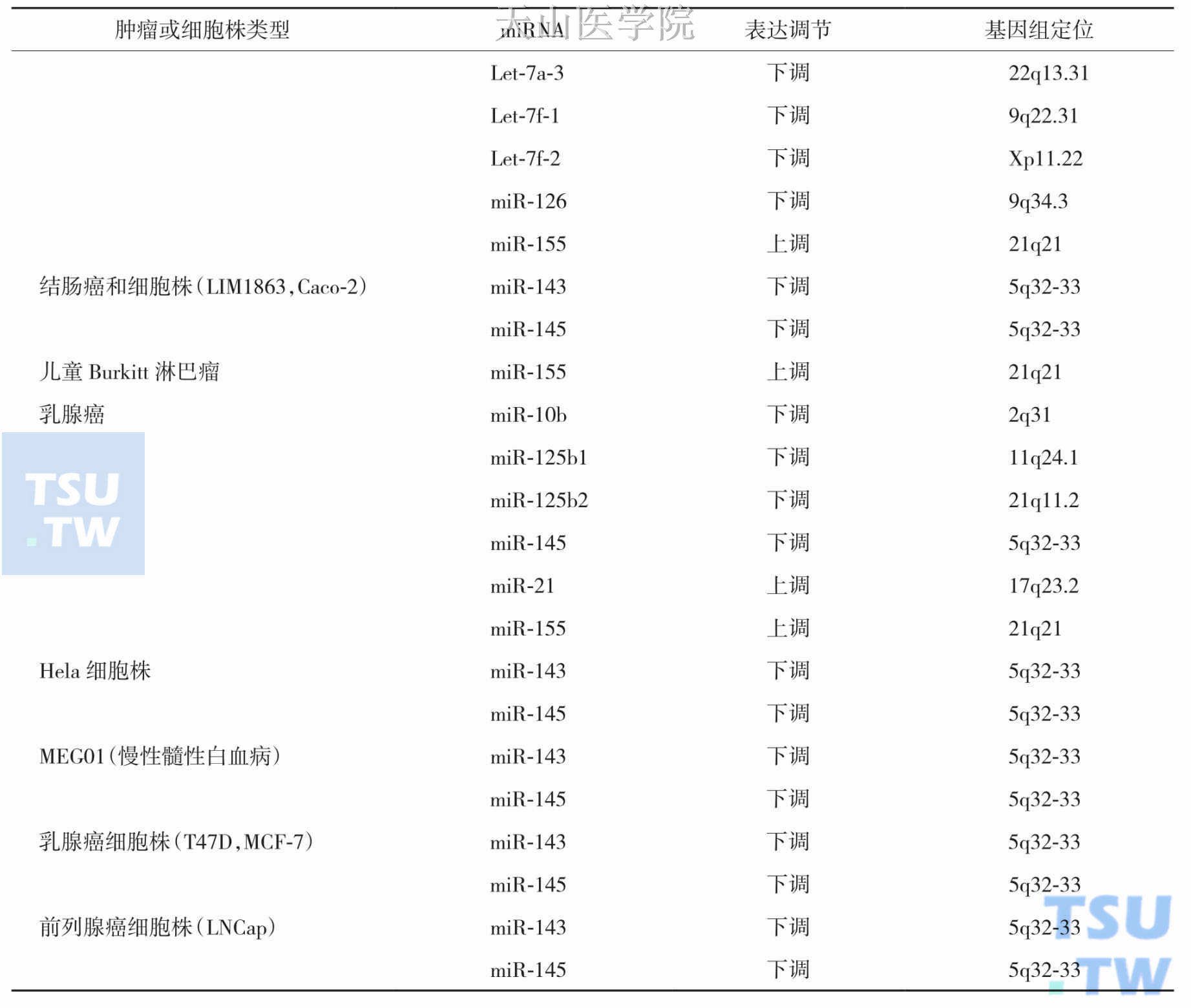
miRNA参与肿瘤的发生发展,值得注意的是,不同肿瘤中的miRNA表达谱并不一致,甚至同一miRNA在不同肿瘤中的作用也可能存在差别。目前研究证实这些致癌或抑癌miRNA参与:前列腺癌、胃癌、肝癌、结直肠癌、卵巢癌、宫颈癌、甲状腺癌、肺癌、乳腺癌、脑肿瘤及白血病等恶性肿瘤的发生发展,miRNA与肿瘤之间的关系见表2-11-1和表2-11-2。
表2-11-1 与肿瘤发生相关的部分miRNAs
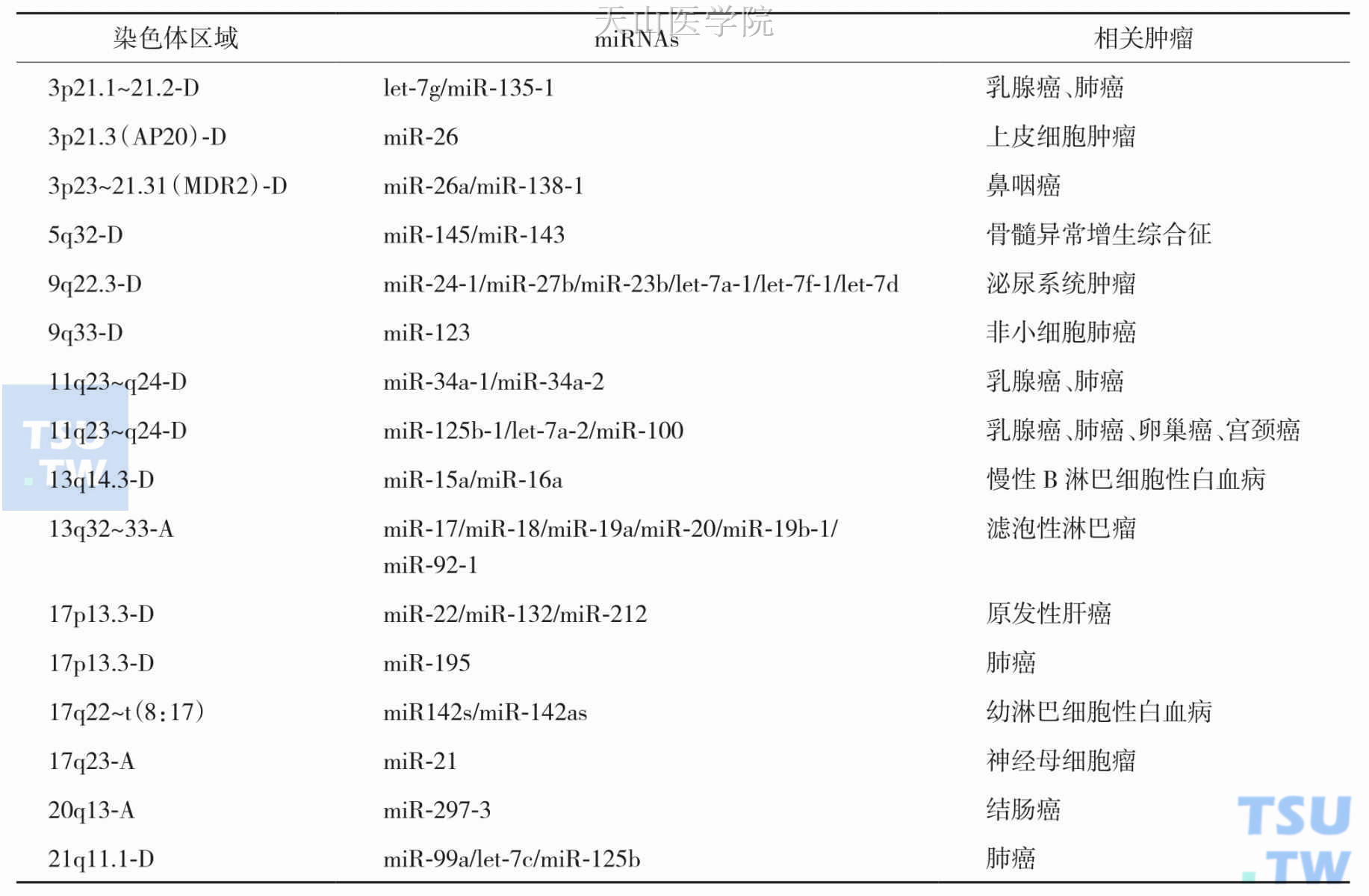
表2-11-2 部分肿瘤和细胞株中miRNAs的表达调节情况
显然易见,miRNA与肿瘤关系非常复杂,miRNA不仅在肿瘤发生中起重要作用,而且还参与肿瘤细胞代谢,调控肿瘤恶液质的发展。本文通过回顾目前miRNA与肿瘤相互关系的各项研究,探讨miRNA可能通过哪些途径来调节肿瘤恶液质患者的代谢活动,重点描述miRNA在肿瘤细胞代谢以及它在调节肌肉组织和脂肪组织的分解和合成代谢的相关机制,同时探讨miRNA作为肿瘤治疗靶点的前景。
