离子通道在各种调控方式作用下,可以快速改变细胞内离子环境,从而实现细胞与外界环境及其他细胞间的信息交换。在精子与周边环境及卵子间的信息交换中,离子通道作为其中一个重要环节,参与精子运动、获能、趋化和顶体反应的调控。各种离子通道在精子上有各自的分布特点,其中一些离子通道是精子所特有的。精子的生理功能中,活动力最容易被观察分析。人们早就猜想到离子通道与精子活力之间存在密切关系,不过一直没有直接的证据,因为精子不仅很小,而且结构特殊,在单个活动精子上进行实验十分困难。直到近几年,随着检测技术和方法的进步,一些离子通道与精子运动之间的关系才逐渐得到证实。精子有活化和超活化两种运动方式,在趋化物质的作用下还可以表现出趋化运动。
可能参与精子运动调控的几种离子通道
钙离子通道
精液射出后,活化精子的鞭毛以小振幅的摆动驱动精子向前运动,进入女性生殖道。精子细胞内的钙离子和碳酸氢根离子调控可溶性腺苷环化酶(soluble adenylyl cyclase,sAC)活性,使细胞内cAMP增加。cAMP可作用于蛋白激酶A(PKA)进而参与精子活化的启动。虽然调节sAC活性所需钙离子的来源还不清楚,精子细胞上的钙离子通道很可能起着重要作用。
人们在哺乳动物精子上检测到许多电压门控钙离子通道(Cav)的亚基,并测量了这种离子通道在精子细胞和精子上的活性。精子上Cav的种类比较多,广泛分布于精子头部和鞭毛。其中Cav2.3分布于人和小鼠精子的头部及鞭毛中段,将其敲除后的小鼠仍能繁育后代,只是精子在游动时直线性增加了。有一类电压门控钙离子通道仅在睾丸组织中表达,命名为“CatSper”,其中的CatSper1和CatSper2定位于精子鞭毛。CatSper1和CatSper2协同表达于精子,敲除CatSper1或CatSper2基因后的雄性小鼠将因精子不能进行超活化运动而丧失生育力。运用膜片钳技术在小鼠精子的胞质小滴上检测到微弱的钙离子内流现象,当细胞内环境碱性化的时候这个离子流信号会显著加强,而当CatSper1被敲除后这种信号就检测不到。以上现象说明CatSper在精子的活力调控中起着重要作用。
瞬时感受器电位(transient receptor potential,TRP)蛋白是存在于细胞膜或胞内细胞器膜上的一类超家族离子通道蛋白,由TRPC(Canonical),TRPV(Vanilloid),TRPM(Melastatin),TRPP(Polycystin),TRPML(Mucolipin),TRPA(Ankyrin)及TRPN(NOMPC)等7个家族组成。在精子中,TRPC可能以经典的SOC(store-operated Ca2+channel,SOC)离子通道形式发挥作用,接受来自睾丸、附睾的促成熟因子的影像,促使精子在女性生殖道内发生获能和顶体反应。其中TRPC1分布于精子的鞭毛上;TRPC3、TRPC4和TRPC6分布于顶体区域和鞭毛中段的质膜;这种分布特征提示它们可能参与精子活化、超活化以及顶体反应。TRPM-8亦分布于精子的头部和鞭毛,在温度变化或薄荷醇的作用下通道开放,增加精子内钙离子浓度。这种钙离子浓度的上升可以被TRPM-8抑制剂(capsazepine和BCTC)所抑制,提示TRPM-8可能参与精子的趋化性运动或温度趋向性的调控。
在精子中还有受体型钙离子通道如RyR,它可能参与精子超活化运动中的钙离子震荡。
其他参与精子运动调控的离子通道
除各种钙离子通道外,在精子中还有钾离子通道、钠离子通道以及氯离子通道,它们在精子的活化、超活化和趋化运动中也起着一定作用。
离子通道与精子超活化运动
超活化运动使精子在具有较高黏滞性的输卵管中具有更好的前进性能,也使精子在受精过程中更有“穿透力”,而钙离子对于精子超活化的启动和维持十分重要。三磷酸肌醇受体(inositol 1,4,5-trisphosphate(IP3)receptor,IP3R)的显效剂可诱导公牛精子超活化,IP3R则位于RNE(redundant nuclear envelope)上。孕酮可诱导人类精子内部出现钙离子震荡,精子的鞭毛呈现超活化样摆动。这种震荡源自含有RNE的精子头部区域,并依赖斯里兰卡肉桂碱受体(ryanodine receptor,RyR)的活性。IP3R和RyR都是受体型钙离子通道。
获能后的精子不仅运动形态发生了变化,其细胞膜的构成和细胞内环境也发生了许多改变:细胞膜的流动性增加并出现超极化;许多蛋白成分发生酪氨酸磷酸化;细胞内pH值和钙离子浓度上升等。获能后的精子具备了趋化运动、精卵间信息通讯以及受精能力。在获能过程中有多种离子及离子通道参与其中,人们对其中的信号途径和调控机制已有初步的认知(下图)。
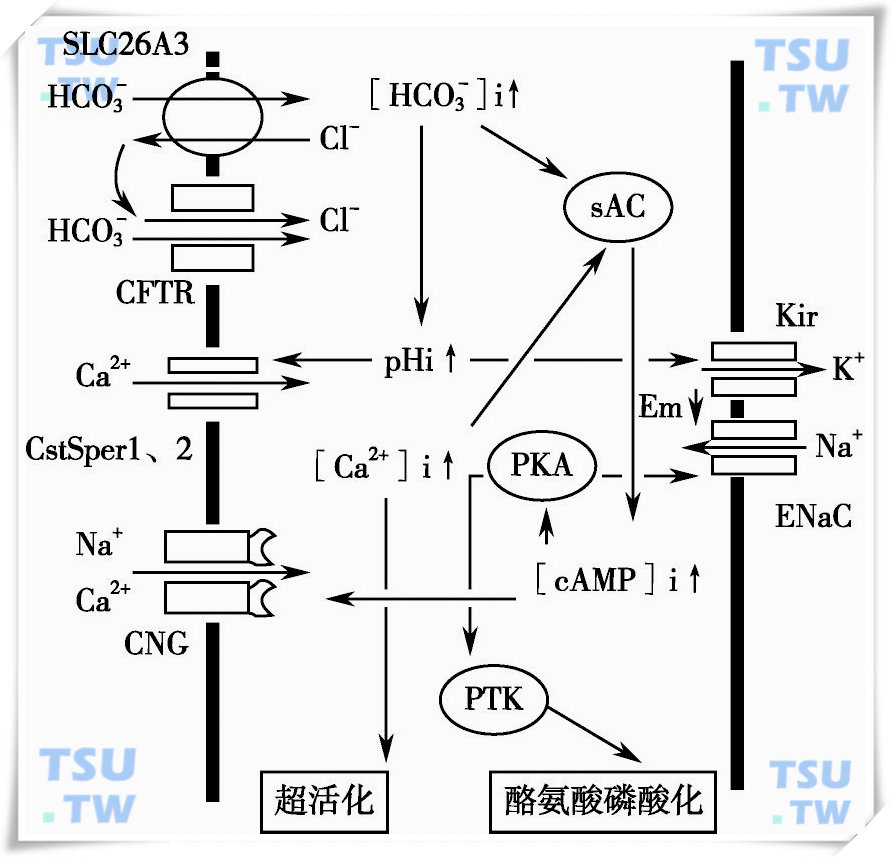
哺乳动物精子获能中的离子流和信号传递途径
Kir:inwardly rectifying K+channels ENaC:Epithelial Na+channels PTK:protein tyrosine kinase CNG:cyclic nucleotide-gated channel CFTR:cystic fibrosis transmembrane conductance regulator
在体外培养的条件下,精子获能需要钙离子、钠离子、钾离子、碳酸氢根等多种离子和其他成分。其中的重要成分有钙离子、碳酸氢根和牛血清白蛋白。外界碳酸氢根浓度增加,使氯离子碳酸氢根反向转运蛋白SLC26A3活性增强。碳酸氢根离子通过转运蛋白进入精子胞质。CFTR不仅可通过碳酸氢根,还可通过氯离子循环维持反向转运蛋白SLC26A3运转。细胞内碳酸氢根浓度增加可提高sAC活性,使cAMP浓度升高并引发细胞膜脂质重组。cAMP作用于环核苷酸门控通道(CNG)促进钠钙离子内流,作用于PKA引发酪氨酸磷酸化反应并抑制了ENaC活性。
细胞内碳酸氢根离子的增加还使胞质pH值升高,促进钙离子经CatSper1和2进入细胞内,而细胞内钙离子浓度升高后又可提高sAC活性并引发精子超活化。
在精子细胞上有pH和ATP依赖的Kir。获能之前精子内环境偏酸性,抑制了Kir活性。而ENaC在获能前处于开放状态,这有助于静息电位维持。Kir的关闭和ENaC的开放可以解释获能前精子膜电位为何能处于去极化状态。获能过程中,细胞内pH值升高可促使Kir开放,钾离子外流,而此时ENaC则处于关闭状态。ENaC的关闭和Kir的开放使细胞膜出现超极化。
离子通道与趋化运动
卵子周边的卵丘细胞分泌的孕酮虽然十分微量,却是重要的趋化物质。自卵子到周边环境存在皮摩尔浓度级别的孕酮浓度梯度。精子能感受到微量孕酮的存在,并逆着孕酮浓度梯度找到卵子。关于精子趋化运动的分子机制,Teves等提出如下模型。
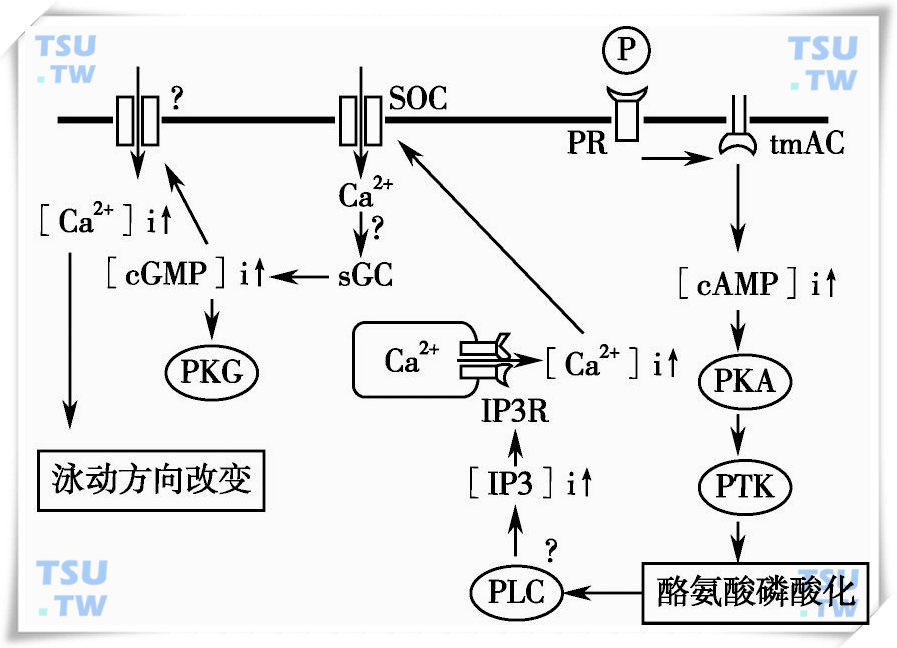
人精子趋化运动的分子机制
(Maria E.Teves et al.2009,略有改动)
孕酮与精子上的孕酮受体结合后,跨膜型腺苷酸环化酶(transmembrane Adenylyl Cyclase,tmAC)被活化。tmAC消耗ATP合成cAMP,后者又使PKA活化。PKA引发蛋白质酪氨酸磷酸化,通过某种途径使贮存的钙离子通过IP3R释放。参照顶体反应中PLCδ4所起的作用,有可能某种PLC活性增加,代谢底物产生IP3。IP3又与钙贮存库上的IP3R结合,钙离子通道打开。胞内钙离子浓度的增加使细胞膜上的SOC开放,细胞外钙离子内流。升高的钙离子浓度通过某种途径活化可溶性鸟苷酸环化酶(soluble guanylyl cyclase,sGC),细胞内cGMP浓度上升。cGMP活化PKG,某种钙离子通道开放,发生第二次钙离子内流。精子处在趋化物质的浓度梯度中,鞭毛内钙离子浓度的变化使鞭毛向趋化物质浓度更高的一侧发生更大的弯曲角度。这使精子头部转向趋化物质浓度更高的方向,精子泳动方向发生改变。
离子通道与精子运动之间存在十分紧密的关系,这点已经得到证实。随着相关研究的不断深入,人们可能会发现新的参与精子运动的离子通道,对精子运动原理和调控机制也将有更深入的认知。
