pH是溶液中氢离子浓度的一个量度,而在机体中,HCO3-是最重要的酸碱缓冲离子。细胞内pH的调控可以通过调节胞内氢离子浓度或者缓冲剂HCO3-的浓度来实现。机体中有许多不同的离子跨膜转运蛋白,介导氢离子或者HCO3-的跨膜运输。这些蛋白可以称为pH调控器(pH regulator),它们对细胞内的pH进行着精细的调节。
根据所转运的离子类型,这些pH调控蛋白可以归纳分为两大类:①介导氢离子跨膜转运的膜蛋白,包括质子通道、质子泵及钠氢交换蛋白;②介导HCO3-离子跨膜转运的膜蛋白,包括SLC4家族蛋白、SLC26家族蛋白、及囊性纤维化跨膜转导调节蛋白(CFTR)等。下面我们分别对这些酸碱跨膜转运蛋白进行简单介绍。
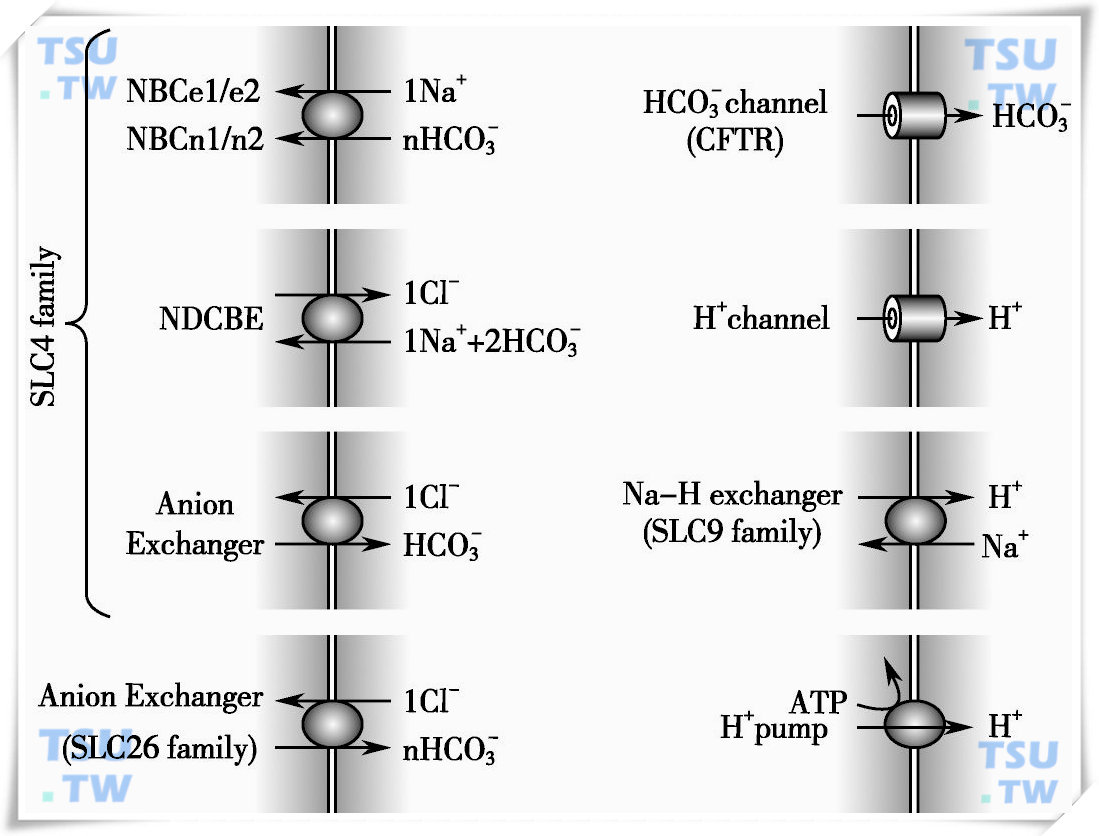
细胞中的pH调控蛋白
主要包括两大类:HCO3-跨膜转运蛋白(包括SLC4家族,SLC26家族,及离子通道CFTR)和H+跨膜运输蛋白(包括质子通道、质子泵,以及钠氢交换蛋白)
精子获能过程伴随着精子胞内pH的升高。要使细胞胞内pH升高,可以有两种策略:①质子外排,即通过质子通道或者钠氢交换蛋白,将细胞中的氢离子排出细胞,使pH升高;②通过主动吸收环境中的HCO3-,中和细胞中的氢离子,使pH升高。
在上面介绍的这些酸碱离子转运体中,除了氢离子泵外,其他作用模式的转运体在精子中均有表达,下面分别介绍。
质子通道
至今在人体中只发现了一个质子通道基因,即HVCN1。该基因编码一个273氨基酸残基的跨膜蛋白Hv1。质子通道Hv1具有以下三个特性:①电压敏感性;②对氢离子具有极高的选择通透性;③对胞外Zn2+非常敏感。
先简单介绍质子通道Hv1的结构特征。Hv1和电压敏感的钠离子通道、钾离子通道及钙离子通道等一样,属于电压敏感的离子通道超家族成员,后面还会介绍精子中存在的两种pH敏感的钙通道和钾通道,他们也属于电压敏感的离子通道超家族。
这些电压敏感的离子通道是由四个重复的基本单元组成的(参见图19-3)。每个基本单元都有6个跨膜螺旋区S1~S6。其中S4富含带正电荷的氨基酸残基,S1~S4是离子通道的电压感受器结构域(voltage-sensing domain,VSD),而S5和S6这两个跨膜螺旋区则是组成这些离子通道的离子跨膜通路的核心部分。钾离子通道基因编码的肽链只有6个跨膜区(S1~S6),四个亚基组成一个同源四聚体,形成一个钾通道。而钠通道和钙通道基因编码的一条肽链上含有四个重复单元,也称为假亚基(pseudo subunit),一个亚基组成一个离子通道。
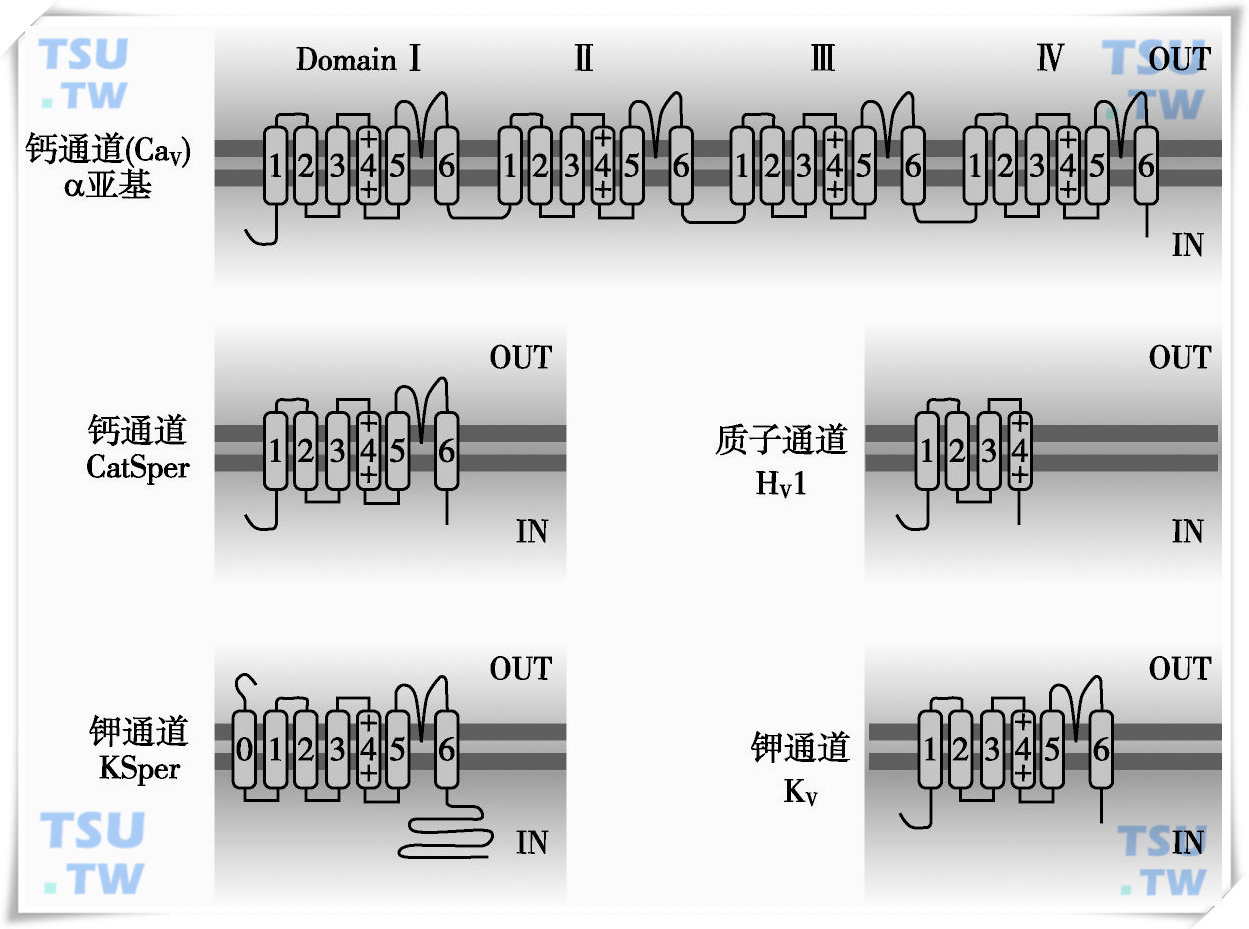
几种离子通道的拓扑结构示意图
在电压敏感的钙通道以及钠通道(没有展示)中,同一条肽链上含有四个重复的单元,每个单元可以称为假亚基(pseudo subunit)。电压敏感的钾通道,以及精子中的钙通道CatSper和钾通道KSper,其单条肽链上只有一个六次跨膜(KSper为七次跨膜)的单元,四个这样的亚基组成一个功能离子通道。质子通道的单条肽链上只有一个四次跨膜的单元,两个亚基组成含有两个离子通路的功能单位。OUT:胞外,IN:细胞内。
与钠通道、钾通道及钙通道不同,质子通道Hv1的单个亚基只有四个跨膜区S1~S4,没有S5和S6,其第四个跨膜区S4也富含带正电荷的氨基酸残基。而且Hv1是一个二聚体,每一个亚基均可以构成一个离子通道,因此一个二聚体含有两个离子通道。但是,钾通道等由四个亚基共同构成一个离子通道。虽然质子通道Hv1与钾通道等在一级结构上及离子通道组成方式上都差别很大,但它们是属于一个超家族。据研究表明,通过单个氨基酸残基突变,可以将钾通道的电压感受结构域VSD转变为质子选择性的通道。
2010年,Lishko等发现人的精子中存在质子通道Hv1的表达。他们通过膜片钳技术及免疫荧光染色研究发现,这种质子通道主要分布在精子鞭毛的主段(principal piece)。这种质子通道可以介导精子中氢离子的外向跨膜运输。Hv1对氢离子的通透性受精子膜电位、精子胞外pH、精子胞外溶液的Zn2+浓度的影响。精子膜电位去极化、精子所处溶液的pH升高、及精子胞外Zn2+浓度的降低均可以促进质子通道的激活。
射精之前,精子储存在附睾中,附睾液是弱酸性的,质子通道不会被激活。相对于其他体液,哺乳动物的精液中富集有较高浓度的Zn2+,这些Zn2+主要来源于前列腺分泌液。综合大量研究报道的结果表明,精液中Zn2+的浓度一般为1~3mmol/L。我们前面提到了,Hv1对于胞外Zn2+高度敏感。膜片钳实验表明,1mmol/L的Zn2+即可完全抑制精子中Hv1介导的氢离子电流,这个抑制浓度非常接近精液中Zn2+的浓度。由于精液中存在很高浓度的Zn2+,所以在精液中精子的质子通道会被抑制。
在雌性生殖道中,精子中的Hv1通道会被激活。首先,通过扩散作用,精液中的Zn2+会逐渐被稀释。第二,输卵管上皮细胞具有吸收Zn2+的作用,会进一步降低生殖道腔中的Zn2+浓度。因此精子到达输卵管中以后,Zn2+对质子通道Hv1的抑制作用完全削除。第三,由于雌性生殖道上皮细胞分泌的黏液含有很高浓度的HCO3-,pH呈弱碱性,碱性pH有利于质子通道Hv1的激活。因此,在雌性生殖道中,精子中的质子通道被激活,介导精子胞内氢离子的外排,促进精子胞内的碱化作用。
钠氢交换蛋白
钠氢交换蛋白(Na+-H+exchanger,NHE)属于SLC9家族(solute carrier 9family)。SLC9家族包括10个不同的基因表达的产物,包括NHE1~NHE9,以及一种在精子中发现的可能是精子特异的sNHE (sperm NHE)。这些蛋白具有广泛的生理学功能,介导胞外钠离子和胞内氢离子的跨膜交换作用,钠离子与氢离子的交换比例为1∶1,因而其离子交换过程是电中性。
NHE1、NHE2、NHE3及NHE4在上皮细胞的酸碱平衡调控中起着重要的作用。其中NHE1分布非常广泛,起着“看家蛋白”(house-keeping protein)的作用。NHE6~9主要分布细胞内的细胞器膜上,比如高尔基体膜以及内体(endosome)等一些细胞中的囊泡结构。这些分布在胞内的细胞器膜上的NHE可能参与这些细胞囊泡结构内的pH调控。
通过钠离子的驱动作用,分布在细胞膜上的NHE可以介导胞外的钠离子与胞内的氢离子之间的交换作用,促进胞内氢离子的外排,从而使胞内的pH升高。
目前在哺乳动物精子中至少已经发现了三种钠氢交换蛋白,包括NHE1、NHE5以及精子特异的sNHE。与质子通道Hv1一样,这些钠-氢交换蛋白主要也是分布于精子鞭毛的主段。有研究报道,通过基因敲除编码NHE1的基因,不影响小鼠的生殖能力。但是,敲除编码精子特异的sNHE的基因,会严重损害小鼠精子的运动能力,导致雄性小鼠完全不育。
有意思的是,在sNHE缺失的小鼠精子中,sAC表达水平下降,sAC活性降低,导致精子的胞内cAMP水平大大下降,从而影响了精子中cAMP依赖的蛋白酪氨酸磷酸化过程。免疫共沉淀研究表明,sNHE和sAC之间可能存在蛋白相互作用。这些研究结果提示,精子胞内与NHE相关的pH调控过程可能对于sAC依赖的信号传导途径很重要。
SLC4家族碳酸氢根离子跨膜转运蛋白
SLC4家族共有10个不同的基因,它们的表达产物主要包括:①三个阴离子交换蛋白(anion exchanger,AE),分别为AE1(SLC4A1)、AE2(SLC4A2)和AE3(SLC4A3);②5个钠离子偶联的碳酸氢根转运蛋白(Na-coupled HCO3-transporter,NCBT),分别为NBCe1(SLC4A4)、NBCe2(SLC4A5)、NBCn1 (SLC4A7)、NDCBE(SLC4A8)和NBCn2(也叫NCBE,SLC4A10)。此外,SLC4家族还包括一个硼酸离子转运蛋白(SLC4A11)和一个功能尚有待进一步研究的SLC4A9。
在这些SLC4家族离子转运体中,AE1~AE3按1∶1的比例介导Cl--HCO3-的跨膜交换作用,是电中性的。NBCe1和NBCe2介导离子跨膜转运时,其Na+和HCO3-的表观离子化学比为1∶2或1∶3。在NBCe1和NBCe2转运离子的同时,伴随有净负电荷的跨膜运动,因此它们介导的离子转运活动会对细胞膜电位产生影响。因而,NBCe1和NBCe2是生电型的。而NBCn1、NBCn2是电中性的,其Na+和HCO3-的表观离子化学比例为1∶1。它们介导的离子转运过程没有净电荷的跨膜运输,对细胞膜电位没有影响。NDCBE也是电中性的,介导Na+驱动的Cl--HCO3-交换作用(Na+-driven Cl--HCO3- exchange)。
SLC4家族的HCO3-跨膜转运蛋白可能是最主要的HCO3-跨膜运输载体,在各种组织中有广泛的表达,包括胰腺导管上皮细胞、肾小管上皮细胞、中枢系统脉络丛上皮细胞以及雌性和雄性生殖道上皮细胞等。在这些组织中,这些SLC4家族的HCO3-跨膜转运蛋白在细胞pH调控、HCO3-跨上皮细胞的运输过程中具有重要作用。
研究发现AE2在精子中有表达。Jensen等通过蛋白免疫印记,发现大鼠精子中有NBCe1的表达。RT-PCR分析的证据表明在小鼠精子中表达的是NBCe1-B。
Demarco等通过电生理学研究证实了小鼠精子中有生电型的NCBT活性的存在。他们发现,在小鼠精子中,HCO3-跨膜转运依赖于胞外钠离子的存在,他们发现这种Na+和HCO3-共转运过程是生电型的,且对DIDS(4,4-diisothiocyanatostilbene-2,2-disulfonic acid)敏感。对Na+的依赖性以及对于DIDS敏感是NCBT(NBCn1除外)的重要特征。Demarco等发现这种生电型的NCBT的活动引起精子细胞膜电位的超极化。综合基因表达的实验证据及Demarco等功能研究的实验结果,NBCe1可能在哺乳动物精子中起着重要作用。另外,研究人员在海胆(sea urchin)的精子中克隆到了一种Sp-NBC,这种NBC与哺乳动物中电中性的NCBT高度同源性。
SLC26家族碳酸氢根离子跨膜转运蛋白
SLC26家族也包括10个基因,这些基因编码的蛋白介导跨膜运输的底物多种多样,包括I-、Cl-、HCO3-、SO24-、甲酸根离子HCOO-以及二乙酸根离子C2O24-。它们主要介导I-或Cl-与其他离子的跨膜交换作用。
根据目前的研究报道,可以参与Cl-和HCO3-跨膜交换作用的SLC26家族成员包括SLC26A3、SLC26A4、SLC26A6及SLC26A9。SLC26A4介导电中性的I--HCO3-或者Cl--HCO3-交换,而SLC26A3、SLC26A6、SLC26A9介导生电型的阴离子交换。
研究报道表明,Slc26a3在豚鼠精子中有表达,免疫组化研究表明,在豚鼠精子中,Slc26a3主要分布在顶体前端区域(anterior acrosome)。这些结果表明,这些阴离子交换蛋白在精子HCO3-跨膜运输中可能具有重要作用,可能参与精子获能过程。
碳酸氢根跨膜运输的离子通道
囊性纤维化跨膜转导调节蛋白(cystic fibrosis transmembrane conductance regulator,CFTR)是一种受cAMP调控的离子通道,属于所谓的ABC超家族成员(ATP-binding cassette superfamily)。编码CFTR的基因突变常常导致囊性纤维化(cystic fibrosis)疾病,这种疾病多见于高加索人种。CFTR对Cl-具有通透性,人们认为其主要起氯离子通道的作用。不过,目前也有很多研究认为CFTR对HCO3-也具有通透性,具有HCO3-通道的作用。
人类CFTR基因突变患者常常伴有生殖力下降,甚至完全不育。有的CFTR基因突变患者表现出先天性双侧输精管缺如(CBAVD)。也有些男性CFTR突变携带者表现为精子质量与数量下降,导致生殖力障碍,表明CFTR对于精子的形成数量及质量都很重要。
CFTR广泛分布于各种上皮细胞中,参与Cl-和HCO3-的跨膜运输,在跨膜上皮细胞的液体重吸收或分泌过程中具有非常重要的生理学作用。此外,CFTR在精子中也有表达。
通过免疫组化发现,在豚鼠精子及小鼠与人的精子中,CFTR主要分布在精子头部的赤道段。香港中文大学的陈小章研究组发现,通过CFTR特异的抑制剂或者CFTR的抗体处理精子,会导致许多精子获能中依赖于HCO3-的过程受到抑制。经过抑制剂或CFTR抗体处理的精子中,HCO3-诱导的精子胞内pH升高、cAMP水平升高、膜电位的超极化等过程均受到一定程度的抑制。体外受精实验发现Cftr+/-杂合子小鼠的精子其运动能力与受精能力均显著低于Cftr+/+纯合子野生型小鼠的精子。这些研究结果表明CFTR对于精子获能以及精子正常受精具有极为重要的作用,这些研究结果可以在一定程度上解释CFTR突变携带者雄性不育的原因。
上面提到了精子中存在的多种不同的HCO3-跨膜转运机制,既有钠离子偶联的碳酸氢根转运蛋白(NCBT),阴离子交换蛋白(Cl--HCO3-exchanger),也有HCO3-离子通道CFTR。这些不同的HCO3-跨膜运输机制之间是什么关系?各种不同的HCO3-跨膜转运机制之间是否可能存在互补性?这些碳酸氢根跨膜转运蛋白和氢离子跨膜运输蛋白之间的相互关系如何?这些问题都还有待进一步研究。
