离子的电化学平衡
细胞内液与细胞外液由细胞膜分隔,细胞膜是由脂质双层构成。假如没有蛋白质的存在,细胞内外离子的分布就遵循电化学平衡规律。因而某种离子在细胞内的浓度可用Nernst方程计算出来:
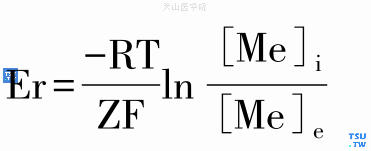
式中:Er为膜电位(V);R为气体常数,其值为8. 314;T为绝对温度,其值为298℃;F为法拉第常数,值为96 500;Z为离子的电荷数,例如Na+为1,Cl-为-1,Ca2+为2等等;[Me]i为细胞内某种离子的浓度;[Me]e为细胞外某种离子的浓度。
以Cl-为例,在非刺激状态下,唾液腺分泌终端的细胞膜电位平均为-60mV(即-0. 06V),细胞外Cl-浓度为135mmol/L,电荷数为-1,则上述方程为:

解上述方程,得[Cl-]i=13mmol/L,这就是Cl-的电化学平衡浓度。当一种离子的细胞内实际浓度明显偏离其电化学平衡浓度时,说明该离子的分布不是被动的,而细胞膜上有转运蛋白存在。
水与电解质分泌模型
一般认为,唾液腺分泌终端细胞水和电解质分泌过程可用Silva等1977年提出的鲨鱼直肠细胞离子分泌模型来描述。近30多年的大量研究结果均支持这个模型。简单而言,参与分泌终端细胞水与电解质转运的共有七种转运系统,即基侧膜上的Na+/K+泵,Na+-K+-2Cl-协同转运蛋白,K+通道、Na+-H+交换器、Cl--HCO3-交换器、顶膜上的Cl-通道、水通道。离子转运动力是来自Na+/K+泵所建立的Na+梯度,即细胞外Na+明显高于细胞内,前者为135mmol/L,而后者仅为15~20mmol/L。离子转运的信号为Ca2+浓度的增加。
如图3-1所示,当毒蕈碱、α1肾上腺素能、P2Y2或P物质受体兴奋时,细胞内Ca2+增高。后者激活顶膜上的Cl-通道以及基侧膜上的K+通道,使Cl-外流到管腔中,而K+外流到血流中。顶膜分泌Cl-吸引Na+通过细胞间的紧密连接进入管腔。同时基侧膜上的Na+-K+-2Cl-协同转运蛋白把Cl-、Na+和K+运入细胞内。对K+和Cl-来说,这是一个逆浓度梯度的过程,但对于Na+来说则反之。这个过程的能量来自Na+梯度。顶膜Cl-通道对HCO3-有通透性,导致HCO3-外流,后者使细胞内与之配对的H+相对浓度增加,因而pH减低。pH减低激活基侧膜上的Na+-H+交换器,引起Na+内流,H+外流,使pH值恢复。腮腺和下颌下腺细胞也含有与Na+-H+交换器相配对的Cl--HCO3-交换器,后者在细胞内pH值增高时激活,引起Cl-进入细胞、HCO3-出细胞,从而使pH值下降,这种情况发生在大鼠腮腺细胞。当细胞受到分泌性刺激时,pH值减低,随后由于Na+-H+交换器的激活常引起pH的反弹性增高。这时Cl--HCO3-交换器激活,使pH值恢复到正常水平。大鼠舌下腺分泌终端细胞缺乏Cl--HCO3-交换功能(见下文)。细胞内蓄积的Na+由钠泵泵出。
水的分泌可能经由两种途径,一种是经由细胞间紧密连接。对这种分泌的机制,目前知之甚少。另一种是经由分泌细胞膜上的水通道(见下文)。
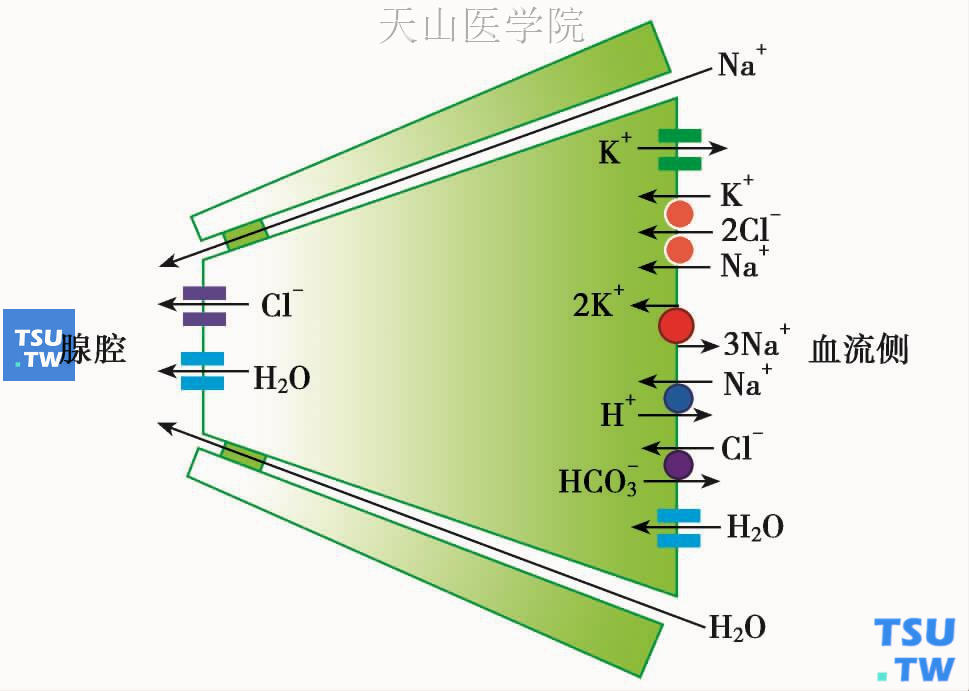
图3-1 唾液腺分泌终端水和电解质分泌示意图
在上述过程中,细胞发生三种生理学变化,即细胞容积、膜电位及细胞内pH均发生改变。分泌的早期,膜电位减低(负值变小),后来逐渐恢复。细胞容积在分泌初期减小,然后逐渐恢复。细胞内pH值的改变早期为酸化,即pH减低,之后逐渐恢复甚至反弹性增高。这些改变均与细胞内Ca2+浓度的变化密切相关。换言之,Ca2+是整个分泌过程的主要信号。
水与离子转运机制
Na+/K+泵
唾液腺分泌细胞跨膜Cl-转运的能量来自Na+/K+泵所形成的Na+梯度,抑制Na+/K+泵则可阻断整个分泌过程。Na+/K+泵的结构和功能早在60年代就已清楚,本文不再赘述。60年代就已证明唾液腺含有很强的钠泵活性。测定3H标记的乌本苷(ouabain)的结合,用生化方法测对乌本苷敏感的依赖Na+和K+的ATP酶,及用免疫组化方法均证明钠泵存在于人、猫、狗、猪、大鼠、小鼠的腮腺、下颌下腺及舌下腺细胞的基侧膜上。尽管也有人报道Na+/K+泵存在于顶膜上,但通常认为是实验误差所造成的。有趣的是,黏液细胞的Na+/K+泵少于浆液细胞,这可能与浆液细胞在短时间内大量分泌的性质有关。
对唾液腺细胞进行代谢研究发现,非刺激状态下唾液腺的ATP消耗为0. 1μmol/(秒•克)组织(湿重),受到分泌性刺激时增高为0. 5μmol/(秒•克)组织。一个重要问题是ATP消耗速率是否足以维持水与电解质分泌所需的能量。当唾液腺受到最大刺激时,分泌速率为0. 6μmol/(秒•克)组织。如果分泌细胞利用Na+-K+-2Cl-协同转运蛋白来驱动分泌过程,每水解一个ATP可泵出3个Na+。上述0. 6μmol/(秒•克)组织的分泌速率则需水解大约0. 1μmol ATP /(秒•克)组织。如果分泌终端细胞也使Na+-H+和Cl--HCO3-配对交换运行,所需的ATP水解速率则需加倍,即0. 2μmol ATP /(秒•克)组织。由此可见,唾液腺ATP消耗速率足以维持分泌过程。
Cl-通道
唾液腺细胞分泌水与电解质的过程是由跨膜的Cl-转运为动力的,因而Cl-通道在分泌过程中起极为重要的作用。近年已经明了,唾液腺分泌终端细胞含有四种Cl-通道。
1) Ca2+激活的Cl-通道:此型是分泌性细胞最重要的Cl-通道,其蛋白为TMEM16A,由TMEM16基因编码。激动副交感神经所引起的Cl-分泌几乎全部是经由此途径。首次直接测定唾液腺Ca2+激活的Cl-通道是在大鼠腮腺腺泡细胞。近年来,许多研究直接测定此通道的性质,它显示很强的外向整流作用。离子选择性为I->NO3->Br->Cl->HCO3-。尽管电压改变不能直接激活这种Cl-通道,但它的激活动力学表明有电压依从性。Ca2+激活的Cl-通道可被Cl-通道的阻滞剂所抑制,例如DIDS(4,4-diisothiocyanatostilbene-2,2'-disulfonic acid)、DDF(1,9-dideoxyforskolin)、NPPB[5-nitro-2-(3-phenylpropylamino) -benzoic acid]、DPC (diphenylamine-2-carboxylate)等。
值得注意的是唾液腺细胞的Ca2+激活的Cl-通道与其他组织的同类Cl-通道有一些差别。例如,牛支气管上皮细胞的Ca2+/钙调蛋白调节的Cl-通道并不是由Ca2+所激活的,而是由Ca2+调节的。其他组织钙调蛋白激活的Cl-通道可被钙调蛋白拮抗剂所抑制,但唾液腺的Ca2+激活的Cl-通道则对这些拮抗剂不敏感。
2) cAMP激活的Cl-通道:这种Cl-通道存在于分泌终端及导管细胞中。通道蛋白质的基因是囊性纤维化跨膜传导调节物(CFTR)基因。临床可见,囊性纤维化患者的唾液腺也被累及,表现为分泌减少,细胞内Na+和Cl-浓度增高。cAMP激活的Cl-通道的电流和电压关系呈线性,其离子选择性为Br->NO3->Cl->I-。它的电生理特点是不受时间和电压的影响,并且对DIDS不敏感,但可被DPC部分抑制。该通道的激活需要cAMP增高和PKA活化,后者使通道蛋白质磷酸化而开放。迄今为止,cAMP激活的Cl-通道在唾液腺分泌终端细胞中意义尚不清楚。
3)细胞容积调节的Cl-通道:腮腺腺泡细胞肿胀可激活此型Cl-通道,相反,细胞容积减小则抑制此通道。这种Cl-通道显示很强的内向整流作用,其离子选择性为I->NO3->Br->Cl-,并对DDF和DIDS敏感。人下颌下腺细胞株HSG也含有这种Cl-通道。考虑到分泌终端细胞在分泌过程中有容积改变,此型Cl-通道有可能参与分泌过程,但仍需研究证实。
4)电压控制的Cl-通道:此型Cl-通道存在于唾液腺分泌终端细胞及导管细胞中,它是由膜电位控制的。已经证明,电压控制的Cl-通道蛋白质是CIC-2。它呈弱的外向整流作用,离子选择性为Cl->Br->I-,未发现任何特异性抑制剂。此型Cl-通道可被膜超级化所激活。在生理状态下,唾液腺细胞膜电位为-50mV到-70mV,足以使之激活。因此在非刺激状态下,电压控制的Cl-通道可能处在激活状态。已知唾液腺细胞有非刺激性Cl-分泌,这种分泌可能经由该Cl-通道。
Na+-K+-2Cl-协同转运蛋白
70年代初期就已发现Na+和K+的协同转运现象,数年后发现,这种转运是与Cl-转运共同进行的,从而证明了Na+-K+-2Cl-转运的性质。
1)性质:Na+-K+-2Cl-协同转运蛋白是电中性转运机制,同时转运一个Na+、一个K+和两个Cl-。三种离子必须同时存在,任何一种离子的缺乏均可明显抑制整个协同转运机制。Na+-K+-2Cl-协同转运的方向取决于细胞种类,亦取决于蛋白所处的位置。在分泌细胞,它大多处于基侧膜,其转运方向是从血流转运离子进入细胞,但在吸收性上皮,如肾小管上皮细胞,其分布是在顶膜,功能是重吸收单价离子。Na+-K+-2Cl-协同转运蛋白的特异性抑制剂是磺胺类环状利尿剂,包括速尿灵。Na+-K+-2Cl-协同转运蛋白的cDNA序列已经清楚,由此也弄清了它的蛋白形式。迄今,已经有两种亚型被鉴定,即NKCC1和NKCC2。前者存在于大多数分泌性上皮细胞,如胃、大肠、肺、支气管、胰和唾液腺上皮细胞。NKCC2则只存在于肾亨利襻的小管细胞。
2)激活:Na+-K+-2Cl-协同转运蛋白可被以下几种因素激活:激素刺激、细胞容积缩小、细胞内Cl-浓度减低。
①激素刺激:凡可使细胞内cAMP水平增高的激素均可引起NKCC1的活化,活化的机制是使NKCC1磷酸化。然而,cAMP引起的磷酸化并不是经由激活PKA,因为NKCC1并没有PKA的磷酸化位点。研究证明,cAMP增加可引起Cl-通道开放,从而使细胞内Cl-浓度减低。后者是激活NKCC1的原因。
②Cl-浓度的减低:现已清楚,细胞内Cl-浓度减低是激活NKCC1的最有效的因素。Cl-浓度减低也可使NKCC1磷酸化。
③细胞容积缩小:任何可引起细胞容积缩小的因素均可激活NKCC1。例如用高渗溶液培养细胞可激活NKCC1。事实上,细胞容积也是由细胞内Cl-浓度来调节的,因而,细胞容积改变也可能反映了Cl-浓度的作用。
④细胞骨架的作用:细胞骨架的状态对NKCC1有很大影响。用纤维状肌动蛋白稳定剂如鬼笔环肽(phalloidin)或类鬼笔环肽(phallacidin)处理细胞可抑制纤维状肌动蛋白的再分布,从而也抑制了NKCC1的活化,使Na+-K+-2Cl-转运减低。与之相反,用细胞松弛素(cytochalasin D)破坏纤维状肌动蛋白微丝则可激活NKCC1。这些现象均表明细胞骨架可能参与Na+-K+-2Cl-协同转运的调节。
⑤尿素:尿素可抑制Na+-K+-2Cl-协同转运。用软海绵酸(okadaic acid)预处理细胞可防止尿素的这种抑制作用,表明尿素可能激活某些蛋白质的磷酸酶,从而使Na+-K+-2Cl-协同转运蛋白失活。
K+通道
另一种至关重要的离子转运机制是基侧膜上的K+通道。K+通道不能大量转运Cl-,但在Cl-通道开放时,必须伴随有K+通道的开放,否则由于电化学平衡的缘故,Cl-无法外流。研究证明,抑制唾液腺细胞的K+通道可抑制Cl-分泌。K+通道的作用是:1)使质膜电位处于超级化状态,从而为阴离子分泌提供动力;2)为Na+-K+-2Cl-协同转运蛋白及钠泵提供条件;如果细胞内K+持续处于高浓度状态,Na+-K+-2Cl-协同转运和钠泵均无法有效工作。
K+通道是一个大家族,已经鉴定的K+通道已达50多种。按照其性质,K+通道可被分为四大类,即电压调节的K+通道(Kv),Ca2+激活的K+通道(Kca),内向整流K+通道(Kir)和串联孔区K+通道(tandem pore domain K+channel)。其中电压调节的K+通道又分为Kv1. 1~1. 8、Kv2. 1~2. 2、Kv3. 1~3. 4、Kv4. 1~4. 2、Kv5、Kv6、Kv7、Kv8和Kv9;Ca2+激活的K+通道又分为高电导、中电导和低电导通道三种。内向整流K+通道又分为Kir1. 1a、Kir1. 1b、Kir2. 1~2. 3、Kir3. 1~3. 4、Kir4. 1、Kir5. 1、Kir6. 1~6. 2。串联孔区K+通道又分为KWIK-1、KREK-1、TASK和TRAAK。已知唾液腺细胞含有高电导Ca2+激活的K+通道,即maxi K通道,其基因为Kcnmal。唾液腺也含有中电导Ca2+激活的K+通道,即IK1通道,基因是Kcnn4。唾液腺细胞缺乏这两种通道之一并不影响水与电解质的分泌,只有当二者同时缺乏时分泌才会受阻,表明任何一种足以支持液体分泌。
用乙酰胆碱刺激唾液腺的分泌终端使质膜阻力减低,并引起膜电位的改变。后者可能为超极化或先超极化,然后去极化,或者更复杂的模式。这种改变是由于K+外流所造成。已知乙酰胆碱所激活的K+外流机制亦可使Cl-通过,但Na+不能通过。这种K+外流是经由电压和Ca2+激活的K+通道。它的激活是膜去极化以及胞质内Ca2+浓度增高。胞质内Mg2+也有控制作用。这种K+通道选择性地允许K+通过,而不允许Na+、Li+和Cs+通过,但Rb+可大量通过。Ca2+激活的K+通道可被细胞外四乙胺所阻滞。细胞内应用Cs+可抑制此类K+通道。这类通道存在于人腮腺、下颌下腺、大鼠下颌下腺、小鼠腮腺和下颌下腺以及羊腮腺。大鼠泪腺和腮腺每个细胞含有50~150个Ca2+激活的K+通道。
羊腮腺分泌性细胞的基侧膜含有大量内向整流K+通道。这种通道通常存在于心肌,是K+进入细胞的途径,其电导为细胞外K+浓度的平方根。这种通道可被细胞外液中低浓度的Cs+和Ba2+所抑制。然而,它与肾脏细胞的内向整流K+通道不同,不受细胞内pH减低及ATP的抑制。这种通道的意义可能在于:①它可能是羊腮腺细胞在非刺激状态下持续性产电性K+流的途径,可能为自发性分泌提供动力;②它可能是细胞摄取的K+途径之一。这种K+通道要求膜电位比Nernst方程所计算的更偏向负的一侧,因而在安静状态下似乎不大可能。但在细胞分泌过程中,细胞内K+减低,细胞间隙K+升高到10mmol/L以上。因此,K+电位在分泌时偏向正的一侧,内向整流K+通道可以从细胞间隙摄取K+。
最近的研究发现,唾液腺细胞的胆固醇调节细胞膜上的K+通道功能;胆固醇的减少减弱Ca2+激活的中电导K+通道。
Na+-H+交换器
Na+-H+交换器几乎存在于所有的细胞,其功能是催化细胞外Na+与细胞内H+进行电中性交换。Na+-H+交换在细胞内pH调节方面起极为重要作用。其他调节细胞内pH的机制有Na+-HCO3-协同转运、Cl--HCO3-交换及H+泵。唾液腺细胞质膜有Na+-H+交换和Cl--HCO3-交换,没有Na+-HCO3-协同转运,也没有H+泵,但细胞内分泌颗粒膜上可能有H+泵。
1) Na+-H+交换器亚型:已经鉴定的哺乳动物细胞Na+-H+交换器至少有六种,即NHE1~6。NHE1约为815~820个氨基酸组成,其mRNA存在于几乎所有的哺乳动物细胞内,只有大鼠肾脏近侧小管的S1和S2皮质节段,以及负鼠肾脏细胞例外。免疫组化研究使用NHE1特异性抗体证明,NHE1存在于各种上皮细胞的基底侧膜上。NHE1可被氨氯吡嗪脒(amiloride)抑制,50%抑制浓度(Ki)为1~3μmol/L。氨氯吡嗪脒衍生物乙基异丙基氨氯吡嗪脒(ethylisopropyl amiloride,EIPA)亦能抑制,Ki为20nmol/L。
NHE2表达于家兔的空肠和回肠,人空肠、回肠和结肠的刷状缘膜上,以及大鼠空肠、肾皮质等细胞。NHE2由809~813个氨基酸残基构成,其mRNA分布于胃、子宫、肾、小肠、肾上腺等器官,支气管和肌肉也含有少量。NHE2的功能仍不清楚,可能与调节细胞容积有关。NHE2对氨氯吡嗪脒的敏感性与NHE1类似,Ki为1~3μmol/L,但对其衍生物EIPA的敏感性则比NHE1低50倍,Ki为1μmol/L。
NHE3可能只存在于家兔近侧小管、空肠、回肠和结肠的刷状缘细胞,以及人空肠、回肠和直肠细胞。其功能亦不清楚,可能与Na+吸收有关。NHE3对氨氯吡嗪脒和EIPA均不敏感,Ki分别为39μmol/L和8μmol/L,比NHE1的Ki分别高39和400倍。
NHE4只存在于大鼠组织。它在等渗状态下没有活性,但高渗状态可使其活化。即使激活之后,活性也很低。NHE4 mRNA在胃中最丰富,小肠和结肠次之,肾、脑、子宫和骨骼肌中活性更低。
NHE5存在于非上皮细胞中,如脑、脾、睾丸、骨骼肌等,其功能不详,可能是一类对氨氯吡嗪脒不敏感的NHE变种。
NHE6表达于数种人体组织中,包括脑和骨骼肌,其氨基酸组成只有20%与其他5种亚型相同,功能未明。
功能研究已经反复证实,唾液腺细胞含有Na+-H+交换器。分子生物学研究证明,大鼠腮腺腺泡细胞含有NHE1,位于基底膜上。导管细胞含有NHE1和NHE3,NHE1位于基侧膜上,而NHE3则位于顶膜上。大鼠下颌下腺分泌终端细胞基侧膜上含有NHE1,而导管细胞基侧膜含有NHE1,顶膜含有NHE2。NHE1受P2Y2受体的调节,而NHE2则受P2Z受体的调节,但尚不清楚哪种P2Z亚型参与这种调节。由于NHE3的功能是吸收Na+,唾液腺导管细胞顶膜含有NHE3与其功能相符。
2) Na+-H+交换的激活:Na+-H+交换功能的激活的主要因素之一是细胞内pH减低。当唾液腺分泌终端受到副交感神经刺激时,细胞内Ca2+增高,pH减低,Na+-H+交换激活。而导管系统的Na+-H+交换激活过程仍不完全了解。Na+-H+交换激活可能是由于细胞内pH减低,或者是由于Ca2+增高。迄今为止,还不能把pH减低和Ca2+增高的作用完全区别开来,因为pH减低也是Ca2+激活的。
3)细胞间的差异:Na+-H+交换在不同的细胞之间有很大差异。如上所述,分泌终端细胞与导管细胞所含的NHE亚型不完全相同。而且,不同腺体之间也有差异。大鼠腮腺腺泡细胞毒蕈碱受体受到刺激时细胞内pH呈短暂减低(约0. 1 pH单位),1~3分钟内恢复,此后呈反弹性增高,即细胞内碱化。抑制Na+-H+交换功能可使这种现象消失,说明是由于Na+-H+交换的过度运行。与此不同,大鼠舌下腺分泌终端细胞受到同样刺激时呈现类似的pH减低(约0. 2 pH单位),大约在3~5分钟内恢复正常水平,但从不出现反弹性增高的现象。这种细胞间差异的机制仍不清楚,推测可能是由于混合(浆黏液)细胞与黏液细胞之间的差异。
4) Na+-H+交换活性的调节:Na+-H+交换活性至少受五种因素的调节:酪氨酸激酶、PKA、PKC、Ca2+及细胞容积的改变。最重要的调节方式可能是NHE蛋白的直接磷酸化。已经证明,NHE的氨基酸序列中含有磷酸化位点,可被PKA和C以及钙调蛋白激酶所磷酸化。促分裂原激活的蛋白激酶(MAPK)亦可使NHE磷酸化。此外酪氨酸激酶激活剂如生长因子或磷酸酶抑制剂等均可激活Na+-H+交换。近来的研究认为,Na+-H+交换的激活还需要一些相关蛋白如钙调蛋白、钙调磷酸酶B(calcineurin B)同源蛋白以及hsp70蛋白等。也有人认为G蛋白可激活Na+-H+交换功能。活化的Gqα、Gα12、Gα13等均可激活Na+-H+交换。小G蛋白也有这种作用,如Ras。这可能是通过激活其下游的信号元素如Raf、MEK1、MEK2以及MAPK等。
Cl-HCO3交换器
--功能性研究证实,唾液腺细胞含有Cl--HCO3-交换机制。大鼠腮腺和家兔下颌下腺细胞的Cl--HCO3-交换功能在细胞内pH减低时受到抑制。
一般认为,唾液腺的Cl--HCO3-交换器相当于其他细胞的三带蛋白(band 3 protein)。后者是一种95kDa膜蛋白,存在于多种细胞,但以红细胞膜上最丰富,因此研究得也最清楚。每个红细胞平均表达1. 2×106个Cl--HCO3-交换器。三带蛋白的主要功能有:①催化Cl--HCO3-交换;②维持细胞形状;③维持细胞膜稳定性。三带蛋白维持细胞形状及稳定细胞膜的功能与其结构有关,它与细胞内锚蛋白相结合,而后者又与血影蛋白结合,血影蛋白又与4. 1带蛋白结合而固定于细胞膜上。唾液腺细胞的Cl--HCO3-的交换器是否以类似的方式存在,仍不了解。
从功能性研究结果推测,Cl--HCO3-交换和Na+-H+交换是配对运行的。当Na+-H+交换使细胞内H+减少、pH增高时,Cl--HCO3-交换功能激活,使HCO3-运出细胞、Cl-进入细胞,使pH恢复正常。Cl--HCO3-交换有明显的细胞差异。大鼠腮腺腺泡细胞呈现很强的Cl--HCO3-交换功能,但舌下腺分泌终端细胞则没有这种功能。这可能是由于腮腺细胞pH调节过程中有反弹性碱化现象,需要配对Cl--HCO3-交换功能,而舌下腺细胞没有反弹性碱化发生,不需要这种功能。然而有趣的是,分子生物学研究发现,舌下腺细胞也有Cl--HCO3-交换器的mRNA表达,但不知是否有三带蛋白的合成。
其他离子转运蛋白
尽管现在流行的水与电解质分泌模型并不需要其他电解质转运系统参与(见图3-1),但并不能排除这些可能性。已经发现,还有数种离子转运体系参与水与电解质分泌过程。
1)非选择性阳离子通道:业已证明,在唾液腺分泌终端细胞的基底膜上,有一种Ca2+激活的非选择性阳离子通道允许多种阳离子通过,但它在水与电解质分泌过程中的地位仍未确定。已知此类通道存在于大鼠和小鼠的腮腺、下颌下腺以及人腮腺、下颌下腺分泌细胞,但不存在于羊的腮腺。此型通道的特点是电流-电压关系呈线性,在150mmol/L NaCl介质中(20℃)为25~35pS。它只允许阳离子通过,但对一价阳离子没有选择性,Na+、K+、Rb+、Cs+、Li+和NH4+均可通过。从其对阳离子通透性计算,它的孔径为0. 49nm。Mg2+也可通过,但通透性只相当于Na+的1/20。虽然对Ca2+和Ba2+的通透性了解较少,但已有研究证明,Ca2+也能由此通道进入细胞。
非选择性阳离子通道是由Ca2+激活的。在大鼠胰腺细胞和泪腺细胞,激活需要细胞内游离Ca2+浓度达1~10μmol/L,而在其他组织则需100μmol/L。生理状态下,细胞内Ca2+浓度很少达到如此高的水平。生理浓度的胞质内腺苷酸可抑制此通道。Cl-通道抑制剂DPC也有抑制作用。
Ca2+激活的非选择性阳离子通道的生理学作用不明。它的开放将导致Na+内流,其结果必将使膜电位减低,使分泌的动力减小,从而减弱分泌。研究证明,正常的分泌性刺激可激活非选择性阳离子通道,因而其生理意义仍然是个谜。
2) Na+-HCO3-协同转运蛋白:大鼠舌下腺分泌终端细胞不含有Na+-HCO3-协同转运体系,但其他唾液腺是否含有仍不清楚。已知羊和牛的腮腺分泌高浓度HCO3-,推测这些组织可能含有Na+-HCO3-协同转运蛋白。
3) Na+-PO43-协同转运蛋白:已经证明,羊腮腺细胞基侧膜上有Na+-PO43-协同转运蛋白。羊腮腺的初始唾液中磷的浓度比血浆中高10倍,提示存在有特异性磷转运体系。
水通道
90年代以前,水的分泌被普遍认为是通过细胞间连接,动力是渗透压梯度。换言之,由于Cl-和Na+分泌使管腔内的渗透压增高,水被吸引进入管腔。后来发现,分泌细胞含有一种或数种特殊通透蛋白,即水通道蛋白(aquaporin,AQP)。AQP可形成通道,选择性允许水通过。1992年,第一个水通道蛋白CHIP28(即AQP1)被克隆。迄今已知有13种水通道蛋白存在于哺乳动物细胞内,即AQP0~12,其蛋白质和基因已被分离鉴定。
水通道蛋白的结构特点是:以单体存在,其C末端和N末端均在细胞内,并有6个跨膜区,由此形成5个环;3个在细胞外,2个在细胞内。水通道是由这些环折叠形成的。
1) AQP0:AQP0是26kDa蛋白质,主要表达在晶状体纤维细胞。唾液腺细胞不表达AQP0。
2) AQP1:AQP1表达在许多组织中,包括肾、肺、眼睛、红细胞、脉络丛、胆管等。肾脏的近侧小管、亨利襻的下降支均有大量表达。它在细胞内位于基底膜和顶膜上。AQP1的表达在人、猪、大鼠肾脏十分相似。PKA可能刺激其表达。已知糖皮质激素可明显增加其表达。大鼠腮腺、人腮腺、下颌下腺、舌下腺、唇腺均表达AQP1mRNA,但腮腺的AQP1主要表达在毛细血管和肌上皮细胞。用毛果芸香碱刺激缺乏AQP1基因的小鼠,其唾液分泌并不改变,表明AQP1不是正常唾液分泌所必需。
3) AQP2:AQP2表达在肾收集管上皮细胞,在水重吸收过程中起重要作用。唾液腺细胞没有AQP2。
4) AQP3和AQP4:AQP3表达在肾收集管基底侧,也表达在胃肠道、肺支气管及眼睛等组织。肺上皮的AQP3表达受糖皮质激素的调节,可能在肺的水分重吸收过程中起重要作用。此外,AQP3亦可转运甘油。AQP4主要表达在神经胶细胞,也表达于视网膜、肺上皮细胞、胃肠道和肾收集管。
唾液腺细胞是否表达AQP3和AQP4,仍有争议。RT-PCR测定显示人腮腺、下颌下腺、舌下腺、唇腺均表达AQP3与AQP4,但尚未证实有这些水通道蛋白存在于唾液腺组织。
5) AQP5:AQP5的cDNA是从大鼠唾液腺分离出来的。它对唾液、泪液和肺液体的分泌极为重要。AQP5的mRNA和蛋白质均表达在所有大唾液腺及唇腺的分泌终端细胞,尤其是顶膜上。导管细胞没有表达,这与导管系统对水没有通透性的理论一致。研究证实,AQP5也存在于肺Ⅰ型细胞、支气管细胞的顶膜。
进一步研究发现,大鼠腮腺细胞的AQP5是在细胞内部的膜上,用乙酰胆碱刺激时,很快(在1分钟内)输送到顶膜上,几分钟之后又转运回内部膜上。这个过程是由刺激胆碱能受体引起的,是一个依赖Ca2+和NO信号系统的过程。非刺激状态下,90%AQP5位于一种细胞内结构。胆碱能受体或α1肾上腺素能受体受到兴奋时,如用乙酰胆碱或肾上腺素刺激时,AQP5就会在很短时间内被输送到质膜上。这个过程是由一种称为“脂筏”(lipid rafts)的结构完成的。脂筏富含胆固醇和鞘糖脂,但其具体结构尚不确定。脂筏也有其他功能,如膜的分选与输送(membrane sorting and trafficking)、受体信号传递、胆固醇稳态的维持,也可能参与某些蛋白质的分选。
脂筏的标志物是flotillin-2和GM1,前者是一种与脂筏结合的膜蛋白,而后者是与脂筏缔合的一种鞘糖脂。用共聚焦荧光显微镜造影发现,在非刺激状态下,AQP5与flotillin-2和GM1共存于大鼠腮腺的胞质中,表明AQP5是在脂筏中。用梯度离心法分离大鼠腮腺细胞的细胞器也证明AQP5与flotillin-2及GM1结合。
用细胞松弛素处理可阻断胆碱能兴奋剂乙酰胆碱或西维美林引起的AQP5转移,表明细胞骨架是AQP5转移所必需。AQP5从胞质转移到质膜的过程需要细胞内Ca2+浓度的增高。Ca2+离子载体A23187可以引起AQP5转移,而Ca2+释放抑制剂TMB-8可阻断胆碱能兴奋剂引起的AQP5转移。
此外,舍格伦综合征患者小唾液腺的AQP5多分布在基侧膜上,顶膜上相对较少。用TNFα抗体治疗后,顶膜上的AQP5增加。也有一些研究表明,小鼠唾液腺细胞中的AQP5不仅存在于顶膜,也存在在基膜。理论上讲,基膜应该有水通道存在;否则,细胞内的水就失去了来源。
6) AQP6和AQP7:AQP6主要表达于肾脏,具体位置不明。AQP7主要表达在精子,在肾和心脏也有少量表达,它可转运甘油。个别实验发现人腮腺表达AQP6和AQP7 mRNA,但其他研究未能重复这些结果。
7) AQP8:AQP8是一种27kDa蛋白质,主要表达在肝、胰腺和睾丸细胞,在大肠和唾液腺亦有少量表达。小鼠AQP8高度表达于胎盘、结肠、肝和心脏,可转运尿素。AQP9表达在脂肪细胞,在心脏、肾脏和小肠也有少量表达。
有些研究发现,AQP8表达在大鼠下颌下腺腺泡细胞的基膜,但后来的几个研究发现,AQP8是表达在分泌终端周围的肌上皮细胞,并不在腺泡细胞与闰管细胞内。微矩阵分析发现,衰老的大鼠下颌下腺AQP8明显减少。敲除AQP8基因并不引起小鼠唾液分泌减低。
8) AQP9:AQP9也可转运甘油,推测在脂肪分解过程中,甘油的运出是经过AQP9。
9) AQP10~12:近年来,AQP10~12被发现,但其确切功能还不清楚。已知AQP10表达在小肠和睾丸。AQP11的mRNA和蛋白存在于大鼠的多种组织,包括肾、肝、睾丸、脑。把AQP11表达在海胆卵细胞质膜上并不能转运水、甘油、尿素或离子。AQP12存在于小鼠胰腺的腺泡细胞。至今还未见到唾液腺含有AQP10~12的报道。
一般认为,唾液腺分泌细胞中所含的水通道主要为AQP5。迄今,对其功能的调节尚不完全清楚。1997年,有人曾将AQP1的cDNA转到放射线处理后的大鼠唾液腺中,成功地使唾液分泌量增加了2~3倍,从而为基因治疗唾液腺功能低下带来了希望。近年的研究也发现,AQP5在唾液腺细胞的容积调节方面起重要作用。
胞质在水与电解质分泌中的作用
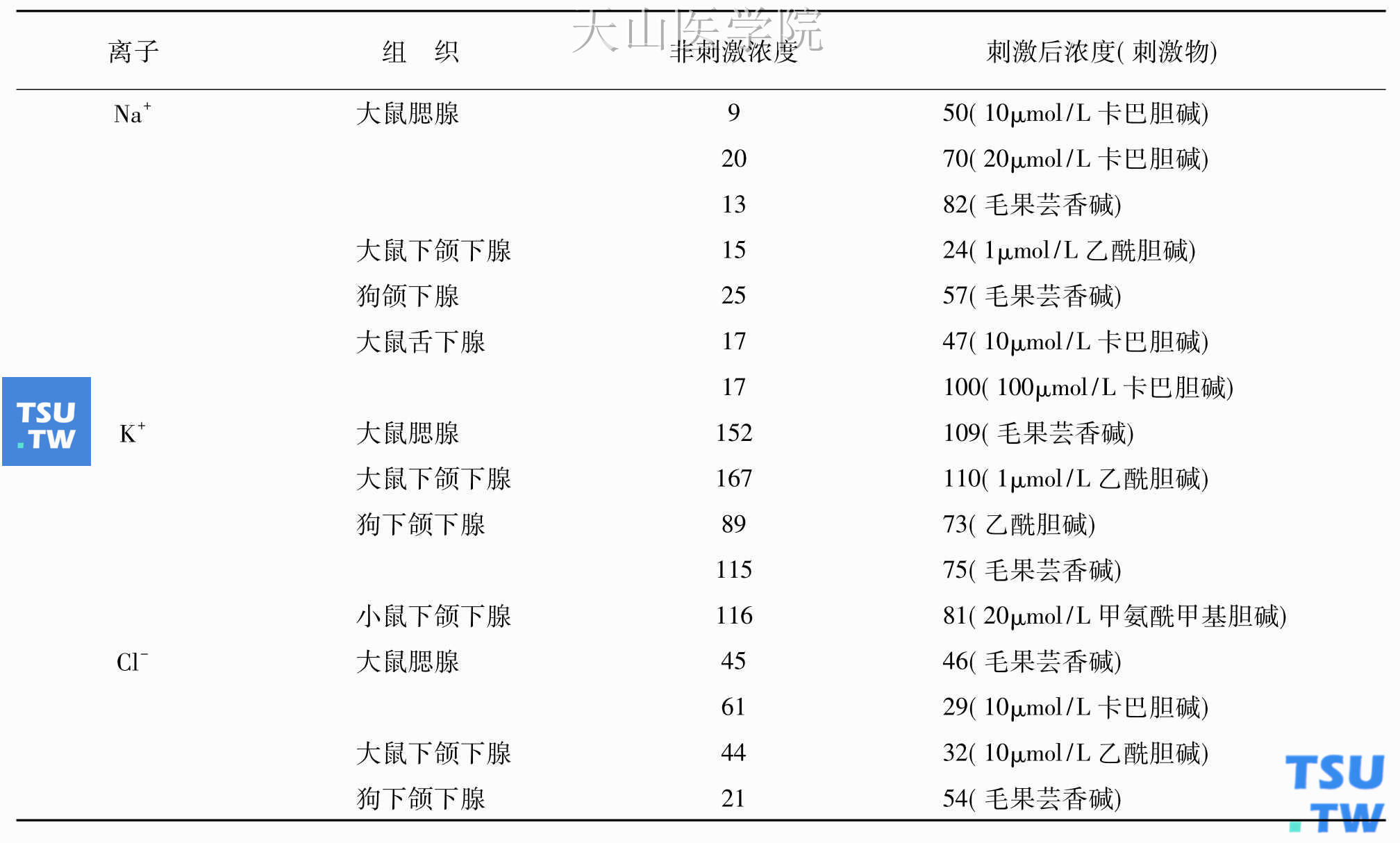
直到最近,技术的发展才使精确测定细胞质内的离子浓度成为可能。研究发现,胞质内的离子浓度在水与电解质分泌过程中举足重轻。表3-13列出了唾液腺细胞胞质内Na+、K+和Cl-的浓度。从表中可以看出,细胞内Na+浓度为10~20mmol/L,刺激毒蕈碱受体使之增高,表明Na+的内流。抑制Na+-K+-2Cl-协同转运机制及Na+-H+交换可阻止胞质内Na+浓度的增高,表明内流途径是这两种离子转运机制。与此相反,非刺激状态下胞质内K+浓度很高,在90~160mmol/L之间,刺激毒蕈碱受体使之减低到73~110mmol/L,表明K+外流。Cl-的情况则稍微复杂。一般认为,分泌反应引起Cl-浓度减低,但由于Na+-K+-2Cl-协同转运机制及Cl--HCO3-交换器的作用,Cl-的浓度可在短期内恢复。许多研究证明,如果破坏胞质内外的离子浓度梯度,就可有效地干扰细胞分泌反应。这些结果清楚表明,胞质内外的离子浓度梯度是唾液分泌的动力。
细胞侧隙的作用
由于唾液腺分泌是在特定的环境中进行的,环境对细胞的作用不可忽略。唾液腺分泌终端细胞之间靠紧密连接相维系,而细胞之间有很大空间,称为细胞侧隙(lateral intercellular space)。细胞侧隙的大小可用下述方式计算:已知唾液腺实质的80%是由分泌终端构成的,假定分泌终端是管泡型,具有160μm长的柱状导管,其外径为45μm,内径为4μm,半球型终端的直径为45μm,其容积为0. 278×106μm3。每克实质组织的体积为1ml,则每克组织所含的分泌终端为2. 88×106个。如果分泌终端的小管部由6个细胞构成,长度为8个细胞,这个分泌终端的基底膜加侧膜总面积为0. 112×106μm2,侧膜面积为0. 086×106μm2,基膜面积为0. 026×106μm2,顶膜面积仅为0. 002×106μm2。可见,侧膜面积是基底膜面积的3倍以上,而基底膜和侧膜面积则为顶膜面积的60倍。紧密连接的宽度为5nm,其总面积约为顶膜面积的0. 1%。一个重量为1克的唾液腺,其基侧膜总面积为3168cm2,而顶膜总面积为59cm2。唾液腺分泌的速率为300μl/(min•g)组织。由于水和电解质分泌是跨细胞转运,上述速率意味着经过顶膜的液体分泌速率为5μl/(min•cm2)。如果液体是经过细胞间的紧密连接分泌的,流过紧密连接的速率就会大1000倍。Cl-经过顶膜的速率为0. 6μl/(min•cm2),相当于短线电流965μA/cm2。这比角膜液体流率大10倍,比胰腺分泌速率大100倍。
表3-13 唾液腺细胞内Na+、K+和Cl-的浓度(mmol/L)
吸收性上皮的情况稍有不同。目前的看法仍然是大部分水的吸收是经跨细胞转运的,是否经过紧密连接转运争议很大。一方面,细胞间紧密连接的面积仅仅为顶膜面积的0. 1%(见上文),所以难以胜任观察到的水流速率。另一方面,质膜水传导率却足以胜任观察到的水流速率。因而水转运很可能大部分是经跨细胞转运的。事实上,水通道的发现也为此提供了进一步的证据。
有一种理论认为水的分泌是靠渗透压梯度的作用。用磁共振法研究大鼠和家兔下颌下腺细胞基侧膜水通透性表明,水的转运速率为3×10-3到6×10-3cm/s,则整个腺体为3cm2/s。家兔和大鼠下颌下腺渗透性水通透性约为3~18μl/(min•mmol•g)。因而,靠渗透压梯度而使分泌速率达到实验观察到的最大速率所需的渗透压梯度要比实际值大得多。可见仅靠渗透压梯度是不够的。这也从另一个侧面证明了跨膜水转运的重要性。
血管和血流的作用
血液是唾液腺分泌的供给线,不断提供水与电解质。如果没有血液的丰富供应,唾液分泌会在极短的时间内完全停止。当家兔的副交感神经受到刺激时,唾液流率可以从0增加到700μl/(g•min),而唾液腺的血流增加20倍,从0. 6ml/(g•min)到12ml/(g•min)。在稳态下,唾液腺每分钟的分泌量相当于唾液腺重量的三分之一。Clough和Smaje(1984)发现,唾液腺的毛细血管总面积为500cm2/g组织,相当于心脏血管的密度,是机体中血管密度最高的器官之一。在非刺激状态下,唾液腺血流量与氧消耗量相当于骨骼肌的5倍。可以毫不夸张地讲,唾液来自血液。在唾液分泌时,血流量与氧消耗量比任何器官都高。然而,血液如何为唾液腺提供水和电解质补充却长久被忽视,是唾液腺研究的薄弱环节之一。
唾液腺分泌时,初始唾液为等渗溶液,其直接来源主要为细胞间隙。分泌开始后,腺体重量及体积减小,开始从细胞间隙汲取液体。这种液体的流动引起细胞间隙中的蛋白质浓度增加、渗透压明显增高,从而使分泌的阻力增大。由于间隙的溶质渗透压的增高,液体从血管流入细胞间隙增加,使蛋白质浓度和渗透压恢复,以保持分泌的继续。血管内溶质渗透压的改变可被持续不断的血液流动缓冲。唾液腺的细胞间隙的空间相当于唾液腺体积的25%,这需要间隙的流率很高,以免间隙的溶质渗透压上升。不难看出,整个过程要求要有大量的血液供应。
毛细血管对水和溶质的通透性很高,而对蛋白质则没有通透性,这对整个系统非常重要。假如毛细血管可以漏出蛋白质,细胞间隙中的蛋白质浓度将会增高很多,渗透压就会大大增加,从而形成压力梯度,使液体不再向唾液腺细胞方向移动,分泌就无法进行。
毛细血管的通透性在不同的区域可能有差别。一般认为,分泌终端的毛细血管的通透性大于导管系统的毛细血管的通透性。
紧密连接的作用
目前对唾液腺紧密连接的了解仍然很少。已知猫舌下腺是“渗漏性”组织。早期的研究发现,猫舌下腺跨上皮电阻很低,比其他唾液腺上皮低数十倍。形态学研究也发现,唾液腺细胞紧密连接的通透性很强,例如,La3+可通过大鼠腮腺腺泡的紧密连接。当有自主神经激动剂刺激时,辣根过氧化物酶亦可穿过紧密连接。这种渗透性紧密连接也存在于大鼠腮腺、舌下腺分泌终端。这些研究表明,唾液腺的紧密连接可能只有少数嵴,因而通透性很强。尽管如此,家兔下颌下腺唾液中只含有极少量的直径大于0. 4nm的亲水分子,表明紧密连接仍然可阻挡大部分物质的通过。值得注意的是,刺激自主神经可引起通透性的增高。
亲水性非电解质是否亦可通过紧密连接,仍不了解。但是研究证明,尿素进入唾液要比进入胞质内快得多,提示可迅速通过紧密连接。
假如唾液腺水和电解质分泌的机制是跨上皮离子转运,紧密连接的作用就十分重要。它不仅仅是渗漏性结构,而且应该是阳离子选择性结构。这样,经顶膜Cl-通道进入如管腔中的Cl-就不会反流到细胞侧隙内,从而保持渗透压梯度,吸引Na+和水进入管腔。这种现象已为众多实验研究证明。
电解质分泌过程中的电流
唾液腺分泌终端细胞电解质分泌是一个阴离子和阳离子平衡转运过程。整个过程中,有6个Cl-经顶膜Cl-通道外流,也有6个Cl-经Na+-K+-2Cl-协同转运进入细胞;有3个Na+经Na+-K+-2Cl-协同转运进入细胞,3个Na+被Na+/K+泵泵出;有5个K+经由Na+-K+-2Cl-协同转运及钠泵进入细胞,相同数目的K+经K+通道流出细胞。有6个Na+经紧密连接进入管腔。在这个过程中,Cl-外流,Na+流入管腔及K+流出细胞均为产电性转运,从而构成一个电流环路。电流从管腔跨细胞流向基底侧,然后从基底侧经细胞侧隙及紧密连接流回管腔。
