在睾丸中,精子的发生与成熟是一个非常复杂的过程,详细见本书第二和第三章。简要过程概括为:首先,精原细胞(spermatogonia)形成精母细胞(spermatocyte),后者通过分裂形成圆形的精子细胞(spermatid)。这种圆形的精子细胞通过变形过程形成带鞭毛的精子,精子被释放到生精小管(seminiferous tubules)管腔中。精子经过输出小管(efferent duct)汇集到附睾,期间经过进一步的成熟,形成成熟的精子,并储存于附睾尾。储存于附睾尾的精子在形态方面已完全成熟,但是它们仍然处于一种静默状态(quiescent state),其运动受到抑制。雄性生殖道腔中液体环境的pH与上述这一系列精子的发生、变形、成熟及储存等生理过程具有非常密切的关系。
本章第二节已述及,在机体中,碳酸氢根离子浓度[HCO3-]和pH之间存在着对应关系。[HCO3-]高,则pH高;反之,[HCO3-]低,则pH低。雄性生殖道中的液体呈弱酸性,其pH低于血液的pH。相应地,雄性生殖道管腔中的[HCO3-]亦显著低于血液中的[HCO3-]。
早在1971年,Levine &Marsh以大鼠为对象,研究了雄性生殖道管腔各部分的离子浓度及pH情况(下表)。由表中数据可以看出,在睾丸的生精小管中,[HCO3-]和pH值比较接近血液中相应的参数(血液pH=7.4,[HCO3-]=24mmol/L)。而随着精子在生殖道管腔中的运输,管腔中的液体环境,包括[HCO3-]和pH值均发生很大的变化。从生精小管开始,经过输出小管、附睾头、附睾体、附睾尾,直至输精管,[HCO3-]和pH值有一个逐渐变化的过程。
其他研究人员在牛中也观察到了类似的结果,牛的睾丸液中[HCO3-]约为30mmol/L。进入附睾之前的液体pH为7.2,而储存精子的附睾尾pH为6.5,相应地,HCO3-为3~4mmol/L。
这些研究表明,雄性生殖道上皮细胞有一套酸碱离子跨膜运输机制,以维持雄性生殖道中较低的[HCO3-]以及酸性pH值。
雄性大鼠生殖道不同部位及血浆的离子浓度、pH及渗透压比较
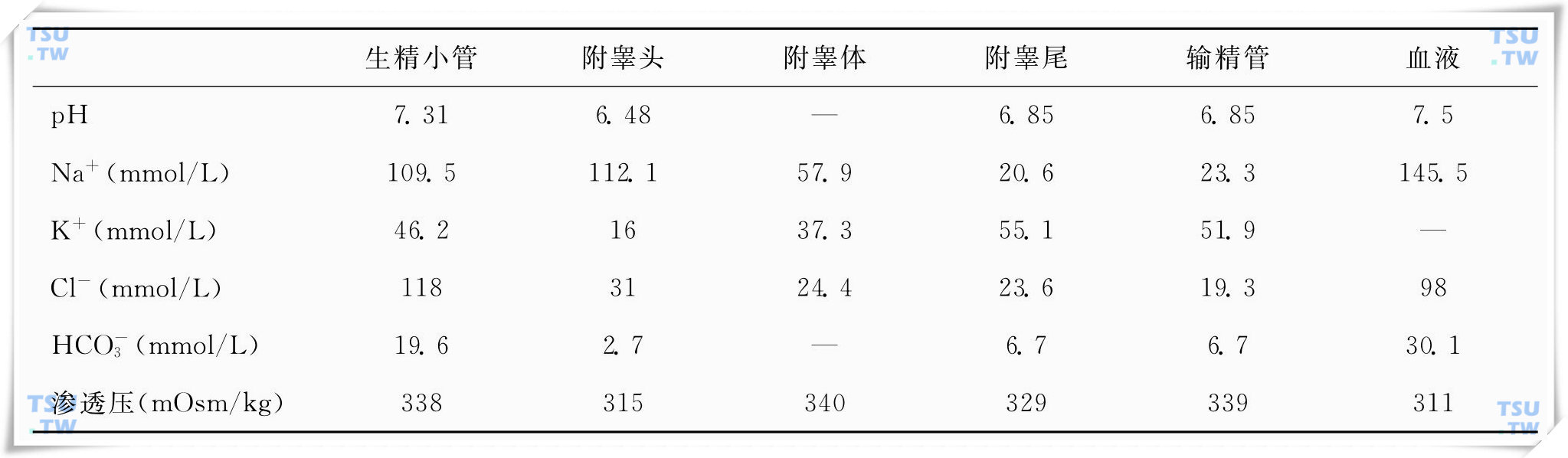
(数据引自Levine &Marsh,1971)。
雄性生殖道具有跨上皮细胞运输各种离子的功能,以吸收或者分泌各种离子,从而维持生殖道腔液体环境合适的离子环境。从胚胎发生学上来说,雄性生殖道与肾小管是同源的,两者都来源于间介中胚层。这两者在离子跨膜运输机制上具有很多相似之处,因此可以将雄性生殖道和肾小管进行比较。
肾脏是机体极为重要的过滤与重吸收器官。人体的肾脏每分钟过滤的体积约为125ml,相当于每天要把人体的血液过滤几十次!在肾脏中,近端肾小管(proximal renal tubule)是HCO3-重吸收的主要部位。通过肾小球形成的滤出液中,80%以上的HCO3-在近端肾小管通过上皮细胞的重吸收作用被重新回收到血液中,因此肾脏对维持全身的酸碱平衡具有极其重要的作用。
雄性生殖道中也发生着类似的HCO3-重吸收过程。当然,相对于肾脏来说,雄性生殖道上皮细胞中离子重吸收过程的速率要慢得多。雄性生殖道HCO3-重吸收的主要部位在哪里呢?表19-1的数据显示,生精小管中碳酸氢根离子浓度[HCO3-]较血液中的要略低,这说明在雄性生殖道中,HCO3-的重吸收可能从生精小管即已经开始了。雄性生殖道中的液体经过精子输出小管到达附睾头时,[HCO3-]达到最低,这表明雄性生殖道的近端部分(proximal segment),即输出小管,应该是HCO3-重吸收的主要部位。伴随着HCO3-浓度的降低,雄性生殖道中液体的pH也相应地降低,其中附睾头的pH是最低的。在附睾尾以及输精管处,HCO3-浓度又有一定程度的上升,pH也相应的稍有上升。这提示附睾尾及输精管部位某些特定的上皮细胞可能具有一定的HCO3-分泌功能,当然这还需要进一步的研究。
雄性生殖道的上皮细胞有着一系列复杂的酸碱离子跨膜运输机制,以维持生殖道腔中合适的pH环境(详见第五节)。这些蛋白对于精子产生与成熟可能具有非常重要的作用,这些转运体的功能发生异常或者缺失,就有可能导致精子形成障碍。譬如,Slc4a2编码的AE2是一个阴离子交换蛋白,介导Cl-和HCO3-的跨膜交换作用。实验表明,与正常小鼠相比,Slc4a2基因敲除的小鼠,其睾丸显著变小,而且产生的精子细胞数量极大地下降,完全不能形成成熟的精子。由此可见,AE2对于睾丸的发育,以及对于精子的发生与成熟都具有极为重要的作用。
