上已述及,机体中存在许多种不同的具有缓冲能力的物质,体液或细胞的缓冲力是各种共轭酸碱对全部作用的集合。在诸多酸碱缓冲体系中,CO2/HCO3-体系在机体的pH调控中具有特别重要的作用。在溶液中,CO2与HCO3-之间存在以下化学平衡:
H2O+CO2←→H2CO3←→H++HCO3-
该平衡反应的第一步,即H2O与CO2结合形成H2CO3的反应是一个慢反应,是整个化学反应过程的限速步骤。该步骤在机体中受到碳酸酐酶(carbonic anhydrase)的催化。因为第一步CO2的水化作用是限速步骤,上面的方程可以简化为:
H2O+CO2←→H++HCO3-
反应平衡常数K为:
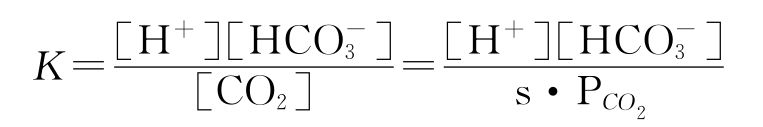
式中的[H+],[HCO3-],[CO2]分别表示溶液中氢离子,碳酸氢根离子和CO2的浓度,s表示CO2在溶液中的溶解系数,PCO2表示CO2的分压。对上面的方程两边取对数,并经过变换后得到:
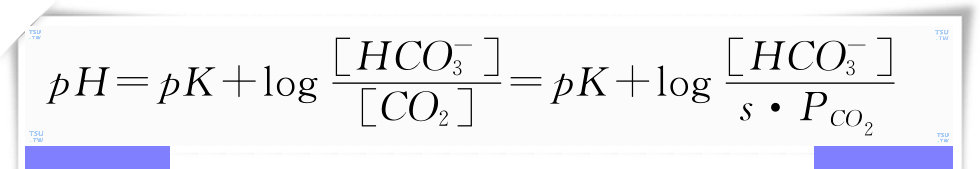
这就是Henderson-Hasselbach方程,该方程显示了溶液的pH与溶液中的CO2和HCO3-浓度之间的关系。根据这个方程可知,在溶液中,[HCO3-]和[CO2]浓度的比值决定了pH。以血液为例,在正常生理条件下,平衡常数pK等于6.1,血液中[HCO3-]约为24mmol/L,CO2的分压约为40mmHg,CO2在血液中的溶解系数约为0.03mmol/mmHg。将这些值代入上面的公式,可以计算出血液的pH约为7.40,这与生理条件下的实验观测值是很接近的,血液的pH一般在7.3~7.5之间。
机体内部的体液环境是一个开放体系,机体产生的CO2通过肺的呼吸作用不断地排出体外,而一般来说,大部分细胞膜对气体分子均具有很大的通透性,CO2分子可以通过自由扩散非常容易地进出细胞。在正常生理条件下,机体中体液及细胞内的CO2浓度(或者CO2分压)能够保持在恒定的水平。因此,根据Henderson-Hasselbach方程,正常生理条件下,机体及细胞中的pH与HCO3-浓度具有很大的相关性。如果其他条件保持不变,那么[HCO3-]每增加或降低一倍,pH会升高或降低0.3个单位。
因为机体是一个开放体系,可以通过呼吸作用不断地排出CO2,使体内的CO2水平恒定,所以CO2/HCO3-组成的缓冲体系具有非常强的缓冲能力。可以说,在机体中存在的各种酸碱缓冲体系中,CO2/HCO3-是最主要的一种。以血液为例,在没有CO2/HCO3-的条件下,血液的酸碱缓冲能力约为25mmol/ pH单位,而在有CO2/HCO3-存在的开放体系条件下,血液的酸碱缓冲能力约为65mmol/pH单位。所以,CO2/HCO3-缓冲体系所贡献的酸碱缓冲能力占血液总酸碱缓冲能力的60%以上。
