左卡尼汀,又称肉碱或维生素BT,化学名称为β-羟基-γ-三甲胺丁酸,相对分子质量为161.2。左卡尼汀广泛存在于自然界中,是一种高极性、小分子季胺类化合物,为人体必需营养素,有重要的生化功能和临床应用价值。左卡尼汀是线粒体膜上唯一的活化脂肪酸载体,主要功能是携带、转运活化的脂肪酸,特别是长链饱和和不饱和脂肪酸穿越线粒体膜,进入线粒体内进行β氧化和三羧酸循环反应,为机体的各种代谢活动提供能量。左卡尼汀还具有促进丙酮酸、支链氨基酸的氧化利用,清除胞质中乙酰辅酶A的积聚和不良反应,调节和维持线粒体基质中酰基辅酶A与辅酶A之间的比例,防止长链脂酰辅酶A对生物膜的损伤等生物功能。
人体左卡尼汀主要有两方面的来源,即饮食摄取和体内生物合成,其合成部位主要是肝、脑和肾。左卡尼汀分布于体内多种组织,以附睾中的肉碱浓度最高。附睾中肉碱以游离态和乙酰化形式存在。目前认为左卡尼汀与精子在附睾中成熟有关。附睾本身无合成左卡尼汀的功能,摄取的左卡尼汀来自血浆,但附睾中左卡尼汀的浓度却远远高于血浆。当精液中左卡尼汀缺乏时,精子线粒体内正常的β氧化过程缓慢,为精子提供的能量降低,可导致精子存活力和运动能力明显降低,进而可导致男性不育。对因左卡尼汀缺乏的患者及时给予左卡尼汀已成为目前治疗男性不育的新疗法之一。然而,目前临床上并没有有效、简便的常规精浆左卡尼汀的检测方法,因此,给予左卡尼汀只是一种经验性的治疗。鉴于此,现将左卡尼汀检测的几种方法简介如下,并具体介绍酶测定法和高效液相色谱法,以供参考。
方法学评价
左卡尼汀的测定方法主要有生物法、化学法、酶法、放射性同位素酶法、高效液相色谱法、电化学法、质谱法和核磁共振法等。生物法为传统的左卡尼汀检测方法,首次提出于20世纪50年代,其选择以左卡尼汀为必需生长因子的大黄粉虫幼虫作为喂养对象,以观察生物体吸收和利用左卡尼汀情况。由于该法特异性、灵敏度和准确性都很差,目前已弃用。
化学法的基本原理为,左卡尼汀在酸性条件下与乙醇反应生成酯,酯在弱碱性条件下与溴酚蓝生成有色物质,其颜色的深浅与左卡尼汀的浓度呈正比。由于该法不能区分测定L-型和D-型,而且,样本中凡含季胺基团或羟基基团物质对测定结果均会产生干扰,如果要排除这些物质干扰,测定前样本需进行繁杂的预处理,因此,该法一般仅适用于组分简单、含左卡尼汀浓度高的样本测定,而不太适合精浆样本左卡尼汀的测定。
酶法是最常用的左卡尼汀测定方法,基本原理为:左卡尼汀和乙酰辅酶A在肉碱酰基转移酶(CAT)作用下反应,生成乙酰左卡尼汀和辅酶A。生成的辅酶A分子中含有一个活泼的-SH基,利用该基团能与许多化合物反应,可以建立不同的酶测定法,如埃尔曼试剂法(DTNB法)、改良酮戊二酸脱氢酶法、酶荧光测定法以及放射性同位素酶化学法等。
DTNB法:选用5,5′-二硫代双-2-硝基苯甲酸(DTNB)作为显色剂,基本原理为DTNB与辅酶A反应,生成黄色的5-巯基-2-硝基苯甲酸阴离子(TNB-),其在412nm波长下具有强的光吸收,且吸收强度与辅酶中-SH的含量在一定范围内符合朗伯-比尔定律,测定光吸收强度即可测出辅酶A生成量,而辅酶A与左卡尼汀之间为等摩尔反应关系,因此可间接测出左卡尼汀含量。该法的优点是在CAT酶的作用下,左卡尼汀与乙酰辅酶A反应的特异性较好,排除了D-型的干扰,也消除了化学法中含季胺基团或羟基基团物质的影响,灵敏度较高,检测限约为5nmol/ml。不足之处是加入显色剂DTNB后会缓慢抑制CAT活性,使第一步生成辅酶A的反应速度下降。此外,DTNB还可与样本中其他还原性物质发生反应,使光吸收值逐渐增大而产生偏差,影响测定的准确度,不过,如果样本预处理时加入氧化剂可以消除内源性还原性物质的干扰。由于在410nm波长下DTNB试剂有空白吸收,对测定会产生干扰,故建议检测波长选用420nm。
改良酮戊二酸脱氢酶测定法:即使生成的辅酶A在酮戊二酸脱氢酶作用下与NAD-和2-酮戊二酸反应,生成琥珀酰辅酶A和NADH。NADH在340nm处具有强吸收,以紫外分光光度计测定340nm处的光吸收强度就可间接测出左卡尼汀的含量。由于酮戊二酸脱氢酶能专一性作用于该反应过程,因此该法不受样本中胆碱、氨基乙酸等杂质的影响,同时也避免了样本中带巯基共存物质的干扰。
酶荧光测定法:即选用具有荧光特性的衍生试剂与左卡尼汀第一步酶促反应生成的辅酶A进行衍生化反应,生成具有强荧光特性的衍生化合物,再通过测定产物的荧光强度间接测出左卡尼汀含量。该法的特点是灵敏度高,重复性和回收率较好。不足之处是测定结果易受样本中内源性荧光物质的影响,因此对每份样本都应设置空白对照。但由于受衍生化反应的荧光试剂种类和荧光检测仪器的限制,该法很难在临床常规检测中使用。
放射性同位素酶化学法:该法首先将乙酰辅酶A的乙酰基用14C放射性同位素标记,再使其在CAT作用下与左卡尼汀反应,生成带14C标记的乙酰左卡尼汀,将乙酰左卡尼汀从乙酰辅酶A中分离出来,便可测得左卡尼汀的含量。本法灵敏度较高,但其检测步骤烦琐,测定精密度较差,而且存在放射性同位素污染环境和操作者易受损伤问题。
另外,作为酶法,酶反应的完全与否以及反应程度的一致性,将直接影响左卡尼汀测定的准确性和重复性。因此,酶法测定左卡尼汀必须满足两个条件:足够量的乙酰辅酶A参与反应,反应中CAT和衍生试剂量必须恒定。而且,试验中各批次的酶试剂活性也应保持一致。然而,由于酶法所需试剂大多比较昂贵,操作步骤较繁杂,耗时较长,目前临床上精浆左卡尼汀的检测仍限于科研用。能否建立一种简便、适合各种规模医院男科实验室使用的精浆左卡尼汀检测方法,酶法仍是考虑的重点,操作过程仍需进一步优化和精简。
高效液相色谱法测定左卡尼汀是在20世纪80年代后发展起来的。该法以分离高效、检测灵敏、操作简便、结果准确为特点。根据样本处理方法的不同,该法可分为直接测定法和柱前衍生测定法。直接法是基于对样本中左卡尼汀的高效柱分离和左卡尼汀在短波长有紫外吸收的特征,直接以紫外分光检测器定量检测,但由于左卡尼汀属强极性化合物,色谱保留的时间短,难以与样本中共存物色谱杂峰及溶剂峰良好分离,加之左卡尼汀仅在短波长范围有弱紫外吸收,检测灵敏度较低。因此,本法常限于高含量左卡尼汀或组分简单的样本分析。柱前衍生法选用具有强紫外吸收或荧光特性的衍生剂,与左卡尼汀柱前反应生成酯类化合物,既改变了左卡尼汀与色谱固定相间的吸附特性,又提高了光学检测灵敏度。根据选用衍生剂的不同,衍生化高效液相色谱测定法又分为柱前紫外衍生高效液相色谱测定法和柱前荧光衍生高效液相色谱测定法,以前者较为常用,后者需要荧光检测器,限制了其使用。
质谱法不仅能测定游离左卡尼汀,也能测定结合左卡尼汀,并能将结合左卡尼汀按各种脂肪酸结合左卡尼汀一一对应测定,是当前左卡尼汀测定的参考方法,但严格的测定要求和昂贵的仪器设备,使其很难用于临床常规检测。
埃尔曼试剂法
埃尔曼试剂法即DTNB法。原理见“方法学评价”一节。
一、所用试剂
- 0.1mol/L Tris-HCl缓冲液(pH7.5);
- 氯仿、异丁醇混合液:按氯仿∶异丁醇=2∶1配制;
- DTNB溶液:用Tris-HCl缓冲液配制成2mg/ml浓度;
- 乙酰辅酶A溶液:用Tris-HCl缓冲液配制成8mg/ml浓度,临用前新鲜配制;
- ACT(肉碱酰基转移酶)溶液:用Tris-HCl缓冲液将酶原液(80μmol/mg蛋白特异活性)稀释30倍,临用前新鲜配制;
- 左卡尼汀标准液:取一定量的左卡尼汀用Tris-HCl缓冲液配制成8mmol/L浓度,临用前稀释80倍使成0.1mmol/L浓度的应用液。
二、操作步骤
基本操作步骤为:①取精浆0.15ml加95%乙醇0.75ml,混匀,于室温放置2h后,3000r/min离心20min,取上清液在40℃以下减压蒸发至干燥。②干燥物溶于3ml蒸馏水中,加4ml氯仿、异丁醇混合液,混匀,5min后3000r/min离心20min。取上层水液2ml于试管中,在40℃以下减压蒸发至干燥,备用。③取数支试管,B为空白管,U为上述制备的样本管,S为标准管,按下表进行操作。
左卡尼汀含量测定步骤
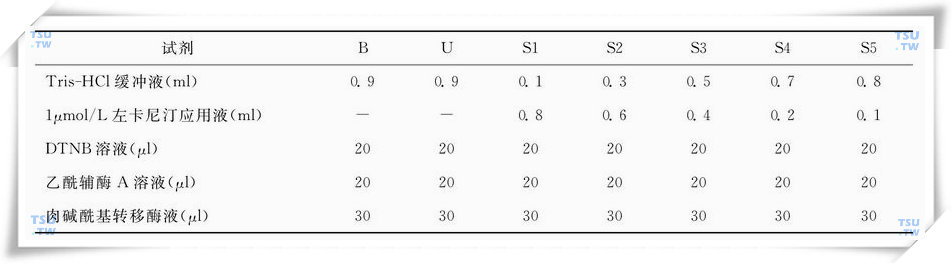
加完试剂后,混匀,置水浴35℃温育30min后,于412nm波长读取吸光度值。先绘制标准曲线:以左卡尼汀含量100、200、400、600、800μmol/L为标准点和所测吸光度值绘制标准曲线。根据标准曲线求出精浆左卡尼汀的含量。
四、正常参考值
正常生育男性精浆左卡尼汀含量为269.93~653.19μmol/L。
高效液相色谱法
这里介绍的方法属柱前紫外衍生高效液相色谱测定法。原理见“方法学评价”一节。
一、所用试剂
包括:①左卡尼汀标准贮备液(10mmol/L):精密称取16.1mg左卡尼汀标准品,置于10ml容量瓶内,加蒸馏水适量,摇匀后加蒸馏水至刻度,-5℃保存备用;②左卡尼汀工作液:用7.5%的BSA水溶液将左卡尼汀贮备液依次稀释至12.5、50、100、200、500μmol/L,4℃冷藏待用;③衍生化试剂:称取10mg对-溴苯甲酰甲基溴化物(p-BPB),加500μl乙睛及40μl四丁胺(TBA),摇匀后4℃冷藏待用。
二、操作步骤
基本操作步骤为:①标本的处理:精液样本液化后,以6000r/min离心10min,吸取100μl上层精浆置另一试管中,加1ml乙睛,于漩涡振荡器上振摇10min,混匀后,6000r/min离心5min,将有机相吸出后置-5℃保存待测。②测定时,吸取10μl精浆样本或左卡尼汀工作液,加100μl乙睛,于漩涡振荡器上振荡1min,8000r/min离心5min后,吸取80μl上清液置另一试管中,加入40μl衍生化试剂,摇匀。70℃温育1.5h后,取10μl上清液进样分析。③色谱分析:色谱柱为Kromasil Sil柱(150mm× 4.6mm,5μm,瑞典Eka公司);流动相由20%A和80%B组成,其中A为1.6μmol/L柠檬酸和4μmol/L三乙胺的水溶液(pH 6.4),B为含10%异丙醇的甲醇溶液,用前均经0.45μm滤膜过滤。检测波长:260nm;流速:0.7ml/min;进样量:10μl。所有色谱数据均按峰面积由Agilent提供的软件“化学工作站”(Chemstations,Version A.09.01)自动进行定量计算。
HPLC法具有高灵敏度、高特异性等优点,因而被认为是测定左卡尼汀的“金标准”。
四、正常参考值
正常生育男性精浆左卡尼汀含量为308.1~903.8μmol/L。
