病例与思考
患者,女,55岁,宫颈癌放疗后2年,以腹胀、腹痛、停止排气半月余于2014年4月8日入肿瘤科住院。入院时体重55kg,身高158cm,BMI:22.03,入院前1月体重下降10kg,入院前一周食欲下降,每天进食少许稀饭(未进食肉类、牛奶以及蔬菜水果),总量约50g,NRS2002评分:4分。入院时临床检验:TP 56.5g/L,ALB 30.7g/L,PA 119mg/L,K 4.38mmol/L,Na 140.7mmol/L,HB 85g/L。医嘱禁食水,给予肠外营养(PICC置管),安置胃管减压,每天灌肠。肠外营养中每日左卡尼丁注射液15ml(相当于左卡尼丁3g/d)。持续胃肠减压,4月9— 16日每日减压出黄绿色液体约100~500ml不等,4月17日以后减压的液体逐渐减少到100~50ml;4 月26停止灌肠后,每2~3日一次大便,质软。4月29日—5月15日,食欲差,自己进食白粥约50g/日,进食后无恶心、呕吐、腹胀。同时肠内给予复合全营素200ml/d,膳食纤维15g/d。期间间断肠外营养,给予热量870kcal,均添加左卡尼丁3g/d。5月15日肠镜后腹痛,暂停肠内营养并禁食。5月23日碘油造影显示:小肠低位梗阻。(从4月9日—5月23日的肠外营养中均加入左卡尼丁3g/d)。5 月23日转入胃肠外科,CT显示肠梗阻加重,于5 月28日在胃肠外科行手术解除肠梗,并行回肠造瘘术。术后情况良好,禁食水,每日给予肠外营养支持2000kcal,但未给予左卡尼丁。6月18日转回肿瘤科治疗。患者一般情况良好,每日进食稀粥约100g,鸡蛋1个,肠内营养液300ml(能量300kcal);间断给予肠外营养补充,此时肠外营养中未添加左卡尼丁。进食量逐渐增加至常规食量,7月14日停用肠内营养,患者一般状况好,出院。出院时体重较入院仅有轻微下降。
- 该病例中第一阶段的肠外营养中添加左卡尼丁(即L-肉碱)是否有科学依据?其用法用量是否合理?
- 该病例在手术解除肠梗阻术后的肠外营养中,未添加左卡尼丁是否合理?
- 该病例给予了44天的左卡尼丁3g/d干预,是否有助于对患者的康复?应该增加哪些检查或检验项目以观察左卡尼丁使用对肿瘤患者的疗效?
肉碱又称左旋肉碱(L-carnitine,L-肉碱),或音译左卡尼丁,是一种具有生物活性的低分子量氨基酸,为人体所有组织正常功能所必需。肉碱(本文的肉碱均指L-肉碱)在人体中主要存在于骨骼肌,在体内主要参与长链脂肪酸的β氧化,它作为一种载体将长链脂肪酸转运进入线粒体,从而使长链脂肪酸得以进一步氧化供能。
人体内的肉碱一部分来源于食物,在人体肝脏及肾脏也可内源性合成。正常情况下人体不会缺乏肉碱,但在疾病状态下,肉碱可能因为消耗增加、合成减少或排出增多,表现为缺乏状态。多种疾病伴有肉碱的缺乏,如晚期肾病、充血性心力衰竭、获得性免疫缺陷综合征、恶性肿瘤等。研究发现,肉碱缺乏可能与这些疾病状态下的肌肉减少密切相关,尤其是肉碱与肿瘤恶液质的关系近来备受关注。
肉碱在机体的代谢
肉碱与长链脂肪酸代谢
L-肉碱的化学名称为L-β-羟-γ-三甲氨基丁酸,分子式C7H15NO3(图14-8-1)。L-肉碱主要参与体内脂肪酸的β-氧化。β-氧化是脂肪酸分解的核心过程,最终使脂肪氧化分解产生大量ATP供能,该β-氧化过程发生在线粒体内。在O2供应充足时,脂肪酸彻底氧化经过4个阶段:①脂肪酸活化;②转移至线粒体;③β-氧化生成乙酰辅酶A (Coenzyme A,CoA);④乙酰辅酶A进入柠檬酸循环并彻底氧化,释放大量ATP。其中,脂肪酸活化为脂酰CoA后,必需进入线粒体才能进一步氧化,而长链脂酰CoA必须在肉碱的帮助下才能透过线粒体内膜。具体过程是:线粒体外膜的肉碱脂酰转移酶Ⅰ(carnitinepalmityltransferaseⅠ,CPTⅠ)催化长链脂酰CoA与肉碱合成脂酰肉碱,后者在线粒体内膜的肉碱-脂酰肉碱转位酶(carnitineacylcarnitine translocase,CT)的作用下,透过内膜进入线粒体内,脂酰肉碱在线粒体内被CPTⅡ分解为脂酰CoA和肉碱,后者由CT转运出线粒体(图14-8-2)。由此看出,肉碱是脂酰CoA从线粒体外转运到线粒体内的载体。因而,肉碱在长链脂肪酸氧化,并最终产生ATP的过程中是重要的一环。当人体内肉碱缺乏时,长链脂肪酸氧化缺陷,细胞能量产生不足,以及一些中间代谢紊乱而引起一系列临床表现。
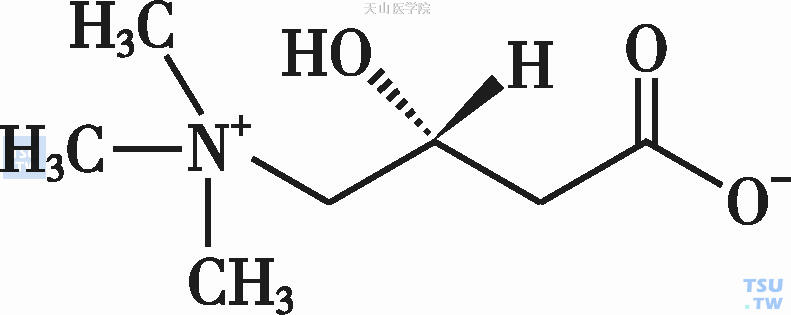
图14-8-1 L-肉碱结构图
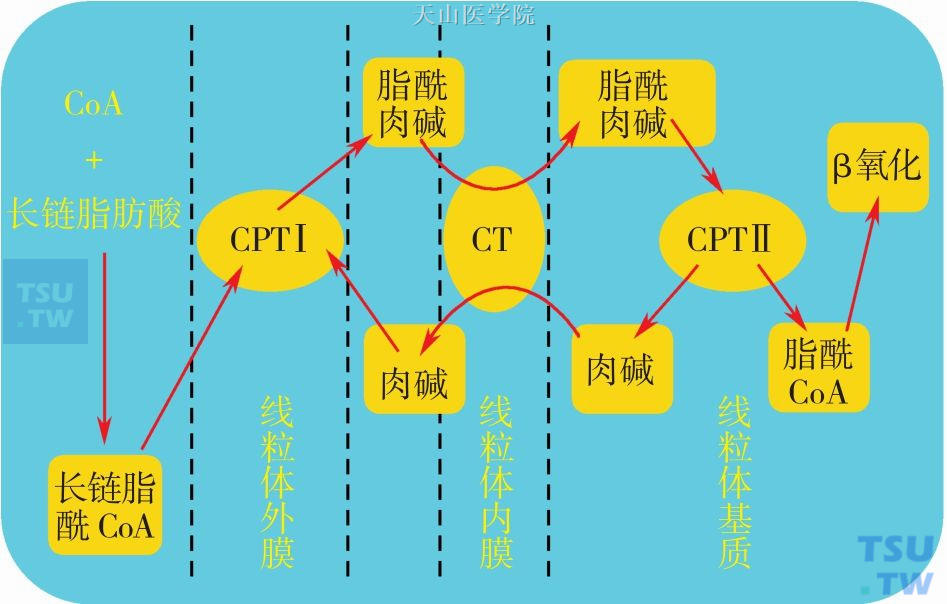
图14-8-2 肉碱协助长链脂肪酸进入线粒体
肉碱的生物合成与降解
L-肉碱在体内由必需氨基酸L-赖氨酸和L-甲硫氨酸衍生而成,其直接的前体物质是ε-N-三甲基赖氨酸。后者主要来自体内肌肉蛋白质的降解。正常情况下,体内蛋白质的常规合成与降解过程产生的ε-N-三甲基赖氨酸能够满足人体对肉碱合成的需要。该合成过程还需要其他营养素,如Fe2+、维生素C、维生素B6以及协同底物α-酮戊二酸、NAD+和O2的参与。在摄食减少情况下,一方面来自食物的肉碱减少,同时伴随的上述辅助营养素的减少也不利于肉碱的体内合成。因而,进食减少的肿瘤恶液质患者很容易发生肉碱缺乏。肉碱体内的主要合成部位是肝脏和肾脏。全身肉碱总循环的更新期为66天,肌肉中肉碱的更新时间为191小时,因而,推测要增加肌肉中含量最好肉碱干预一周以上。
肉碱在体内的降解主要是通过胃肠道内的细菌酶,该酶将肉碱经厌氧途径分解为γ-丁基甜菜碱。
肉碱的体内分布及转运
人体中肉碱的92%~97%存在于骨骼肌中,其他非肌肉组织,如肝肾中有2%~6%,其余0.7%~1.5%存在于血液及细胞外液。血浆中肉碱浓度为25~50µmol/L,而骨骼肌中浓度约为4000µmol/L,骨骼肌从血浆中逆浓度梯度摄取肉碱。尽管血浆肉碱水平不能完全反映组织中的肉碱水平,但是血浆肉碱<20µmol/L或低于正常水平的10%~20%均被认为是缺乏。正常人可通过饮食摄入和体内肝肾合成获得肉碱,体内的肉碱通过肾脏排泄,维持体内肉碱平衡。正常人每天通过食物摄入肉碱量为100~1000µmol,体内肝肾合成量为100~200µmol,肉碱每天由肾脏排泄100~400µmol,这样达到体内肉碱代谢平衡。外源性的摄入肉碱并不影响肉碱的内源性合成。
肉碱及其短链酰基酯衍生物如乙酰肉碱和丙酰肉碱,主要通过有机阳离子转运体(organic cation transporter,OCTN)转运。OCTN包括OCTN1、OCTN2、OCTN3。对肉碱的转运以OCTN2为主,OCTN1和OCTN3也可转运部分肉碱。该转运过程依赖于钠离子内流,且钠离子与肉碱协同转运。食物中的肉碱在肠道被吸收入血也是通过钠离子依赖的肉碱转运。OCTN2对肉碱的转运是其逆浓度梯度进入组织,包括肌肉组织的主要机制。OCTN2基因编码缺陷会出现机体肉碱缺乏,表现为肌无力等。
肉碱与乙酰肉碱在代谢中的关系
组织和细胞外液的肉碱中,10%~20%为酯化肉碱,80%~90%为非酯化肉碱。酯化肉碱主要为L-乙酰肉碱,少量为L-丙酰肉碱。肉碱上的一个羟基,与有机酸或脂肪酸结合后,形成不同的短链、中链和长链的酯,即乙酰肉碱。乙酰肉碱和游离肉碱(free carnitine,FC)是人体血液中肉碱的主要存在形式。乙酰肉碱和游离肉碱称为总肉碱(total carnitine,TC)。检测血浆中肉碱水平时,通常需要检测游离肉碱(FC)和总肉碱(TC)。酰基在肉碱和辅酶A之间的转化是脂肪酸进入线粒体代谢的中心环节,CPTⅠ催化酰基从CoA转移到肉碱(成为乙酰肉碱),CPTⅡ催化酰基从乙酰肉碱又回到辅酶A(形成CoA),肉碱实际是将酰基从胞外转移到胞内,这个过程中,长链脂肪酸是与酰基结合在一起的。因而,肉碱转移酰基的过程实际是将长链脂肪酸从线粒体外转运到了线粒体内,是一个载体。乙酰肉碱与游离肉碱的比例高于或等于0.4,表明乙酰肉碱的高负载导致了游离肉碱的缺乏。肉碱同时是细胞及线粒体外乙酰肉碱的重要来源。肉碱可调节CoA池,主要是通过调节丙酮酸脱氢酶复合物。肉碱的缺乏不仅影响长链脂肪酸的代谢,还影响葡萄糖的利用及胰岛素敏感性。
肉碱的排泄及重吸收
肉碱主要通过肾脏排泄。同时肾脏可以重吸收68%~90%的肉碱。肾脏对肉碱的重吸收是调节人体肉碱总稳态的主要机制。肾脏刷状缘黏膜上的有机阳离子转运体OCTN2主要负责肉碱及其短链乙酰肉碱的重吸收。口服或静脉注射肉碱,可使肉碱重吸收减少。慢性肾脏病(chronic kidney disease,CKD)患者或透析患者的肾脏重吸收功能障碍,肉碱重吸收减少,引起肉碱的缺乏,同时肾脏合成肉碱减少,可能是CKD患者或透析患者肌肉减少的重要原因。
由于肾脏对肉碱的重吸收能力很强,因而即使严格素食者的血浆肉碱也不至于很低。
肉碱的食物来源及吸收
肉碱可以从食物中获得,红色肉类及奶制品是肉碱的主要来源。一般人每天能从膳食中摄入50mg,素食者摄入更少。素食的成人及儿童血浆肉碱水平通常比混合膳食的对应人群低10%和 25%。膳食肉碱的吸收率通常在55%~90%之间,而膳食补充剂中的肉碱(0.5~4g/d)的吸收率低一些,约为15%~25%。目前暂时没有肉碱的膳食参考摄入量(DRI)标准。晚期肿瘤患者因食欲严重下降,动物性食物摄入少,进一步引起体内L-肉碱的缺乏。
肉碱与恶液质
恶液质患者体内肉碱水平下降
恶液质时机体多种营养素代谢异常,其中包括肉碱在体内的分布及代谢异常,以机体肉碱缺乏为主要表现。在多种慢性疾病,包括慢性肾脏疾病、透析、获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS)、肿瘤恶液质等患者中,食物摄入减少引起的肉碱摄入减少,以及伴有的其他营养素包括维生素C、维生素B6、Fe2+摄入的减少引起的体内肉碱合成减少,是血浆肉碱水平下降的一个重要原因。肉碱内源性合成机制受损引起肉碱水平的进一步下降,而体内肉碱下降可能与肿瘤患者的恶液质进展有关。
Vinci等比较了肿瘤恶液质患者、非恶性肿瘤患者以及健康人的血肉碱水平,发现与健康人相比,恶液质患者的游离肉碱下降8.20µmol/L,短链酰基肉碱下降2.60µmol/L,长链酰基肉碱下降0.40µmol/L,总肉碱下降11.20µmol/L。认为血浆肉碱水平下降与恶液质患者的肉碱合成代谢受损有关。
Malaguarnera等发现,胃肠道肿瘤恶液质患者的血清肉碱水平下降。他们分别在恶性消化道肿瘤、恶性非消化道肿瘤、非恶性肿瘤以及健康人中比较血清游离肉碱、长链乙酰肉碱、短链乙酰肉碱和总肉碱水平,发现消化道恶性肿瘤患者各指标水平最低,其次为恶性非消化道肿瘤和其他非恶性肿瘤,健康人的游离肉碱及总肉碱均最高。与健康人相比,消化道恶性肿瘤患者的游离肉碱水平降低15.5µmol/L,短链酰基肉碱水平降低5.2µmol/L,长链酰基肉碱降低1.0µmol/L,而总肉碱水平降低21.7µmol/L。
肿瘤患者尤其是恶液质患者体内肉碱水平下降还可能是肿瘤治疗的不良反应。研究发现,部分化疗药物,如顺铂作用小鼠48小时后,小鼠尿中肉碱排泄增加,其机制可能通过下调肾脏的肉碱转运体OCTN2,减少肾脏对肉碱的重吸收,促进肉碱在尿中的排泄,从而降低机体肉碱水平。而对缺乏顺铂转运蛋白基因Oct1和Oct2的基因敲除小鼠,顺铂干预不增加尿中肉碱的排泄。
肿瘤恶液质时,骨骼肌的肉碱水平下降意味着长链脂肪酸在线粒体的β-氧化不能有效进行。Szefel等对55例肿瘤恶液质患者的研究中发现,所有患者的尿液中肉碱的排泄均高于正常值。在不同BMI患者中,BMI<19kg/m2的患者血浆游离肉碱、总肉碱和骨骼肌游离肉碱、总肉碱水平均低于BMI>19kg/m2者。分别给予患者长链脂肪酸(LCTs),或者中/长链脂肪酸(MCTs/LCTs)后,发现MCTs/ LCTs干预使血浆游离肉碱(FC)及总肉碱(TC)降低,而LCTs干预患者的血浆FC及TC水平下降不如MCTs/LCTs者,同时两组患者尿中肉碱排泄没有明显改变,表明在恶液质患者中,对LCTs的代谢能力不如MCTs/LCTs。MCTs/LCTs相比LCTs,对肉碱从骨骼肌释放到血浆及尿排泄减少。提示在恶液质患者的脂肪酸供应中,要考虑到MCTs的供应。
肉碱在恶液质肌肉减少中的作用及可能机制
多种病理状况均存在骨骼肌丢失(muscle wasting),包括慢性心衰(chronic heart failure,CHF)、CKD,慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD),AIDS等。近年来的研究表明,在一系列病理性的骨骼肌丢失中,都有肉碱代谢障碍。我们尤其关注肿瘤恶液质状态下肉碱的功能。
由于肉碱在恶液质患者的骨骼肌、血浆中含量的下降,推测肉碱补充有助于改善恶液质症状,尤其是恶液质患者的肌肉减少。在肿瘤恶液质患者的肌肉组织的丢失也展现了同样的代谢过程。由于骨骼机体积及其完整性对于机体整体代谢及健康尤为重要,因而进行性的肌肉组织下降会引起系列反应,包括影响机体对治疗的耐受、疾病预后,甚至与高死亡率相关。目前认为,肉碱可能在肿瘤中成为一个适宜的抑制肌肉减少的药物。
病理状态下的骨骼肌丢失有多种机制参与,包括:①肌肉蛋白降解增加;②肌肉蛋白合成受损;③肌细胞凋亡;④炎症反应;⑤氧化应激增加;⑥线粒体功能受损。而肉碱可能从上述多个方面预防骨骼肌丢失,从而有助于改善恶液质。目前关于肉碱削弱肌肉减少的动物及临床试验多集中于HIV、血液透析患者等,而对于肉碱干预恶液质患者肌肉减少的动物实验及临床试验并不多。
1. 肉碱抑制肿瘤患者的蛋白降解
病理性的肌肉减少主要表现为机体蛋白质代谢紊乱,体现为蛋白质分解代谢增加,合成代谢受损。研究表明,肿瘤恶液质的肌肉减少主要是肌肉蛋白质的降解,而蛋白质的泛素化降解是机体蛋白质降解的主要方式(其他方式包括自噬等)。具体是蛋白质被泛素化酶进行泛素化以后,进一步被蛋白酶体(Proteasome)降解。人群研究显示,蛋白酶体的抑制剂bortezomib可能有效治疗肿瘤引起的体重下降。因而,泛素化酶的作用以及蛋白酶体的作用尤为重要。
atrogin-1、MuRF1是参与恶液质患者肌肉蛋白降解的主要泛素化酶。Busquets等发现,肉碱干预可以抑制荷瘤大鼠的蛋白质降解。1g/(kg•d)的肉碱干预荷瘤大鼠6天,可增加大鼠摄食,下调泛素化酶atrogin-1、MuRF1的mRNA水平以及泛素化酶的其他组分,并下调蛋白酶体活性,抑制离体腓肠肌细胞的蛋白分解,增加肌肉总量,并提高肌肉物理表现。
2. 肉碱促进肿瘤患者的蛋白质合成
病理性肌肉减少时,机体蛋白质合成亦受到影响。研究发现,与蛋白质合成代谢相关的激素,如胰岛素生长因子1(Insulin-like growth factor-1,IGF-1)、睾酮等的相对缺乏,以及组织对蛋白合成激素的敏感性下降(如胰岛素抵抗),也可能是病理状况下肌肉减少的原因之一。恶液质时,多种因素影响机体骨骼肌蛋白质的合成。如肿瘤患者分泌的肿瘤相关因子-蛋白水解诱导因子(proteolysis inducing factor,PIF)降低蛋白合成,它通过磷酸化蛋白翻译的起始因子-真核起始因子2(eIF2-alpha),而降低蛋白合成。同样,在CHF患者和CKD患者中,血管紧张素Ⅱ (Ang Ⅱ)升高,可能降低这两种疾病患者的蛋白合成,并刺激蛋白分解。
肉碱干预影响肌肉减少的临床证据不多。仅有的几项研究多是关于血液透析患者的,均在20世纪80年代及90年代开展。其中Giovenali的前瞻性研究将26例血透患者分为三组,肉碱口服组,肉碱加入透析液组,或透析后静脉注射组(剂量均为2g/d),干预24周后,发现肉碱干预使骨骼肌肌纤维直径增加。
最近的研究在地中海贫血患者的随机对照试验中发现,肉碱[50mg/(kg•d)]干预6个月,使患者血清IGF-1和生长因子(GH)水平增加,有助于患者肌肉蛋白质的合成。
3. 肉碱改善恶液质患者氧化应激及炎性反应
肿瘤恶液质时释放的细胞因子如IL-6、IL-8、 TNF-α、PIF等可抑制了下丘脑的脂肪酸氧化,从而抑制食物的摄入。细胞因子同时在骨骼肌细胞刺激了氧化基因的表达,从而促进了恶液质时氧化应激的发生。动物实验发现,富含抗氧化因子的食物或肉碱干预可促进荷瘤大鼠的食物摄入,改善其厌食症状,增加机体瘦体重,并同时伴随肿瘤相关细胞因子水平的下降。
研究发现,肉碱具有糖皮质激素类似的免疫抑制作用,可能抑制HIV患者的肿瘤坏死因子(TNF-α)的作用。它具有糖皮质激素的抗炎功能,但没有糖皮质激素的副作用。丙酰肉碱200mg/(kg•d)干预,可增加甲基胆蒽诱导肉瘤大鼠食物摄入,增加瘦体质,可能与其下调血液炎性介质水平有关,包括IL-1b、IL-6、TNF-α,提示肉碱可能通过削弱肿瘤相关炎性反应而改善恶液质。也有研究认为,抗氧化机制在肉碱拮抗肿瘤恶液质中作用不明显,Gramingnano等对12名进展期肿瘤患者,每天给予肉碱6g连续4周,发现肉碱可改善患者食欲、疲倦,并增加瘦体质;肉碱干预后活性氧ROS水平下降和谷胱甘肽过氧化物酶活性增加,但没有统计学意义。同时IL-1β、IL-6、TNF-α在干预后没有显著差别。
4. 肉碱改善线粒体功能
肉碱及短链乙酰肉碱能阻断线粒体内的活性氧,从而保护线粒体。随年龄增加,线粒体功能下降。动物实验显示,给老年大鼠补充L-乙酰肉碱,可以使老龄化相关的线粒体功能恢复到接近幼龄大鼠水平。Patel等在脊髓创伤动物模型中研究了乙酰胆碱对线粒体损伤的改善作用,结果发现给予300mg/(kg•d)干预一周,明显改善了急性损伤引起的线粒体功能损伤。肉碱改善线粒体功能可能与肉碱稳定线粒体膜有关,其机制可能在于维持了能量代谢相关酶,以及氧化磷酸化的线粒体关键酶的活性,这些酶包括PDHC、线粒体复合物Ⅰ、线粒体复合物Ⅱ等。肉碱对于线粒体功能损伤的保护也有抗氧化和抗炎的机制参与。Hota等认为,缺氧状况下乙酰肉碱通过ERK1/2-Nrf2调节的线粒体生物合成途径介导其神经保护效应。丙酰胆碱通过提高肝脏呼吸链活性,可调节高脂膳食诱导肥胖小鼠的肝脏脂代谢,从而有助于改善其代谢紊乱及心血管改变。
关于胆碱改善线粒体功能的临床试验很少,检索到的3项随机对照临床试验分别针对HIV,终末期肾病患者和透析患者。在61例HIV-1感染伴有皮下脂肪萎缩(lipoatrophy)的患者中,21例患者给予乙酰肉碱,20例给予安慰剂,20例不给予补充剂,各48周,比较三组13CO2呼出量反映的线粒体功能以及CD4+细胞的线粒体DNA含量,结果显示乙酰肉碱干预改善患者线粒体功能。但其他几项临床试验没有显示出肉碱干预对患者线粒体功能的改善。如Vaux等开展的随机对照临床试验中,在26例终末期肾病患者透析后给予肉碱20mg/kg机体干重或安慰剂每周3次,共干预16周。尽管肉碱干预使血浆肉碱水平增加,但通过MRI和近红外光谱检测患者肌肉能量代谢和功能的结果,并没有显示出肉碱干预的有效性。
5. 其他可能机制
肉碱在恶液质脂代谢中的作用:恶液质伴随蛋白质、脂肪以及碳水化合物的代谢异常。研究显示,肉碱可以诱导恶液质脂代谢异常的恢复,如肉碱可以恢复恶液质的肉碱棕榈酰转移酶活性的下降,改善恶液质患者的甘油三酯异常。
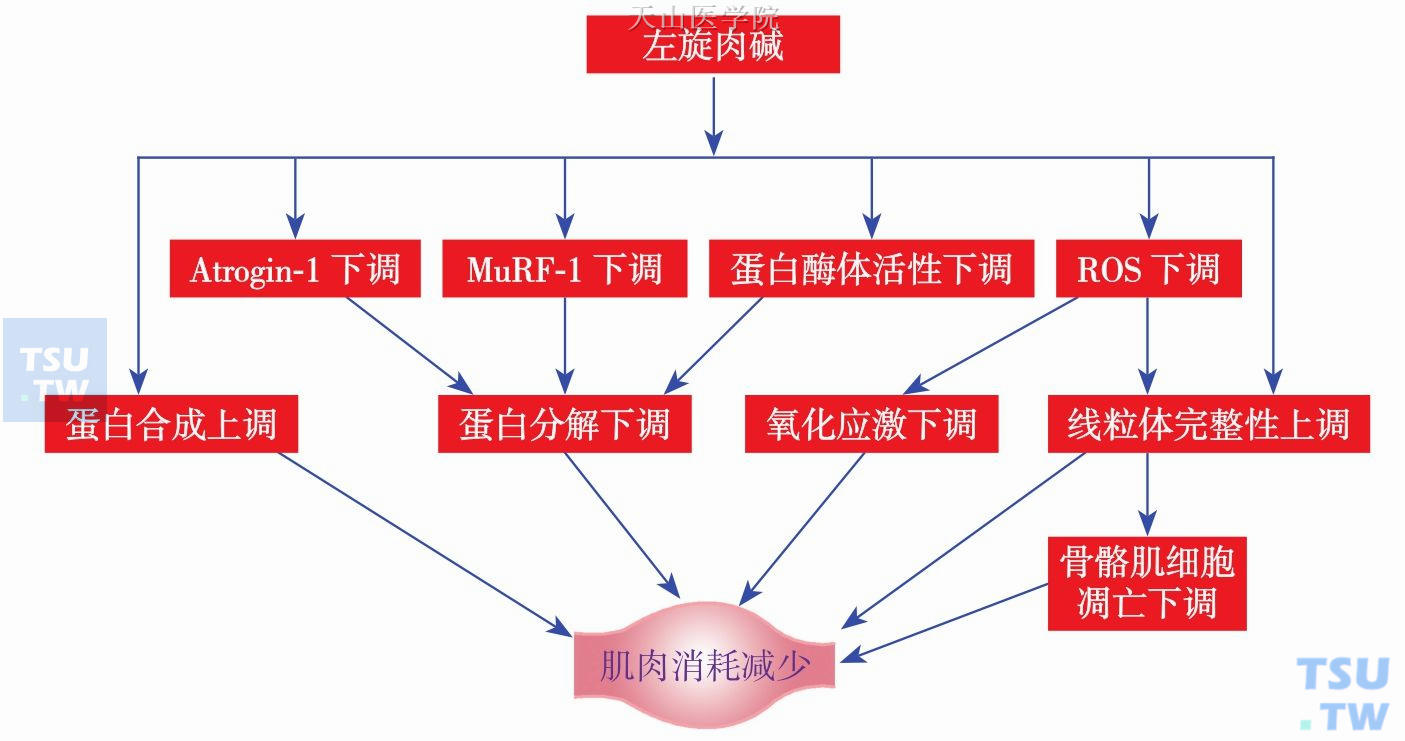
图14-8-3 肉碱在恶液质肌肉衰减中的作用及可能机制
有研究表明,病理性的肌肉减少中有骨骼肌细胞的凋亡(myonuclear apoptosis)的机制参与,其中ROS或炎性前反应诱导的骨骼肌细胞凋亡可能是病理状况下骨骼肌减少的机制之一。Busquets等发现消化道肿瘤恶液质患者有骨骼肌细胞的凋亡。肉碱干预[1g/(kg•d)]荷瘤大鼠,可抑制大鼠肌细胞凋亡。Vescovo等发现,肉碱干预(口服50mg/kg,BW/d,28天)可抑制野百合碱诱导大鼠心衰模型的骨骼肌细胞凋亡。
肉碱还可能改善恶液质患者的疲倦症状。Cruciani等的研究发现,肉碱替代可改善肿瘤患者的疲倦、睡眠和抑郁症状,但病例数只有27例。Gramingnano等发现肉碱可使正在进行抗癌治疗的晚期肿瘤患者的食欲改善、疲倦减轻,并增加瘦体质,但例数仅仅12例。
综上所述,尽管肉碱可能通过多种机制,包括促进蛋白质合成、抑制蛋白质降解、抗氧化剂抗炎效应、保护线粒体功能等抑制病理性的肌肉减少,包括恶液质状态下的肌肉减少,但临床试验研究并不充分。要探明肉碱干预是否可以预防肿瘤恶液质患者的肌肉减少,以及改善其疲倦等临床症状,有待于进一步开展较大样本前瞻性严格随机对照的临床试验。(许红霞)
