代谢异常是肿瘤及其恶液质的一个特征,代谢调节治疗由于副作用小、患者耐受性好,疗效明显,应该成为治疗恶液质的重要手段,可以预测,在不久的将来代谢调节将成为治疗肿瘤及其恶液质的一个重要靶点。
恶液质时外周骨骼肌水解,为肝脏合成蛋白质及肿瘤蛋白质提供原材料。补充外源性氨基酸可以为机体提供蛋白质合成原料,防止肌肉分解,为肌肉(蛋白质)代谢及糖异生提供底物,从而发挥肌肉蛋白质节约作用。亮氨酸的代谢产物羟甲基丁酸盐(β-hydroxy-β-methylbutyrate,HMB)可以通过修饰NF-κB的表达发挥预防恶液质的发生作用。可溶性肌肉生长抑制素诱饵受体(myostatin decoy receptor)ActRⅡB-Fc、抗分解/合成转移剂(anticatabolic/anabolic transforming agent) MT-102等蛋白质代谢调节药物的作用也在积极研究中。
脂肪消耗是恶液质患者的一个普遍现象。肉碱是长链脂肪酸进入线粒体进行氧化供能的必需物质,在脂肪代谢中发挥关键作用,并表现出强烈的抗氧化、抗炎症特性。白色脂肪组织在恶液质过程中会发生一系列形态与生理性改变,在副肿瘤综合征(paraneoplastic syndrome)及慢性炎症反应中发挥重要作用。肿瘤及其恶液质等多种疾病情况下血浆肉碱水平下降,补充左旋肉碱后1周内血浆肉碱水平恢复,但是直至治疗结束,骨骼肌细胞内肉碱水平仍然不能完全恢复正常。研究发现:补充肉碱可以改善恶液质患者的疲劳、肌肉无力及生活质量,其机制可能与抑制脂肪细胞因子有关,后者既是炎症反应的重要介质,也与氧化反应损伤密切相关。下丘脑肉碱棕榈酰转移酶与脂肪酸合成酶一起参与调节黑素皮质素系统,TNF-α、IL-1等抑制脂肪酸氧化,所以,左旋肉碱可以改善恶液质患者的神经系统症状,改善食欲。Silvério R等认为一般情况下,左旋肉碱2~6g/d是安全的,副作用为轻微的胃肠道症状,如恶心、呕吐。
肿瘤细胞糖代谢的一个特征是Warburg效应,即在氧供充分的条件下,肿瘤细胞仍然主要依靠糖酵解途径供能,同时产生大量乳酸。Foster R等将不同肿瘤细胞株在25mmol/L、0.5mmol/L、0mmol/L葡萄糖浓度条件下培养120小时,发现:0.5mmol/L葡萄糖时多数肿瘤细胞生长抑制;没有葡萄糖(0mmol/L)时,所有肿瘤细胞株细胞的生长均得到显著抑制,据此,减少葡萄糖供给成为荷瘤患者的重要治疗原则(图1-7-2)。
二氯乙酸盐(dichloroacetate,DCA)是一个分子量仅为150D的小分子化合物,可以轻易通过任何细胞膜。20世纪50年代意大利科学家如Cascio G最先对它进行研究,1969年Stacpoole PW第一次以英文文字综述介绍了DCA的作用。DCA早期是作为一种乳酸中毒治疗药物,其作用机制在于激活丙酮酸脱氢酶,使线粒体去极化,使肿瘤细胞线粒体膜电位恢复到正常细胞线粒体水平,刺激丙酮酸进入线粒体,经三羧酸循环供能,促进氧化磷酸化,抑制糖酵解(图1-7-3)。
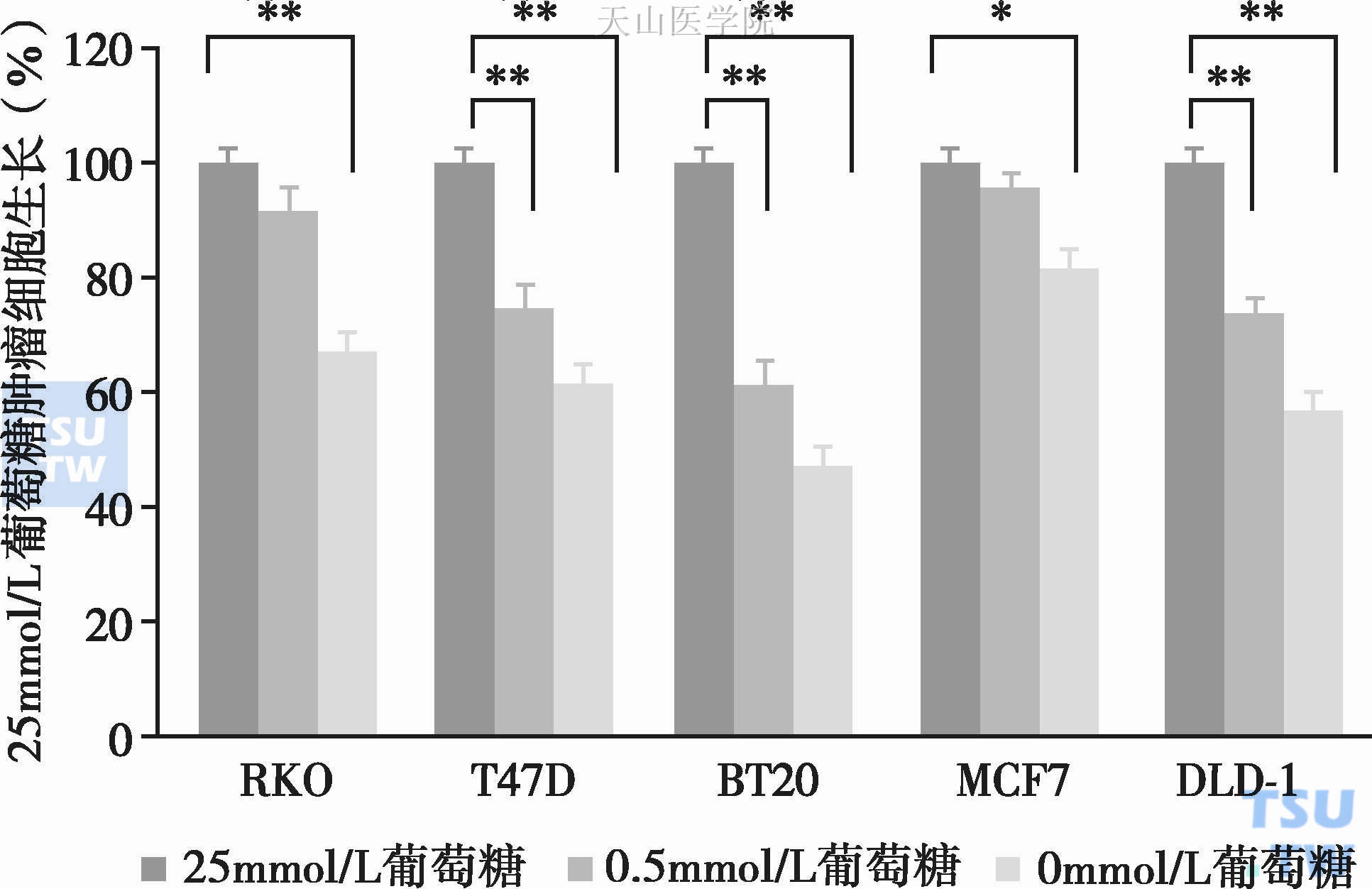
图1-7-2 不同肿瘤细胞株细胞在不同葡萄糖浓度条件下的生长情况
与25mmol/L葡萄糖生长情况相比,* P<0.05,** P<0.01本图说明,随着葡萄糖供给减少,肿瘤细胞的生长得到显著抑制
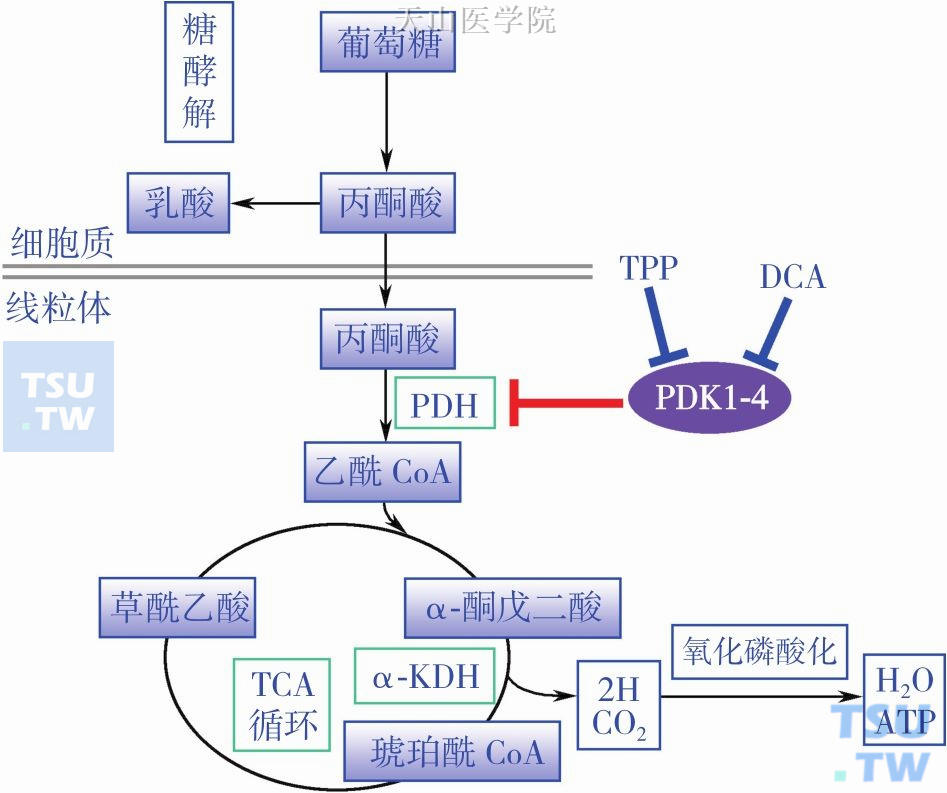
图1-7-3 DCA的作用机制
20世纪80年代开始有人将它用于肿瘤动物及患者的治疗,2008年Michelakis ED等人发表了著名的论文——Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer(DCA可以作为一个肿瘤代谢治疗的潜在靶点),2013年他们又报告了Pyruvate dehydrogenase kinase as a novel therapeutic target in oncology(丙酮酸脱氢酶激酶可以作为肿瘤治疗的新靶点),发现经DCA治疗后肿瘤细胞异常糖代谢扭转,线粒体功能恢复正常,Warburg效应得以抑制,有氧氧化明显增强,肿瘤细胞凋亡,肿瘤病灶显著缩小(图1-7-4)。2014年Badr MM等报告,DCA不仅具有代谢调节作用,而且具有免疫调节作用。他们发现:DCA可以刺激脾细胞产生IFN-γ,但是不产生IL-17;刺激巨噬细胞产生IL-12,但是不能调节T细胞及自然杀伤细胞产生IFN-γ;脾细胞产生IFN-γ的作用可以被抗IL-12抗体所抑制。结论认为:DCA通过激活IL-12-IFN-γ途径,趋化细胞因子向Th1细胞转变,从而发挥免疫调节作用。
维生素B1的主要磷酸化衍生物焦磷酸硫胺素(thiamine pyrophosphate,TPP)作为丙酮酸脱氢酶复合物的重要组成成分,参与脱羧作用。Comín-Anduix 等研究发现当维生素B1摄入量大于推荐剂量的75倍时肿瘤增殖停止了,显示出抗增殖效应。最近在胰腺癌和神经母细胞瘤细胞系的研究进一步证实高剂量硫胺素可显著抑制肿瘤细胞增殖,同时促进肿瘤细胞凋亡。并且发现高剂量硫胺素的抑制作用类似于DCA,能显著降低PDH磷酸化水平,降低葡萄糖消耗、乳酸产生和线粒体跨膜电位。高剂量硫胺素和DCA两者都具有靶向肿瘤代谢表型而对正常细胞没有影响,但硫胺素的IC50显著小于DCA,更具有安全性和应用前景。因为达到抗肿瘤作用的DCA需要量达到mmol级,换算为成人用量达到25mg/(kg•d),这个用量会导致患者神经系统毒性病变,包括线粒体肌病、脑病变和卒中样发作等,而硫胺素是人体功能的必需维生素,在抑制肿瘤生长的高剂量时几乎没有产生剂量限制性毒性反应。研究显示正常人给予1.5g/d硫胺素没有任何副作用,给予7.5g/d硫胺素时只出现轻微的消化不良症状(图1-7-3和图1-7-5)。维生素B1与肿瘤的关系详见本书第三章第五节。
