病例与思考
患者,男性,58岁,因持续性吞咽困难加重入院,患者主诉:吞咽困难,胸痛,食物反流感,夜间咳嗽加重3周。既往病史:一年前,曾发生吞咽困难,持续两月,当时未予以治疗。入院时,患者X线显示食管上部1.5cm处有狭窄,食管钡剂排空延迟,见图6-9-1。该患者自从发病后,进食减少,体重较发病前下降6%。入院时,BMI为25。实验室检查结果:血红蛋白计数108g/L,红细胞4.3×1012,ESR 5mm/h。
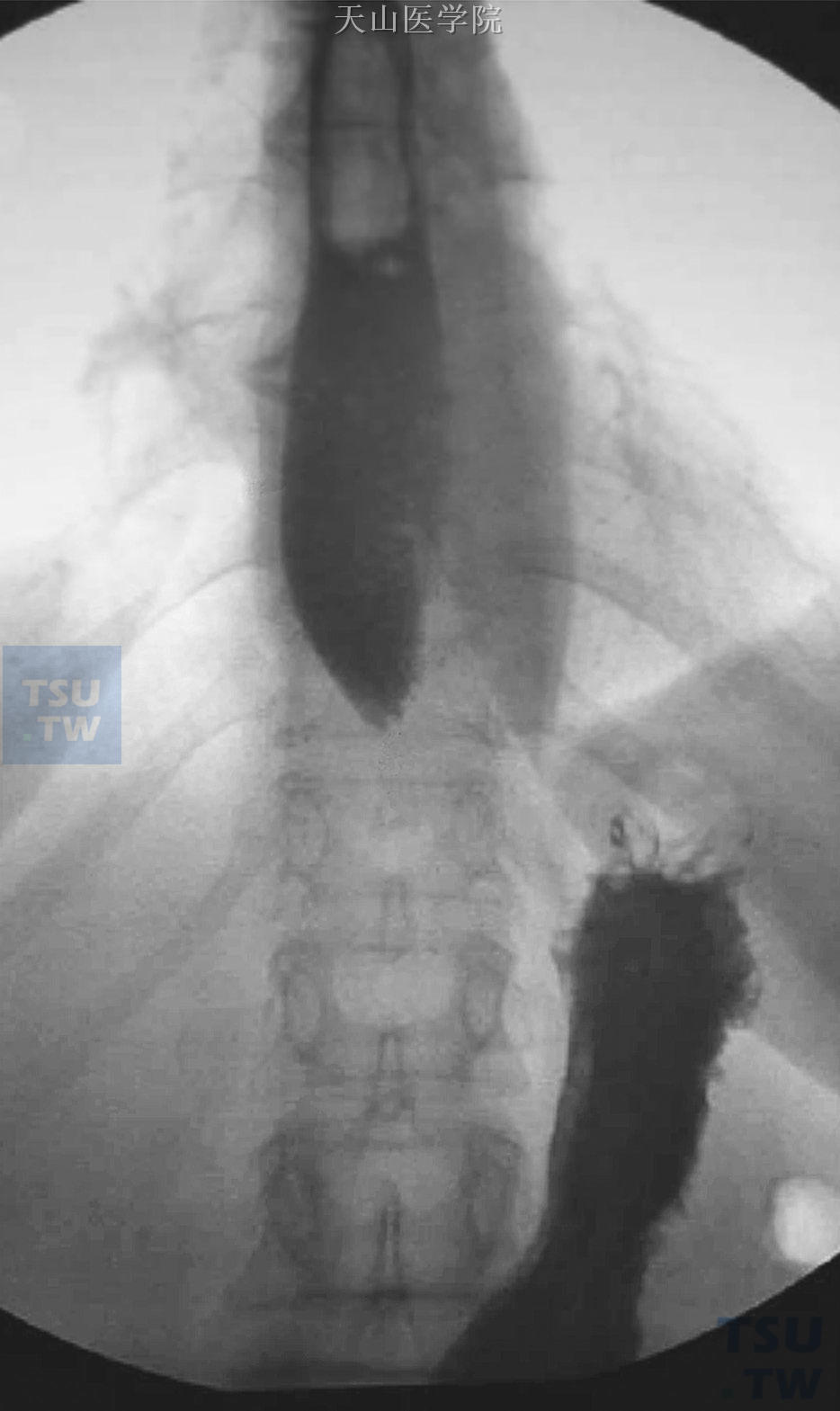
图6-9-1 食管吞钡实验
箭头所指出显示食管狭窄,呈现“鸟嘴样”改变,食管下括约肌痉挛
- 该患者体重丢失原因是什么?体重丢失能否通过一般营养支持逆转?
- 该患者能否诊断为恶液质?为什么?
- 欲评估此时患者的炎症反应程度,还需要测量哪些实验室指标?
- 针对该患者体重丢失的恰当治疗有哪些?
- 如果不予治疗,疾病晚期时,患者的身体组成成分有什么变化?
体重丢失的概述
由恶液质引发的体重丢失(weight loss)已经成为影响患者致死率和致病率的重要因素。例如,体重丢失的发生率在术前肿瘤患者中占75%,在放疗患者中占57%,化疗患者中占51%。在社区肿瘤患者中,也至少有80%的患者出现恶液质导致的体重降低。在肿瘤患者中,最易出现体重降低的恶液质患者是胃肠道肿瘤和头颈部的肿瘤。在体重降低的恶液质患者中,决定预后的因素是疾病的侵袭性,治疗措施,以及患者心理状况。
体重丢失的表现
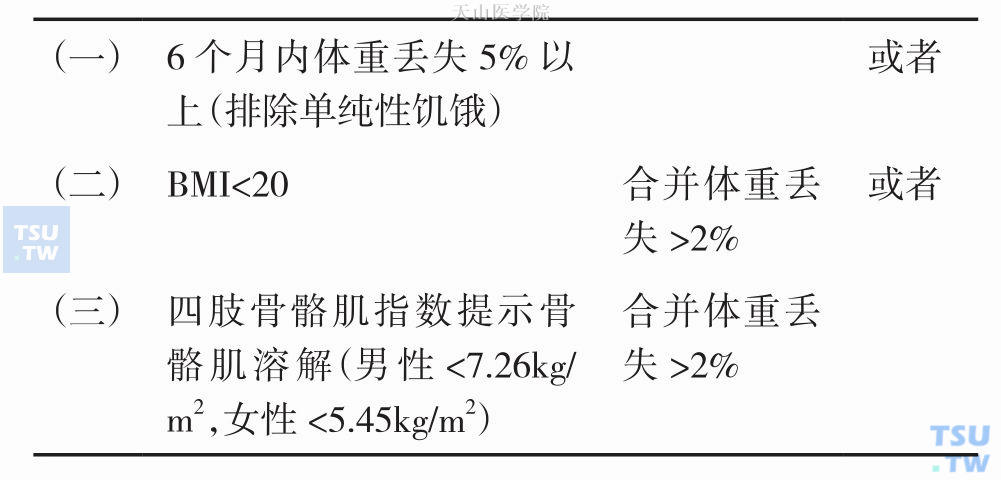
根据公认的恶液质诊断标准,体重丢失表现为:近六个月内体重丢失量是正常体重的5%以上,或者体重丢失2%以上伴随出现消耗症状,消耗症状通常为体质指数(body mass index,BMI)小于20或者出现骨骼肌溶解,见表6-9-1。体重丢失一般不能通过营养支持逆转。即使患者摄入更多的能量,瘦体组织(lean body mass)依然减少。
表6-9-1 恶液质诊断标准
持续性体重降低是病情恶化的标志,当患者持续体重下降,伴随出现能量储备耗尽和蛋白质消耗时,容易出现严重并发症。初始体重对患者预后有影响。比如,当患者BMI为22时,即使是降低5也会产生严重后果。相比之下,如果患者初始BMI 是35,则降低5没有那么严重的后果。另外,在BMI是30且合并体重降低的患者中,出现骨骼肌溶解则预示患者预后较差。体重丢失与恶液质分期的关系见图6-9-2。
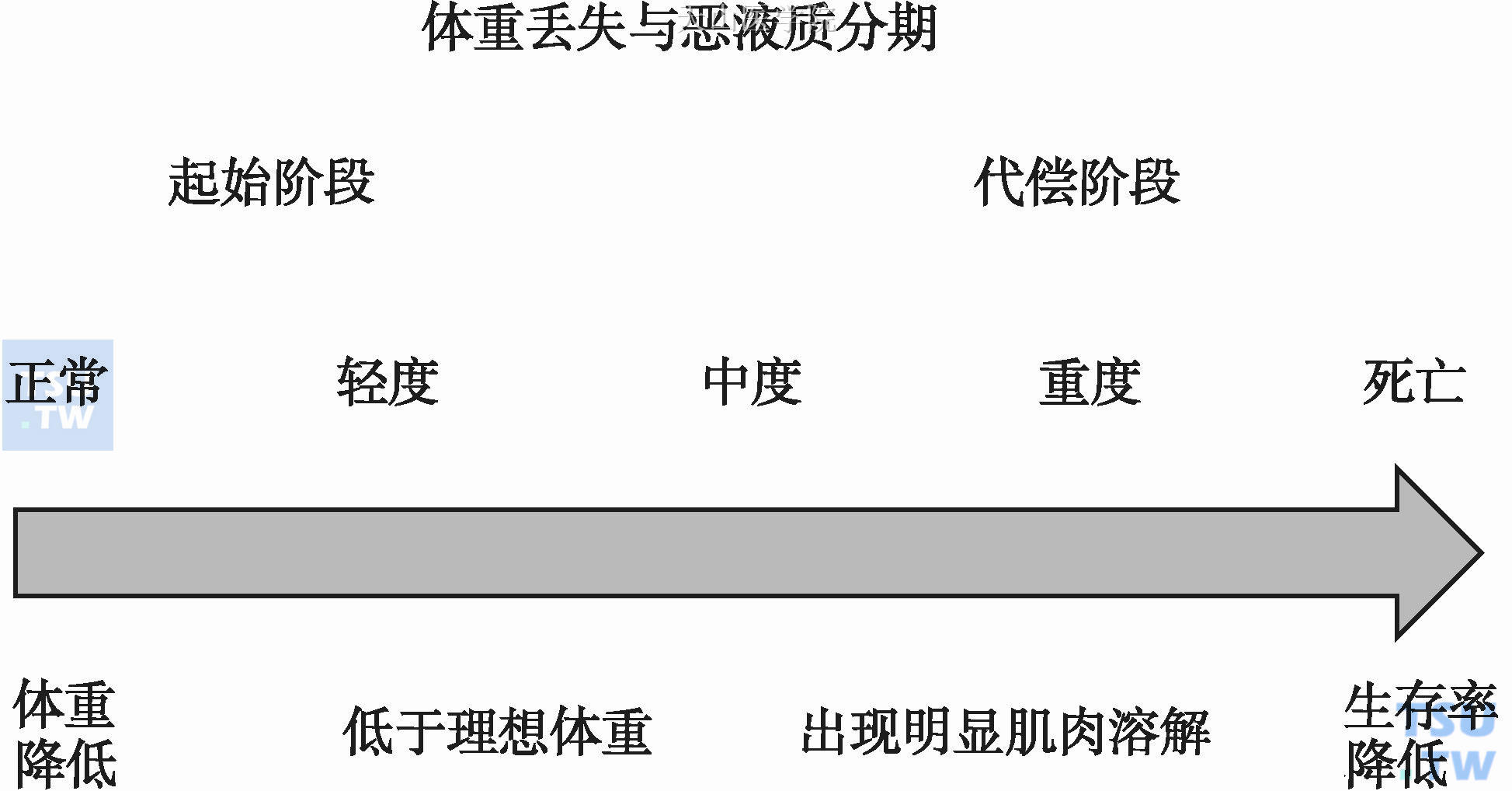
图6-9-2 体重丢失与恶液质分期
在恶液质的发生发展过程中,体重丢失是恶液质前期的征兆,在恶液质前期,体重丢失≤5%,且出现厌食。在恶液质中期,体重丢失≥5%或者BMI小于20+体重丢失>2%或者出现骨骼肌溶解+体重丢失>2%
恶液质导致的体重降低的原因
(一) 厌食或者营养摄入障碍
能够加重厌食的因素包括:中枢神经性厌食,味觉和触觉感受器障碍,上消化道蠕动减弱,远端消化道蠕动障碍(如治疗便秘后)。为了评估摄入障碍的程度,需要测量蛋白质和能量摄入。只有当能量和蛋白质摄入这两个指标达标后,我们才能正确评估厌食水平。住院患者能量需要量是20~30kcal/(kg•d),蛋白质需要量为0.6~1.5g/(kg•d)。当患者摄入量没有达到标准时,就要警惕恶液质的进展。
(二) 分解代谢增强
恶液质的患者由于原发病,自身往往处于高分解代谢的状态。在肿瘤代谢,评估分解代谢的最好指标是系统炎症。如果在某些病例没有明显的炎症,则需要间接指标,比如患者对化疗的反应。在恶液质的系统炎症中,C反应蛋白(C reactive protein,CRP)是最好的评价指标。
(三) 骨骼肌总量减低
恶液质重要的特征之一就是骨骼肌重量减少。当患者体重丢失30%时,患者骨骼肌减少量可达到75%。骨骼肌消耗的原因是蛋白质代谢异常。患者血浆中升糖氨基酸浓度减低,支链氨基酸浓度正常或者偏高。骨骼肌中蛋白的降解导致氨基酸释放入血中,比如丙氨酸和谷氨酰胺。测量骨骼肌重量首选CT和MRI,其次可选用双能量X线成像。另外,在普查中可采用上臂肌面积和生物阻抗。
(四) 功能和心理因素
功能因素是由于原发病导致的机体功能障碍,通常是各种器官的功能减低。而近年来的生物-社会-心理模式则强调心理因素的影响。目前用于评估功能因素的的有“Karnofsky机体功能量表”。和欧洲肿瘤治疗研究组织生活质量量表(European Organisation for Research and Treatment of Cancer Quality of Life Questionnaire-Core 30,EORTCQLQC30)。
体重丢失的激素和体液介质的改变
(一) 瘦素
瘦素能够调节机体脂肪代谢和降低食欲,瘦素的作用是通过下丘脑神经肽生长素(Ghrelin)和神经肽Y(neuropeptide Y,NPY)完成的。当饥饿时,机体瘦素分泌减少,能量消耗小于能量摄入,能量代谢变成正平衡。所以,当机体处于如肿瘤等的恶液质疾病过程中,机体产生类似下丘脑的信号,模拟瘦素的作用,导致机体厌食和能量消耗增加,体重丢失。
(二) 5-羟色胺(5-HT)
在肿瘤患者厌食的发生发展中有重要作用。顺铂诱导的恶心呕吐与5羟色胺相关。实验表明在注射顺铂的肿瘤小鼠中,5羟色胺含量显著增加。并且,5-HT2C受体与食欲调节有关,5-HT2C受体表达于阿片-促黑素细胞皮质素原(proopiomelanocortin,POMC)细胞,而POMC与厌食反应有关。所以在现阶段的临床治疗中,5-HT受体拮抗剂可以与抗肿瘤药物连用,以减轻恶心呕吐。
(三) 细胞因子
细胞因子是由淋巴细胞和(或)单核巨噬细胞释放的蛋白质分子。TNF-α、IL-1、IL-6、IFN-γ都跟恶液质的病因有关。细胞因子来源有两个:肿瘤细胞或者机体炎症细胞。注射这些细胞因子,可以导致摄食减少和恶液质的发生。有实验报道:在荷瘤动物中,腹腔注射TNF受体拮抗剂可以改善厌食症状。IL-1、IL-6也与肿瘤相关恶液质有关,一方面,IL-1β是一氧化氮合酶(nitric oxide synthase,iNOS)的激活剂,产生NO,抑制关键酶和氧化磷酸化。此外,NO能够损伤骨骼肌的收缩能力。
(四) C反应蛋白
C反应蛋白(C reactive protein,CRP)是最常用的评价炎症反应的指标。在Glasgow预后评分中,CRP和血浆白蛋白浓度是评价预后因素的独立指标,见表6-9-2。当患者入院时候,CRP升高是各种死亡率的不良预示指标。比如,当CRP浓度高于80mg/L时,肿瘤患者死亡率升高至22.8倍。在小细胞肺癌的患者,许多出现体重丢失的患者都伴有CRP水平的升高。在另一项消化道食管癌的病例研究中,体重丢失的程度和血清CRP浓度的升高相关。
表6-9-2 改良Glasgow预后评分

体重丢失的相关分子通路机制
(一) PI3K/Akt/mTOR通路
磷脂酰肌醇3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白[phosphatidylinositol-3-kinase(PI3K)/ protein kinase B(Akt)/the mammalian target of Rapamycin(mTOR),PI3K/Akt/mTOR]是一种细胞间信号通路,在肿瘤和凋亡中有重要作用。该通路激活能导致肌肉高度增生,被抑制后则出现肌肉萎缩,肌肉重量减少。比如,胰岛素样生长因子-1 能够激活Akt,继而激活mTOR激酶,p70S6激酶磷酸化增强,真核转录因子4E-BP-1磷酸化,蛋白合成增多。然而,最近的研究表明,当这条通路被抑制后,蛋白合成明显减低。在肿瘤,糖尿病和尿毒症导致的恶液质中,mTOR、p70S6磷酸化水平明显降低,与蛋白合成降低有明显相关性。此外,当小鼠注入Akt1基因的干扰剂,出现了明显的生长迟缓,Akt1和Akt2敲除的小鼠也出现了显著的肌肉萎缩。
(二) 核因子κB(nuclear factor-kappa B,NF-κB)通路
NF-κB是一种控制DNA转录的蛋白复合体。广泛分布于所有动物体内。各种应激因素(如紫外线、过氧化、细胞因子)通过此通路显现作用。该蛋白复合体中的κ轻链是免疫球蛋白的关键成分,因此,NF-κB的异常调节与免疫抑制异常相关。在肿瘤、炎症、自身免疫、病毒感染、脓毒症休克时,NF-κB发挥了重要作用。在哺乳动物中,有5种NF-κB转录因子,分别是p65(Rel A)、Rel B、c-Rel、 p52 和p50。泛素和肿瘤坏死因子-α(tumor necrosis factor,TNF-α)能够激活该通路。TNF首先降解蛋白Ik-B,然后激活p65/p50复合体。研究表明,基因敲除P50,则动物不会出现肌纤维萎缩。当使用IKKβ(inhibitor of nuclear factor kappa-B kinase)时,老鼠表现出不同的肌肉萎缩表型,这提示IKKβ是肌肉萎缩的充分条件。
(三) myostatin-Smad2/3(myostatindrosophila mothers against decapentaplegic protein)通路
肌肉生成抑制素(myostatin)属于转录生长因子(TGF-Beta)家族,属于肌肉生长的负性调节因素,myostatin抑制蛋白合成,myostatin突变的动物出现肌肉过度增殖。Myostatin的作用是通过Smad2或者Smad3的核转位,以及Smad4的异二聚体形成。Myostatin通路与mTOR通路可能有交叉作用。在通过细菌转导形成的肌肉过度增生的模型中,mTOR的小干扰RNA能够部分阻断该途径。关于myostatin在信号通路中的详细机制尚未完全阐明,尽管存在实验证据表明抑制myostatin后有助于治疗恶液质,但是也存在一些相反的结果报道。见图6-9-3、图6-9-4。
人体组成成分的变化与代谢异常
恶液质的患者会发生人体组成成分变化,其中,最主要的变化是机体蛋白质减少,糖原减少且利用障碍,脂肪减少。
最常见的碳水化合物代谢改变是糖异生增加,胰岛素分泌受损,以及胰岛素抵抗。胰岛素的代谢障碍会导致外周血糖升高和利用障碍,糖耐量降低。恶液质时,己糖激酶,磷酸果糖激酶,细胞色素C氧化酶活力都降低,与糖异生有关的葡萄糖-6-磷酸脱氢酶活力升高。肿瘤坏死因子(TNF-α)能够伴随糖代谢障碍同时存在,急性炎症与糖代谢障碍有关。与高血糖对应的是静息状态的能量消耗升高,尤其是肺癌和胰腺癌的患者。在恶液质的患者中,胰岛素抵抗会导致机体无法充分利用葡萄糖,于是恶液质的高代谢状态则依赖于脂肪动员。这是因为脂肪具有高能量密度(9kcal/g),脂肪组织在恶液质中变成了主要的供能物质。在恶液质中,85%的脂肪组织都会被消耗供能。脂肪代谢异常表现为:脂肪溶解增加,脂肪组织生成减少。脂蛋白脂肪酶活动减低。脂肪动员可能与β受体激活有关,在恶液质患者身上使用β受体阻滞剂,能观察到能量消耗降低,脂肪溶解减少。恶液质对于蛋白质的影响在于分解代谢增加,合成代谢降低。恶液质的蛋白代谢紊乱最明显的表现在于选择性骨骼肌减少。当恶液质患者体重减低30%时候,骨骼肌的重量减低就会达到75%。肌肉重量减低是预测恶液质患者预后的重要指标。肌肉质量严重减少的患者无法承受抗肿瘤治疗的风险,肌肉质量在预测恶液质致死率方面具有重要意义。
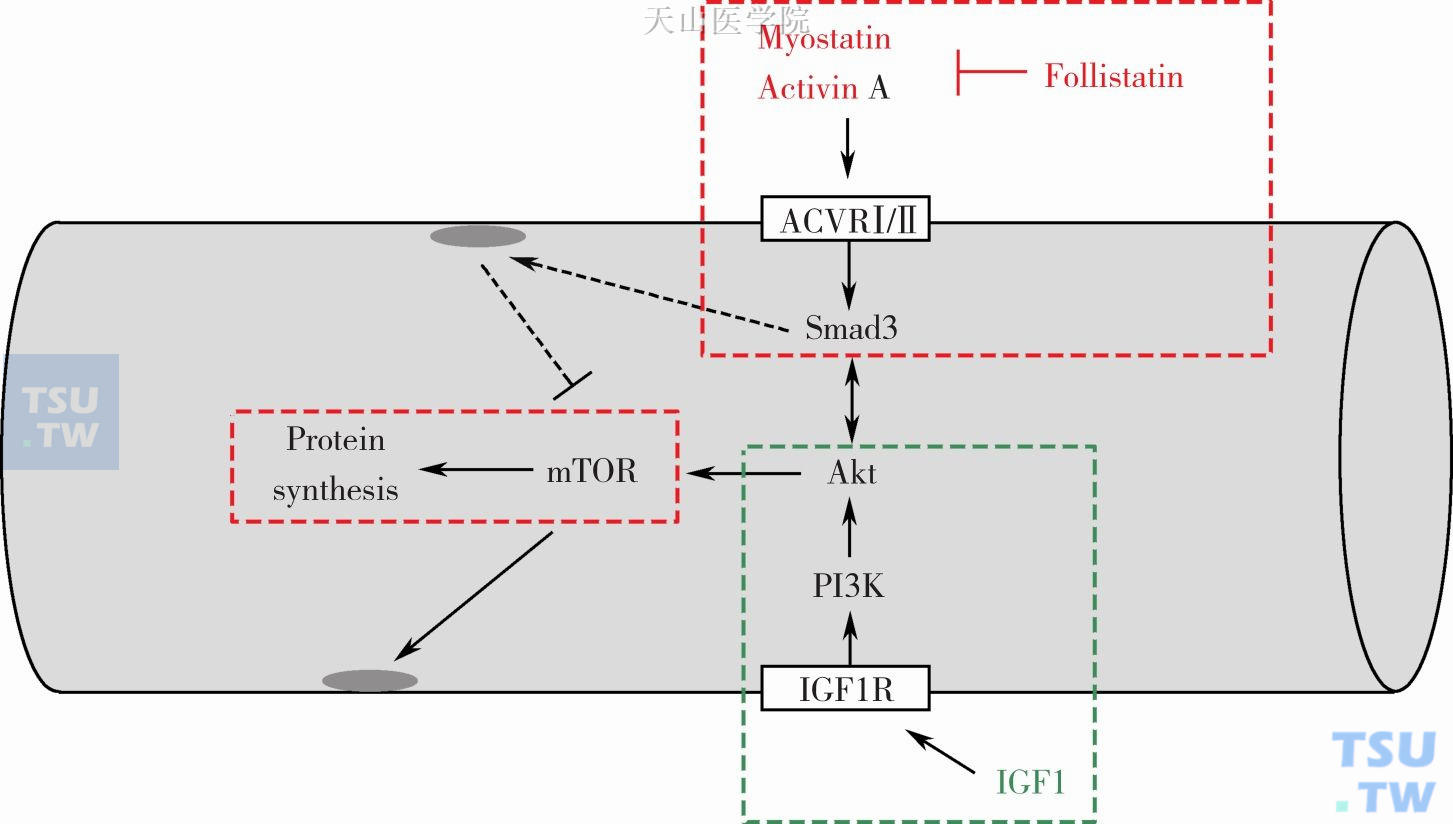
图6-9-3 蛋白质合成中的myostatin-Smad2/3通路
Myostatin:肌肉生长抑制素;Follistatin:卵泡抑素;ACVR:activin A receptor,活化素A受体;Smad:drosophila mothers against decapentaplegic protein,果蝇母抗同源序列蛋白;Akt:蛋白激酶B;IGF:insulin like growth factor,胰岛素样生长因子。实线箭头表示在mTOR中的转录作用。虚线箭头表示与蛋白合成有关
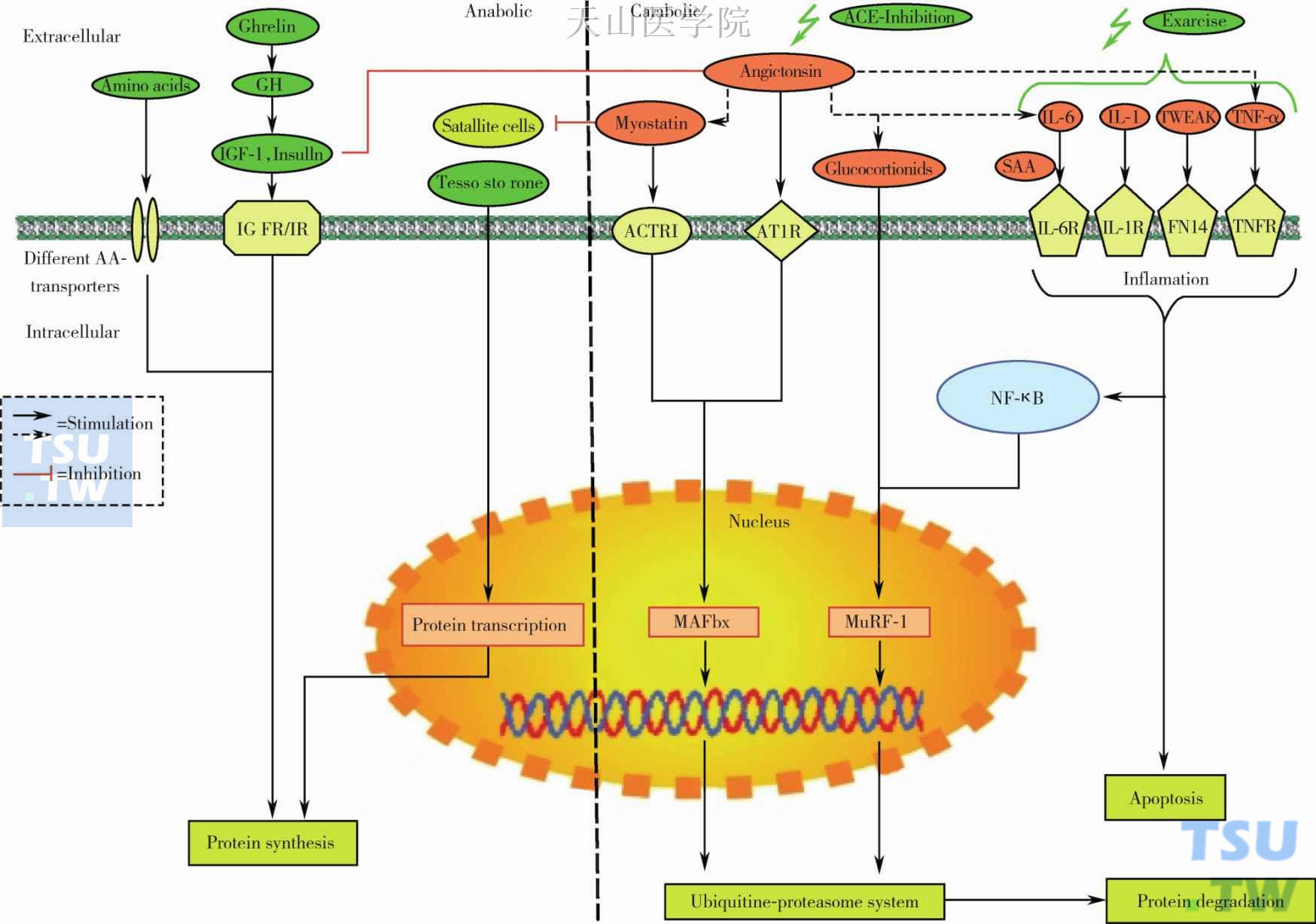
图6-9-4 相关分子通路汇总(黑色箭头表示促进,红色线段表示抑制)
AA:amino acids,氨基酸;ActRⅡ:actin-related protein 2,肌动蛋白相关蛋白2;AR:androgen receptor,雄激素受体;AT1R:angiotensin Ⅱ type I receptors,血管紧张素2受体1;ghrelin:生长素;GH:growth hormone;生长激素;GR:glucocorticoid receptor,糖皮质激素受体;GSK3:glycogen synthase kinase 3,糖原合酶激酶3;IGF-1:insulin-like growth,factor 1,胰岛素样生长因子-1;IGFR:insulin-like growth factor receptor,胰岛素样生长因子受体;IL-1:interleukin-1,白介素-1;IL-6:interleukin-6,白介素-6;IL-1R:interleukin-1 receptor,白介素-1受体;IL-6R:interleukin-6 receptor,白介素-6受体;IR:insulin receptor,胰岛素受体;Myostatin:肌肉生长限制因子;MAFbx:muscle atrophy F-box,肌肉萎缩F盒;MuRF-1:Muscle RING-Finger Protein-1,肌肉环指蛋白-1;NF-κB:nuclear factor“kappa-light-chain enhancer”of activated B cells,B细胞核因子kappa轻链增强子;SAA:serum amyloid A,血清淀粉样蛋白A;Testosterone:睾酮;TNF-α:tumor necrosis factor-alpha,肿瘤坏死因子-α;TNFR:tumor necrosis factor receptor,肿瘤坏死因子受体;TWEAK:tumor necrosis factor-like weak inducer of apoptosis,肿瘤坏死因子样凋亡微诱导子
针对体重丢失和人体组成成分变化的治疗
(一) 开胃剂
对于有明显厌食的患者,早期使用开胃剂是最好的选择。孕激素类药物,如甲地孕酮和甲羟孕酮。大剂量的孕激素药物可以提高70%的患者的食欲,这与孕激素降低炎性介质有关。但是关于孕激素的应用还存在争议。由于孕激素具有拮抗雄激素的性质,所以,孕激素实际上是抑制肌肉蛋白合成,增加的体重是来源于孕激素的保水和脂肪沉积作用。另外在应用的剂量上面,也没有统一的标准。孕激素还会存在潜在的副作用。
(二) 促骨骼肌合成代谢药物
由于恶液质的特征之一是选择性骨骼肌减少,所以针对骨骼肌的治疗至关重要。体液中的炎症因子是调节骨骼肌溶解的关键介质,所以,很多药物都是针对这一机制。主要的药物包括抑制细胞因子合成与释放的药物和细胞因子拮抗剂。前者如:环氧酶抑制剂(COX-inhibitor)、己酮可可碱(pentoxifylline)、沙利度胺(thalidomide)。血管紧张素转换酶抑制剂,后者有苏拉明(suramin)、抗炎细胞因子(IL-12、IL-15)等。目前,只有COX-抑制剂和EPa(eicosapntemacnioc acid,二十碳五烯酸)通过了功效学实验,成为标准疗法中的药物。
(三) 体力锻炼
体力活动对恶液质治疗有辅助疗效。体力活动能增加胰岛素敏感性,增加蛋白质合成和一些抗氧化酶的活力。并且,锻炼还能抑制炎症反应和增加免疫力。研究表明,低度阻抗伴有高重复的耐力运动能够改善恶液质的疲劳症状,但是,高阻抗伴低重复的运动则加速肌肉的消耗,加重恶液质。体力锻炼适用于卧床期间,因为此期间体力活动锐减,肌张力,瘦体重都会减少,所以此时应用体力锻炼能有效防止疲劳和抑郁的发生,并且维持肌张力。
(四) 对症支持
恶液质的患者往往出现一系列的症状和体征,对于这些症状,医生应该竭尽所能的缓解症状,做到对症支持。比如,临床医师可以使用抗呕吐剂治疗恶心、呕吐,使用促胃动力消耗药治疗提前出现的饱腹感,用胰酶治疗吸收不良,泻药治疗便秘。一旦出现剧烈疼痛,用最小剂量的镇静剂治疗剧烈疼痛。
(五) 心理和行为干预
最近研究表明,心理和行为疗法有助于改善生命质量,并且延长期望寿命。常见的心理干预包括:催眠、放松训练和短期小组心理疗法。据统计,心理压力和精神障碍在肿瘤中发生率为10%~79%。在肿瘤的家属中,这一现象也很常见。所以,心理干预能够很好地解决这部分人群的问题。
(朱乾坤 李丹)
