病例与思考
患者,男,62岁,2013年11月2日因胸骨后疼痛、反复呕吐入院。患者2012年6月初无明显诱因出现吞咽梗阻感及胸骨后疼痛,在我院行食管镜示:(食管)高分化鳞癌,2012年7月1日在我院胸外科行食管癌切除、胃代食管主动脉弓下吻合术。病理:(食管下段)高分化鳞癌(溃疡型,3cm×3cm)侵达外膜。食管旁(1/2)、贲门周围(3/3)淋巴结内癌转移。术后放疗4600Gy/25次,采用紫杉醇+氟尿嘧啶方案化疗四周期。2013年8月起患者再次出现吞咽梗阻感,胸骨后疼痛、反复呕吐,病情逐渐加重,钡餐及胃镜示吻合口复发,取病理为鳞癌。现患者活动明显减少,卧床3天。体重下降明显,意识清楚,在过去10天内进食减少,只能进食少量流食。体格检查:(2013年8月)身高:174cm;体重:74kg;脉搏:80次/分;呼吸:20次/分;血压:120/82mmHg;ECOG:1。(2013年11月)体重:55kg;脉搏:95次/分;呼吸:22次/分;血压:102/63mmHg;ECOG:4。现患者平卧位,皮肤干燥、无黄染,双眼凹陷,皮肤褶皱明显,几乎触不到皮下脂肪和肌肉,患者口唇异常红润,头发干枯易脱落。浅表淋巴结未触及肿大,双肺呼吸音清,心律齐,心率95次/分,肋骨分明,可见心尖搏动,肝脾未触及肿大,腹部无压痛及反跳痛,双下肢轻度凹陷性水肿。辅助检查:C-反应蛋白(CRP):34.3mg/L,参考值(0~6)mg/L;白介素-1(IL-1)10.83pg/L,参考值(0~3.92pg/L)。
- 根据 2011 年恶液质国际专家共识,患者是否符合恶液质诊断标准?
- 非甾体抗炎药物治疗肿瘤恶液质患者是否安全有效?
- 非甾体抗炎药的作用机制是什么?
恶液质多见于慢性消耗性疾病,常出现于慢性病的终末期,如肿瘤、AIDS 和终末期肾衰等。肿瘤恶液质(cancer cachexia)临床上很常见,近20%肿瘤患者直接死于恶液质。在上消化道实体瘤(85%胃癌患者)和肺癌(61%非小细胞肺癌患者)中恶液质尤为常见。目前,对非肿瘤患者恶液质的发生机制并不完全了解,但对肿瘤恶液质的发病机制,尤其是局部致炎因子的释放所产生的作用已有较详尽的研究。
肿瘤恶液质的发生机制十分复杂,目前认为是宿主与肿瘤之间相互作用的结果。肿瘤发生恶液质过程中,肿瘤局部分泌蛋白水解诱导因子(proteolysis-inducing factor,PIF)、脂质动员因子(lipid-mobilizing factor,LMF)导致宿主产生全身炎性反应的细胞因子,如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素-1(interleukin-1,IL-1)、白介素-6(interleukin-6,IL-6),这些因子直接诱导机体发生肌蛋白降解、脂肪分解亢进,从而产生生物级联反应,导致恶液质的产生。
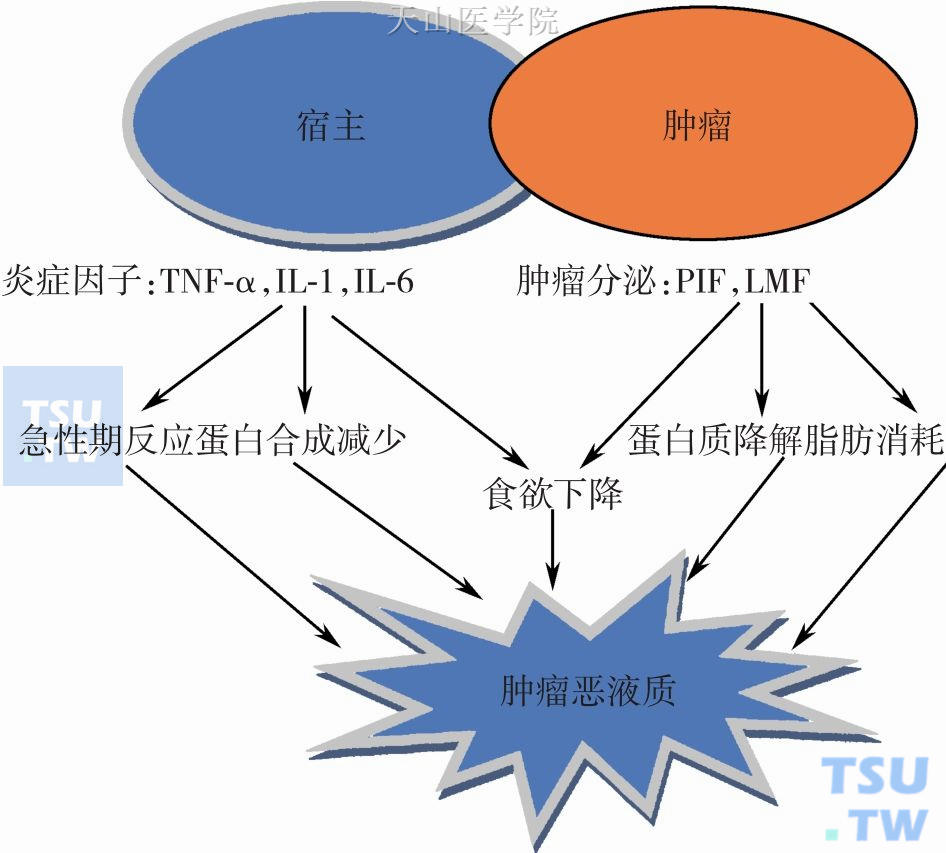
图10-3-1 肿瘤恶液质的病理生理
因此,处理肿瘤恶液质的代谢紊乱应该集中在下调肿瘤引起机体的炎性反应。目前发现TNF-α、IL-1、IL-6、干扰素γ(interferon-γ,IFN-γ)等是肿瘤恶液质发生的重要因子,肿瘤组织分泌上述因子可诱导肝脏发生急性期蛋白反应(acute phase protein response,APPR),在提高局部炎症反应同时激活全身炎症细胞,产生机体细胞因子瀑布般穿越肿瘤,在骨髓、肌细胞、肝细胞、脂肪细胞、上皮细胞及神经元等多靶位点发挥作用,产生复杂的生物级联反应,导致恶液质的产生。这些细胞因子在恶液质发生过程中相互关联、协同作用。因此,治疗恶液质的策略应该是抑制细胞因子合成或抑制这些因子发挥作用。
相关致炎细胞因子的研究
肿瘤坏死因子α(TNF-α)
TNF-α能引起实验动物厌食、脂肪消耗、无脂体重降低,导致肿瘤恶液质的发生。给裸鼠注射转染有人TNF-α基因的卵巢癌细胞后,血TNF-α升高,并出现进行性消瘦、厌食等类肿瘤恶液质综合征,并很快死亡。将此细胞移植到裸鼠脑内可产生厌食和体重下降等与饥饿类似的症状,并且全身脂肪储备下降。将此细胞移植到裸鼠肌肉内未发生明显厌食,但50天后出现蛋白和脂肪都有消耗的肿瘤恶液质。此外,将TNF-α与脂肪细胞一起培养可诱发剂量依赖的脂肪分解,尤以最初6小时为著,试验组与对照组差异显著。
多数学者认为TNF-α能直接激活肌肉蛋白的分解。给无瘤大鼠注射TNF-α后骨骼肌蛋白降解率升高,但体重下降不明显。给荷瘤大鼠注射抗TNF-α单抗可使骨骼肌、心脏和肝脏蛋白降解率降低。体外肌肉与TNF-α孵育180分钟后,C8蛋白酶的表达未增加而泛素(ubiquitin)基因表达升高。以上结果均说明TNF-α与肌肉蛋白的分解密切相关。把肝癌细胞移植到裸鼠后,实验动物体重下降,内源性TNF-α和前列腺素E2(prostaglandin E2,PGE2)升高。在Lewis肺腺癌中,抗TNF-α抗体可部分逆转脂肪丢失,但对摄食量和体重没有影响。
但是,也有部分研究显示肿瘤恶液质未见血液中TNF-α升高,认为血液中TNF-α升高与肿瘤恶液质的发展无关。其可能的原因为细胞因子从生成部位转运至靶组织过快未致血浓度升高。
白介素-6(IL-6)
荷瘤动物模型显示IL-6升高与肿瘤恶液质发展相关,给小鼠注射抗IL-6单抗能减轻小鼠体重下降和肿瘤恶液质的其他指标。荷瘤且无体重下降者,血IL-6 浓度低于带瘤有体重下降者。Espat等的研究结果显示,如果连续7天给健康小鼠注射IL-6(250mg/kg•d),可导致小鼠肝脏出现APPR,但对食物摄取或体重没有影响。舒拉明属于一种萘磺酸盐,能抑制IL-6与细胞膜受体的结合,可部分阻断荷瘤动物模型发生肿瘤恶液质,但不减轻肿瘤负荷。在宫颈癌动物模型中,IL-6 通过促进肿瘤细胞在裸鼠体内生长从而诱发肿瘤恶液质。胰腺癌患者中,患者生存与C反应蛋白及IL-6间有密切关联。循环系统中的IL-6水平增加,是肿瘤恶液质患者全身性炎症反应的证据之一。
某些细胞因子调节剂,如IL-12 能使荷瘤小鼠IL-6 下降,减轻肿瘤恶液质导致的体重降低、脂肪消耗和低血糖。IL-10被认为是细胞因子合成抑制因子,给荷瘤小鼠转染IL-10 基因后血浆IL-6 下降虽未达到基线,但防止了肿瘤恶液质发生。由于IL-6 的不完全降低可阻止肿瘤恶液质,表明还有其他未知因子参与肿瘤恶液质发生。
抗IL-6 受体抗体可减轻腓肠肌重量的减少,抑制组织蛋白酶B 和L 的活性,降低组织蛋白酶L 的mRNA 水平。IL-6 转基因小鼠的肌肉萎缩可被抗IL-6 受体单抗阻断。肌肉萎缩与组织蛋白酶B、L的mRNA 升高相关。给大鼠注射IL-6 后迅速激活骨骼肌降解。用鼠C2C12肌管与重组人IL-6 培养可缩短蛋白的半衰期,提高26S 蛋白酶和溶酶体酶的活性,显示IL-6 有直接提高蛋白降解的作用。与TNF-α不同,有体重下降的非小细胞肺癌、大肠癌患者IL-6 和C-反应蛋白显著上升。
白介素-1(IL-1)
IL-1作用类似于TNF-α,能抑制脂蛋白脂酶的活性,加速脂肪分解。给小鼠注射重组IL-1 后出现厌食、体重下降、低蛋白血症和淀粉样物质升高等症状,其致厌食作用强于TNF-α。在MCG101 肉瘤恶液质模型小鼠中发现脾、肝、小肠、大脑中均有IL-1mRNA 的表达。IL-1 和TNF-α都能在瘤组织中检出,但含量与正常组织相似。给荷瘤大鼠注射IL-1 受体拮抗剂未能防止组织消耗和蛋白高代谢。用IL-1 受体拮抗剂基因转染肿瘤恶液质细胞系也未阻止肿瘤恶液质症状的程度,这说明IL-1不能单一发挥作用,有赖于其他细胞因子如IL-4、IL-10、IL-12的相互作用。
干扰素γ(IFN-γ)
体外实验表明IFN-γ与TNF-α对脂肪代谢的作用相同,荷lewis 肺癌小鼠体重下降与IFN-γ有关,抗IFN-γ抗体可减轻脂肪消耗,但不减轻蛋白质消耗;可减轻MCG101 肉瘤大鼠体重下降、厌食症状,延长生存时间。给小鼠接种转染了IFN-γ基因的细胞可致厌食、脂肪消耗和体重下降,但作用不完全且维持时间较短。表明IFN-γ不是肿瘤恶液质的唯一介质。在黑色素瘤患者中,IFN-γ较常人上升53%。
恶液质症状的程度不仅与上述致炎细胞因子的作用有关,还取决于抗炎细胞因子如IL-15,IL-10的作用。有报道称IL-15能抑制ATP-泛素-蛋白酶体途径,明显缓解骨骼肌蛋白质降解、减低DNA断裂的比率、增加运动与解偶联蛋白3(uncoupling protein,UCP)的表达,而这些正是肿瘤恶液质肌肉萎缩的关键之处。体外实验证实了这些细胞因子与骨骼肌萎缩的直接关系,恶液质动物模型中应用IL-15治疗能得到肌肉质与量的双重改善。大鼠的耐力练习可抑制一些促炎因子的产生,增加IL-10 与TNF-α的比值,减轻炎症,其可能对恶液质的治疗有一定价值。
相关药物研究进展
致炎因子导致恶液质的证据越来越多,因此能够抑制细胞因子分泌的药物引起了研究者们的兴趣。一项开放性对照研究中发现沙利度胺可逆转恶液质患者的体重下降。Gordon等通过双盲的随机对照研究发现沙利度胺能够延缓肿瘤恶液质进程,且耐受性较好。Klausner等在一项对混合性患者人群开展的研究中发现,每日300mg沙利度胺治疗后患者的平均体重增加了4.5%,与安慰剂(0.9%)相比疗效显著。
Peluffo等研究表明,非甾体抗炎药(nonsteroidanti-inflammatory drugs,NSAIDs)联合胃黏膜保护药能延长患者生存期、减少机体炎性反应、减慢脂肪消耗。在结、直肠癌所导致的恶液质患者中,非甾体抗炎药布洛芬,可以减少急性相蛋白、IL-6 以及皮质醇的水平,稳定全身的蛋白质动员,这在胰腺癌患者中同样有效。布洛芬系一种环氧化酶抑制剂,可降低肿瘤恶液质患者的静息能耗、消除体重下降的代谢过程、降低血浆C反应蛋白。另一项随机对照临床试验显示,给予晚期肿瘤患者吲哚美辛50mg、每日2次,可以明显延长生存期。虽然此类药物存在一定的不良反应,但仍不失为一种有效而廉价的抗肿瘤恶液质药物。而新型的环氧化酶-2 (COX-2) 抑制剂如塞来昔布等,因其有较高的安全性,可能更适于临床使用,这些药物可能有助于减轻或控制恶液质相关症状。此外,选择性COX-2抑制剂在动物模型中对肿瘤的生长也具有抑制作用。因此,它们的抗肿瘤活性可能有助于恶液质的治疗。在一项使用选择性的COX-2抑制剂塞来昔布的研究中,Lai等将11例恶液质患者(包括头颈部肿瘤或胃肠肿瘤)分为2组,随机接受塞来昔布200mg每日两次或安慰剂治疗,共三周。研究发现,塞来昔布组的患者与安慰剂组相比依从性较好,无不良反应。虽患者体重未明显增加,但生活质量显著改善。最近的一项针对24例晚期肿瘤患者,采用塞来昔布300mg /天治疗共4个月的非随机、前瞻性Ⅱ期临床试验研究结果表明:患者的促炎细胞因子和TNF-α显著下降,去脂体重显著增加,患者的生活质量、行为状态评分、握力显著改善,且依从性良好、未见明显的毒副作用。基于以上研究,塞来昔布目前被认为是抗炎症治疗肿瘤相关恶液质的一个选择。目前开展了一项随机Ⅱ期临床试验,对晚期非小细胞肺癌患者进行了为期12周的多模式干预,包括:塞来昔布、口服营养补充剂,以及体育锻炼,预期2014年12月完成实验,我们期待这项试验带来更多的阳性结果。
二十碳五烯酸(eicosapentaenoicacid,EPA)是长链多不饱和脂肪酸(polyunsaturated fatty acid,PUFA),为鱼油的天然成分,可通过鱼油胶囊或者特制高蛋白、高能量营养品补充。EPA是另一个环氧化酶抑制剂,能减弱肿瘤恶液质的分解代谢因子的作用,抑制脂肪细胞cAMP升高,从而抑制脂肪分解和骨骼肌分解,以此保存蛋白质和脂肪储备,稳定体重。Russell等发现EPA既能下调促炎症反应因子,又能阻断肿瘤恶液质相关因子的影响。Fearon等发现摄入EPA能够抑制营养下降,提高患者机体活动状态,但很少能增加体重。ω-3多不饱和脂肪酸(ω-3PUFA)被认为在减缓肿瘤生长和肿瘤恶液质方面具有一定的治疗效果,其可能机制在于抑制核转录因子-κB(nuclear factor-κB,NF-κB)以减少COX-2的表达,进一步减少由NF-κB诱导产生的其他细胞因子对肿瘤细胞的促进作用。临床研究证实,ω-3PUFA能有效抑制肿瘤恶液质中的蛋白分解代谢,增加无法切除的胰腺癌患者的瘦组织群和体重,延长总生存时间,改善生活质量。
胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)可通过内分泌、旁分泌或者自分泌的方式刺激骨骼肌肥大。Muscaritoli等认为,针对肿瘤恶液质患者,利用重组腺病毒载体进行局部基因治疗,能够增加肌肉IGF-1的含量、促进肌肉肥大和再生,是很有潜力的基因疗法。
肿瘤患者临床应用促红细胞生成素(erythropoietin,EPO)的好处是可以升高患者的血红蛋白水平,Kanzaki等报道显示:EPO对于荷瘤鼠恶液质的阳性疗效不仅在于通过增加红细胞计数来改善代谢和运动能力,还在于能够通过减少恶液质诱导因子IL-6的产生来缓解恶液质症状的程度。
目前认为,ATP-泛素-蛋白酶体在恶性肿瘤引起的肌肉分解萎缩中起重要作用,细胞因子TNF-α、IL-1、IL-6、IFN-γ及蛋白水解诱导因子(proteolysis-inducing factor,PIF)等均参与ATP-泛素-蛋白酶体途径的激活。TNF-α可通过直接激活ATP-泛素依赖的途径而激发肌肉的蛋白水解作用。肌肉特异性的泛素连接酶atrogin-1/MAFbx和肌肉环指蛋白1(musclering finger-1,MuRF-1)被发现对恶液质引起的肌肉萎缩有显著的正调节作用。PI3K/Akt/mTOR途径在调节泛素-蛋白酶体通路和反向调节细胞因子中起重要作用。对ATP-泛素-蛋白酶体途径进行干预给治疗肿瘤恶液质带来曙光,该蛋白水解系统的抑制剂,诸如乙醛肽、乳胞素、β-内酯等均为治疗癌性肌肉萎缩的潜在药物。β2-肾上腺素能受体激动剂Clenbuterol和Formoterol均能降低泛素基因的表达、抑制泛素-蛋白分解系统的过分激活,从而缓解恶液质状态的肌肉分解,其中Formoterol还能减少肌肉细胞的凋亡,刺激卫星细胞增殖而有利于肌肉再生。动物实验证实这种β2-肾上腺素激动剂对于治疗肿瘤相关的肌肉萎缩非常有效,且对心脏和骨骼肌起到选择性有力的保护作用,其可作为一种潜在的手段治疗肿瘤恶液质或其他消耗性疾病。但是,完全阻断这条途径可能会影响其他功能如细胞周期和细胞分化,所以选择性抑制某些成分可能对临床更有利。基于此,一种能特异性阻断骨骼肌肌纤维蛋白质降解的物质仍有待于被发现。由此我们可以看出,肌肉特异性泛素连接酶(atrogin-1和MuRF1)的发现具有重要意义,因为如发现这种合成酶的抑制剂,那么泛素/蛋白酶体水解作用的组织特异性抑制剂也就能诞生。另一方面,进一步阐明ATP-泛素-蛋白酶体途径的上游激活机制以及肌肉蛋白降解过程中可以干预的关键步骤,寻找可能的调控措施,将为临床治疗恶液质开辟新途径。
尽管一些肿瘤恶液质患者的一般状况得到明显改善,但临床治疗追求的目标是稳定现状和延缓衰弱过程。目前还没有单一的治疗措施对所有患者有效,而且往往积极治疗只能产生有限的益处,但这并不能成为放弃治疗的理由。随着对肿瘤恶液质发病机制的深入研究以及针对性治疗药物的开发,恶液质患者有望得到更好的治疗。在循证医学时代,我们期待更多的随机对照研究,客观评价抑制致炎细胞因子的靶向药物疗效。
思考题答案
1. 根据 2011 国际恶液质专家共识提出的具体诊断标准为:(1)无节食条件下,6 月内体重下降>5%,或(2) BMI<20(中国人<18.5)和任何程度的体重下降>2%,或(3)四肢骨骼肌量指数(Appendicular skeletal muscle index)符合肌肉减少症标准(男性<7.26kg/m2,女性<5.45kg/ m2)及任何程度的体重下降>2%。首先,患者6个月内体重下降为(74-55)/74=25.7%;且患者BMI=55/1.742=18.17,均符合恶液质诊断标准,可诊断为恶液质。
2. 众多研究表明,非甾体抗炎药(nonsteroidanti-inflammatory drugs,NSAID)联合胃黏膜保护药能延长肿瘤患者生存期,减少机体炎性反应,减慢脂肪消耗,消除体重下降的代谢过程,降低血浆C反应蛋白。且患者的生活质量、行为状态评分、握力显著改善,依从性良好、未见明显的毒副作用。
3. 非甾体抗炎药的作用机制是减少急性期蛋白、IL-6 以及皮质醇的水平,稳定全身的蛋白质动员,可降低肿瘤恶液质患者的静息能耗,消除体重下降的代谢过程,降低血浆C 反应蛋白。
(王萌 陈公琰)
