病例与思考
患者,男,68岁,2013年3月无明显诱因出现上腹部疼痛以左上腹部为著,偶有后背部疼痛,伴食欲减退、恶心、无呕吐。后症状逐渐加重,6月2日于我院门诊行全腹增强CT检查,诊断为胰头癌,腹腔多发淋巴结转移。6月4日行超声引导下穿刺活检,病理示:胰头部腺癌。6月5日开始行吉西他滨+卡培他滨方案化疗四周期,化疗后疗效评价为部分缓解,腹痛症状及食欲均好转,后因经济原因终止化疗。近一个月无明显诱因再次出现上腹部疼痛并伴食欲减退,体重明显下降,现极度消瘦,卧床不起,近五日不思饮食,靠静脉营养维持生命,为进一步诊治入院。体格检查:(2013年6月)身高:172cm;体重:68kg;脉搏:89次/分;呼吸:19次/分;血压:123/87mmHg;ECOG:1。(2013 年10月)体重:52kg;脉搏:112次/分;呼吸:23次/分;血压:90/56mmHg;ECOG:4。现患者平卧位,皮肤干燥、无黄染,双眼凹陷,皮肤褶皱明显,几乎触不到皮下脂肪,浅表淋巴结未触及肿大,双肺呼吸音清,心律齐,心率112次/分,肋骨分明,可见心尖搏动,肝脾未触及肿大,腹部压痛(+),以左腹部为著,双下肢轻度凹陷性水肿。
- 根据2011年恶液质国家专家共识,患者是否符合恶液质诊断标准?
- 患者目前处于恶液质的哪一个阶段?
- 肿瘤恶液质患者糖补充原则是什么?
恶性肿瘤患者营养不良的发生率相当高,后期常表现为恶液质,发生恶液质后预后明显差,生存时间明显缩短。早在1919年就有研究者在肿瘤恶液质患者中发现糖代谢紊乱是导致恶液质发生的一个重要因素,在疾病发展过程中对胰岛素的敏感性下降,其常被人们忽视。在1959年,JOSLIN等报道了肿瘤和糖尿病在同一患者出现的问题,认为糖尿病可能和肿瘤有关,但在当时缺乏有力的证据。1960年,两者的联系在一次人口普查时再次被提出,肿瘤患者常伴有糖代谢紊乱。近年随着人们生活水平的提高,流行病学和临床观察发现,不仅肿瘤和糖代谢异常这两种严重威胁人类健康的疾病成逐年增加的趋势,且肿瘤伴发糖代谢异常的患者也越来越多见,因此不少研究者开始探讨两者的联系。肿瘤患者出现恶液质的原因和机制非常复杂,有肿瘤本身的原因,也有来自抗肿瘤治疗的相关因素,肿瘤条件下糖类、蛋白质、脂肪的代谢明显异常,研究和探讨肿瘤条件下代谢异常,对治疗肿瘤恶液质具有重要的理论和现实意义。
正常糖代谢
糖类即碳水化合物,人体内的主要糖类是葡萄糖及糖原,而食物来源的糖类主要为淀粉。糖类在人体内的主要生理功能是提供能量,60%左右的能量由糖类代谢提供,它还能提供碳源供机体合成各种有用的生物分子。另外,它还能转变为含氮化合物、参与组织结构的组成、参与细胞信息的传递等。食物中的淀粉经酶化作用分解为葡萄糖,经小肠吸收进入细胞,在整个过程中包括一系列复杂的化学反应(图10-4-1)。糖的分解代谢包括糖酵解、糖有氧氧化和磷酸戊糖途径等。糖酵解是指在无氧条件下,葡萄糖或糖原在胞浆内生成乳酸的过程。其生理意义在于缺氧情况下为机体迅速供能,其中间产物又能为细胞合成代谢提供碳源。糖有氧氧化指在有氧条件葡萄糖彻底氧化分解为水、二氧化碳和能量的过程,它是机体获能的最主要途径,每分子葡萄糖经此途径可产生30或32分子的ATP。磷酸戊糖途径是糖酵解旁路,由6-磷酸葡萄糖经脱氢氧化和脱羧反应生成磷酸戊糖及NADPH+H+,前者经基团转移反应转变为3-磷酸甘油醛和6-磷酸果糖后再进入糖酵解途径或逆过程生成磷酸戊糖,此途径为核酸的生物合成提供5-磷酸核糖,并且该途径是体内唯一生成磷酸核糖的途径。糖异生作用是指非糖物质转变为葡萄糖或糖原的过程,其有助于维持空腹和饥饿时血糖水平、补充肝糖原、增强乳酸利用及体内酸碱平衡的调节。
糖原合成是指在肝及肌肉等组织,由葡萄糖合成糖原的过程。糖原分解是指肝糖原分解为葡萄糖的过程。由于葡萄糖-6-磷酸酶只存在于肝、肾中,而肌肉中缺乏,因此肌糖原不能分解为葡萄糖,只能在肌细胞内进行糖酵解和糖有氧氧化分解,因此只有肝、肾中的糖原可直接补充血糖。糖原合成及降解不是完全相反的两条途径,糖原合成酶是糖原合成的关键酶,糖原磷酸化酶是糖原分解的关键酶,两者通过协调地共价修饰和变构调节来影响糖原代谢途径的方向和速率,从而影响血糖水平。
恶液质与Warburg效应
恶液质患者的糖代谢异常主要表现为葡萄糖的氧化和利用降低,葡萄糖转化增加,胰岛素抵抗和胰岛素分泌相对不足。早在1927年,Warburg等发现肿瘤细胞的糖代谢存在异常:即肿瘤细胞在线粒体氧化磷酸化途径供给ATP不足时,将转而更多依赖糖酵解供能来满足其快速生长的需要。甚至在有氧环境下,肿瘤细胞优先进行糖酵解,并产生大量的乳酸,即所谓的“有氧糖酵解”,亦称之为“Warburg效应”。这是因为肿瘤细胞生长迅速,常需大量葡萄糖分解以提供能量。另一方面,肿瘤细胞繁殖需要大量的ATP以供应其合成RNA和DNA。大多数正常组织在有氧时通过糖的有氧分解获取能量,只有在缺氧时才进行无氧糖酵解。肿瘤组织则不同,大多数肿瘤常存在缺氧的微环境,而有些肿瘤甚至在氧气充足的情况下亦以无氧糖酵解为主获取能量,肿瘤细胞中约50%的ATP来源于糖酵解途径。当时,Warburg等将肿瘤细胞糖酵解活跃的原因归结于肿瘤线粒体呼吸功能的损伤,并认为糖酵解代谢增强是致癌因素,即将肿瘤的发生归因于“生化代谢疾病”。后来随着分子生物学技术的兴起,以及“肿瘤是基因疾病”的观念在学术界得到普遍认可,肿瘤糖酵解的研究进入低谷。1988年,由于正电子发射断层成像(positron emission tomography,PET)技术在临床肿瘤诊断上的成功应用,肿瘤细胞糖代谢这一特异性表型,再度引起人们的高度关注。目前,Warburg效应作为肿瘤的能量代谢标志,已在多种类型的细胞中得到证实。肿瘤细胞的糖酵解能力是正常细胞的20~30倍,糖酵解的增强与肿瘤的生长速度成正比。同时,Warburg效应的活跃程度随细胞类型不同而异,还与肿瘤的侵袭生长密切相关。此外,肿瘤细胞糖异生和磷酸戊糖通路代谢也增强。
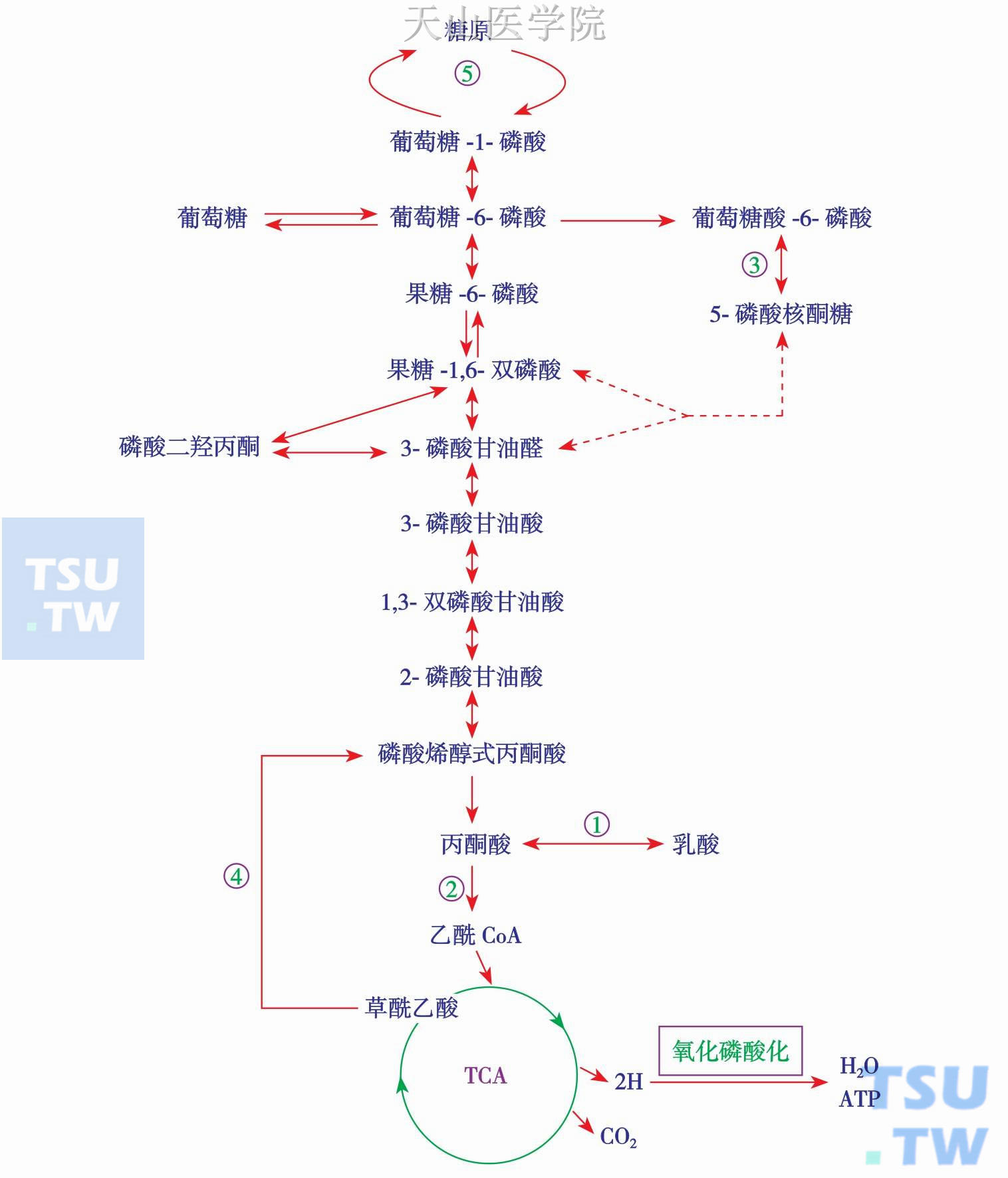
图10-4-1 葡萄糖基本代谢途径
葡萄糖在体内的主要代谢途径包括:①糖酵解;②糖有氧氧化;③磷酸戊糖途径;④糖异生;⑤糖原合成及分解
Warburg效应有利于肿瘤的生长,尽管糖酵解较线粒体氧化磷酸化产能效率低,但恶性肿瘤细胞可从活跃的糖酵解代谢中受益,主要表现在:①糖酵解产生ATP的效率尽管比氧化磷酸化低,但其速度快,更有利于肿瘤细胞的快速增殖,而对于正常细胞来说,缺氧却是致命的。所以尽管肿瘤组织缺氧导致线粒体氧化磷酸化受到抑制,但糖酵解却可代替补充ATP的供给;②肿瘤细胞可通过糖酵解获取中间代谢产物用于代谢的需要;③糖酵解通过影响线粒体外膜通透性使肿瘤细胞获得拮抗细胞凋亡的能力,从而导致恶性肿瘤对放化疗等促凋亡作用耐受;④糖酵解产生大量乳酸,导致微环境酸化,有助于肿瘤侵袭和免疫逃逸;⑤糖酵解还直接促进缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)表达,通过其下游的信号转导途径促进肿瘤细胞增殖、启动肿瘤血管新生、躲避细胞凋亡等,同时HIF-1反过来可直接促进肿瘤细胞糖酵解。肿瘤细胞无限制的增殖是其主要的特征,而细胞增殖需要大量耗氧,肿瘤组织的氧分压明显低于周围组织,这与肿瘤局部扩散、转移和患者病死率相关。
恶液质与糖代谢的酶
除了Warburg效应的作用外,尚存在许多因素导致肿瘤患者糖代谢异常从而发展为恶液质,基因突变或表达异常如原癌基因Ras、myc等的过表达,抑癌基因如P53等突变或活性降低,线粒体DNA突变引起线粒体氧化磷酸化呼吸功能下降等。另外早期致癌因子诱发许多糖代谢的关键酶或载体活性/数量的改变,其中最重要的是己糖激酶Ⅱ(hexokinase,HK-Ⅱ)、ATP枸橼酸裂解酶(ATP citrate lyase,ACL)和丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase,PDK)。它们协同作用使肿瘤细胞以低效率的糖酵解来获取能量,而糖酵解除了直接启动肿瘤细胞对营养物质的摄取为肿瘤细胞提供自主、直接的营养物质外,还可促进HIF-1表达,同时HIF-1 反过来又促进肿瘤细胞糖酵解,进而形成恶性循环。
己糖激酶Ⅱ(HK-Ⅱ)
HK-Ⅱ、线粒体电压依赖阴离子通道(voltage-dependent anion channels,VDAC)和编码HK-Ⅱ基因起中枢作用(图10-4-2)。
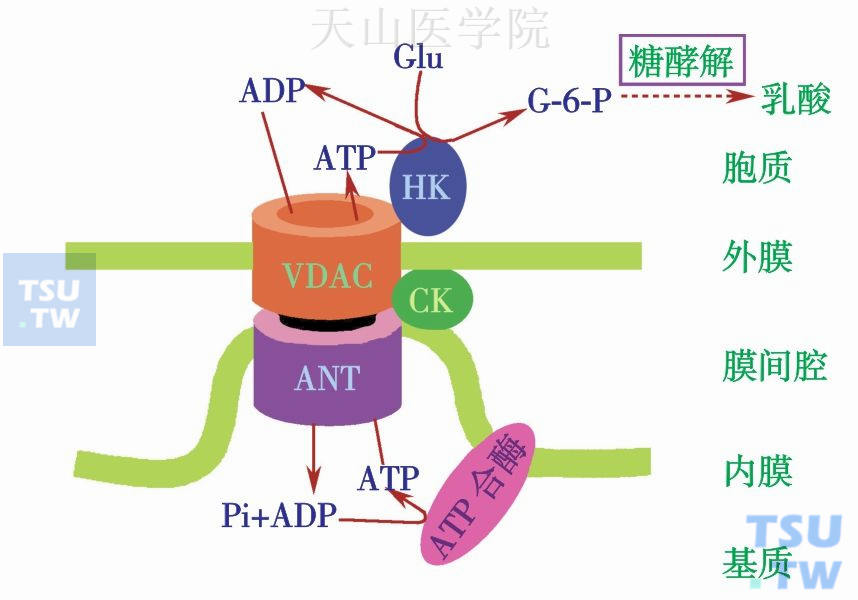
图10-4-2 HK与线粒体VDAC作用模式图
本图说明线粒体通透性转换孔复合物组成,包括VDAC、ANT、HK和CK等,HK与VDAC相互作用使HK-Ⅱ与ATP结合的亲和力提高约5倍,优先获得线粒体释放出的ATP,并且其酶促反应不受葡萄糖-6-磷酸产物的负反馈抑制。VDAC:电压依赖性阴离子通道;ANT:腺苷酸转运蛋白;HK:己糖激酶;CK:肌酸激酶;Glu:葡萄糖;G6P:6-磷酸葡萄糖
HK-Ⅱ是糖酵解途径中的第一个酶,也是肿瘤组织中糖酵解的限速酶。它在肿瘤组织中表达数量及活性的增加,使肿瘤组织在乏氧情况下,仍能保证足够的能量摄入。并且糖酵解的许多中间产物可被肿瘤细胞用来合成蛋白质、核酸和脂类等,为肿瘤细胞本身的生长和增殖提供必需的物质基础。HK-Ⅱ与线粒体结合,并利用线粒体内ATP直接启动糖酵解,可抑制细胞凋亡。肿瘤细胞倾向于优先表达HK-Ⅱ有代谢上的几个理由:HK-Ⅱ较HK-Ⅳ(葡萄糖激酶)有更高的底物亲和力,是后者的100倍,从代谢角度对肿瘤细胞相当有利;HK-Ⅱ的N端的疏水结构域能与线粒体通透性转换孔复合物的VDAC结合,使HK-Ⅱ与ATP结合力提高约5倍,从而赋予了酶促动力学上的多种优势。
丙酮酸激酶(PK)
PK有四种同工酶,分别是PK-L、-R、-M1和-M2,它们的动力学特征、分布及作用是各异的,PK-M2为胚胎型丙酮酸激酶,它是糖酵解途径的关键酶(图10-4-3),有研究表明肿瘤细胞的恶性程度与PK-M2的过度表达密切相关,它在肿瘤细胞转换为有氧酵解中起开关的作用,调节肿瘤细胞的糖酵解流量。肿瘤细胞受生长因子刺激增殖时,磷酸化信号通路可下调PK-M2活性使糖酵解中间物转向用于细胞合成代谢,使肿瘤快速生长,促进恶液质的发生发展。
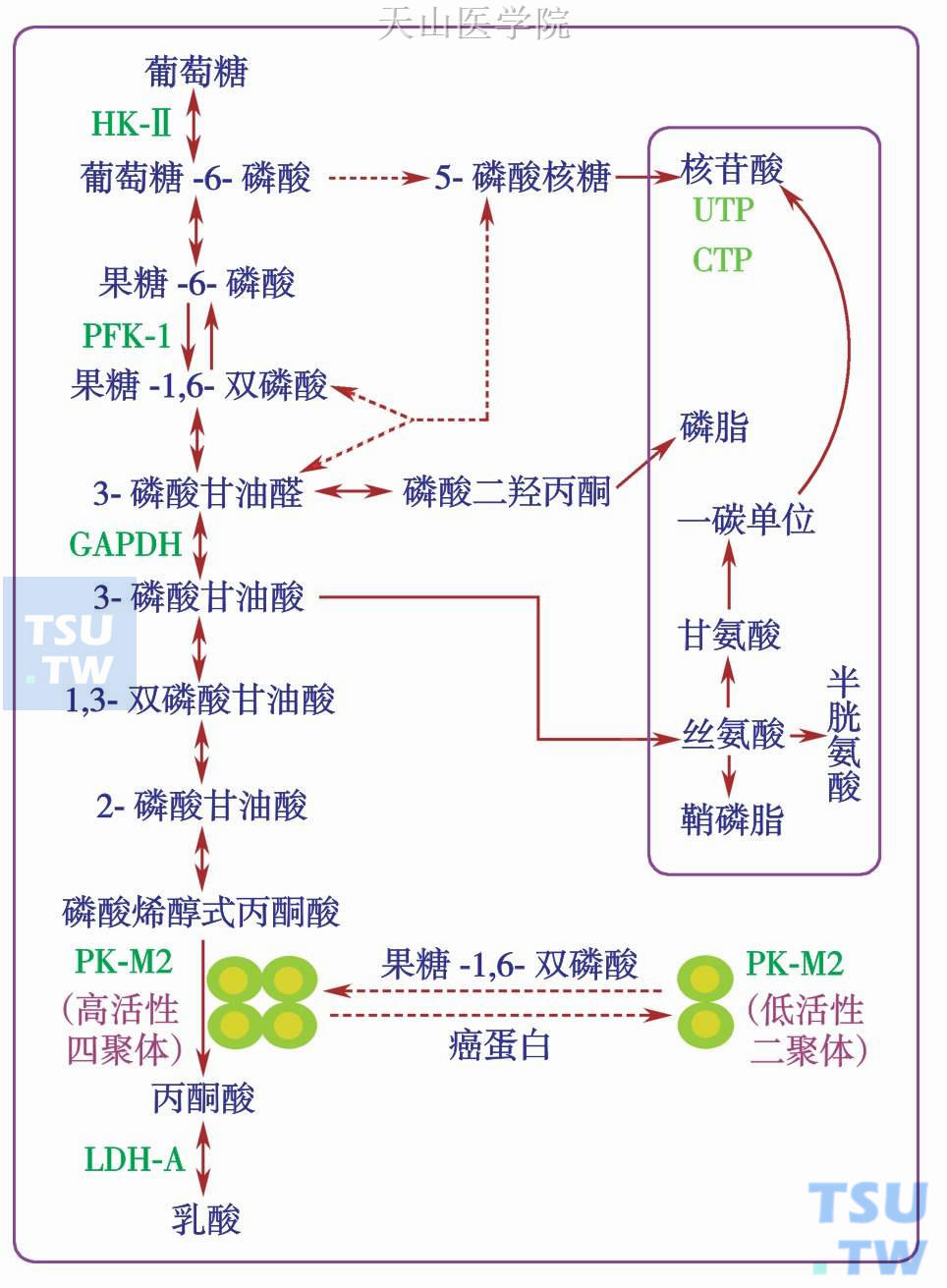
图10-4-3 PK-M2调节糖酵解中间物转向合成代谢
本图说明PK-M2可能在肿瘤细胞转换为有氧酵解中起一个开关的作用,通过PK-M2高活性的四聚体和无活性的二聚体之间转换可调节肿瘤细胞的糖酵解代谢,而二聚体的PK-M2有利于为细胞生物合成提供代谢中间物。这两者可进行周期性转换以满足肿瘤细胞能量及合成代谢的需求。HK:己糖激酶;PFK:磷酸果糖激酶;GAPDH:磷酸甘油醛脱氢酶;PK-M2:丙酮酸激酶胚胎型2;LDH:乳酸脱氢酶;F1,6BP:果糖-1,6-双磷酸
缺氧诱导因子(HIF)
恶液质的发生常伴有肿瘤的无限制生长,肿瘤实体增大,不断增多的细胞数将导致耗氧量增加,造成肿瘤内缺氧微环境的形成。在快速生长的肿瘤细胞中,供氧量不能满足线粒体产生ATP的需求,肿瘤细胞继而通过上调糖酵解来补偿氧化磷酸化产能的不足,逃避缺氧导致的死亡,而HIF在这个过程中至关重要。缺氧诱导因子1-6(HIF-1-6)可诱导产生葡萄糖载体(glucose transporter,GLUT)1、3以及与糖酵解有关的酶,增加肿瘤细胞对葡萄糖的摄取,加速糖酵解,使ATP产生增加,使肿瘤细胞能适应缺氧的微环境。Lu等研究认为,在含氧量正常的情况下,糖酵解的代谢产物,如乳酸盐和丙酮酸盐,能引起HIF-1-6的蓄积,调控缺氧诱导基因的表达,由此建立一个潜在的正反馈通路。
恶液质与能量消耗
归根到底,糖代谢中能量的消耗是恶液质产生的根本,葡萄糖在肿瘤细胞内酵解仅生成2分子ATP和2分子乳酸。乳酸在肝内重新生成1分子葡萄糖时需消耗6分子ATP。因此,每一次循环有4个高能磷酸键的损失,在这种无效循环中浪费了大量的能量。正常情况下,乳酸循环(Cori循环)仅占葡萄糖转化的20%,而在肿瘤恶液质患者中却增加至50%,60%的乳酸再次进入Cori循环。肿瘤患者乳酸水平与肿瘤的转移和复发率呈正相关,与患者生存率呈负相关。乳酸、甘油和生糖氨基酸的糖异生作用增加,是肿瘤患者葡萄糖转化增加的最主要特征,葡萄糖转化增加的量直接受到肿瘤分期、组织类型以及是否存在恶液质等的影响。
恶液质的糖代谢治疗
综上所述,肿瘤患者的能量消耗及缺失较大,如果营养不能及时补充,就有可能出现恶液质。针对恶液质的肿瘤患者进行营养支持时,《2004临床肠内肠外营养操作指南》中明确指出:肿瘤患者营养支持原则为每天摄入总能量25~30kcal/ (kg•d),氮量0.12~0.15g/(kg•d),糖脂比以(1~2)∶1为宜,可选用高脂肪低碳水化合物的配方产品或肿瘤专用型配方产品。如此,既可改变患者的营养状况,又能避免高糖摄入刺激肿瘤生长。此外,许多新的肿瘤治疗研究将目光投向抑制肿瘤的糖代谢,糖代谢途径中的糖酵解关键酶有可能成为治疗研究的新靶点(图10-4-4),通过药物控制肿瘤细胞的无氧代谢有望实现控制肿瘤细胞分裂增殖的治疗目的。
控制葡萄糖供应
由于肿瘤细胞代谢需要摄取大量葡萄糖,降低环境中葡萄糖浓度对肿瘤细胞具有选择性的毒性作用。在低葡萄糖浓度培养条件下,肿瘤细胞都出现快速凋亡。在异体移植肿瘤试验中,通过给予胰岛素短暂减少血流和间质中葡萄糖浓度对于移植瘤具有抑制效果。肿瘤中最常见的GLUT1呈现过表达,通过干扰其活性可抑制肿瘤细胞的糖酵解。
抑制关键酶
在恶性肿瘤中高表达的糖酵解酶如HK-Ⅱ,乳酸脱氢酶(lactic dehydrogenase,LDH),磷酸果糖激酶(phosphofructokinase,PFK)和磷酸甘油醛脱氢酶(phosphoglyceraldehyde dehydrogenase,GAPDH)等均可能作为治疗恶性肿瘤控制恶液质的靶点;例如甲磺酸伊马替尼是特异性BCR-ABL的酪氨酸激酶抑制剂,可降低白血病细胞中HK和6-磷酸葡萄糖脱氢酶的活性,抑制有氧糖酵解,进而完成对肿瘤的治疗。
HK-Ⅱ是目前研究最多的肿瘤细胞糖酵解酶,有研究显示HK-Ⅱ抑制剂对肝移植瘤及肺转移瘤有明显的抑制作用,而对正常组织细胞无损害,其不仅能降低肿瘤细胞ATP水平,还能提高活性氧家族(reactive oxygen species,ROS)和线粒体功能损害而促进细胞死亡。
糖酵解转向有氧氧化
当细胞从糖解获得ATP转向通过线粒体氧化磷酸化获得能量时,可以提高肿瘤细胞对药物的敏感性。例如,通过PDK1抑制剂来激活PDH,促进乳酸转变为丙酮酸而进入线粒体氧化,这对线粒体氧化磷酸化损伤的肿瘤细胞尤为有效(图10-4-5),但对线粒体功能完整的肿瘤细胞的效果有限,要想达到更好的抗肿瘤作用,则需要同时应用线粒体呼吸活性抑制剂。小分子二氯醋酸盐(dichloroacetate,DCA)是一种代谢调节剂,多年来被应用于治疗罕见的代谢紊乱,比较安全。有研究显示它能调节肿瘤细胞糖代谢,逆转肿瘤的线粒体超极化和糖酵解的表型,减缓癌细胞生长,改善恶液质。更重要的是,DCA能杀灭癌细胞(包括非小细胞肺癌(图10-4-6)、乳腺癌、胶质脑细胞瘤、子宫内膜癌、前列腺癌等),却没有明显影响非癌组织,因为这些组织的代谢没有改变。
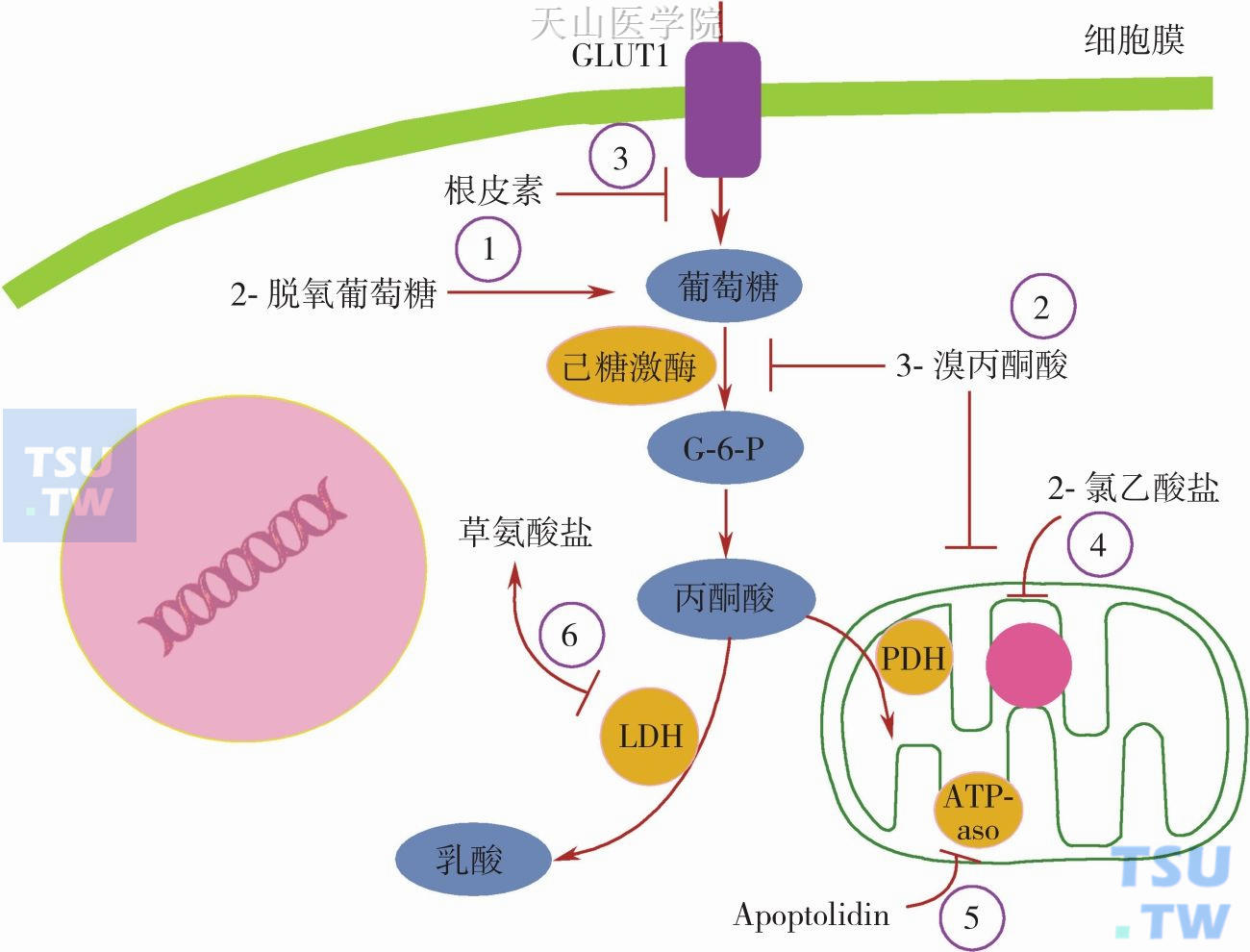
图10-4-4 针对肿瘤Warburg效应的潜在治疗靶点
针对肿瘤Warburg效应目前存在6个潜在的治疗靶点:①2-脱氢葡萄糖(2-deoxyglucose,2-DG)是非代谢的葡萄糖类似物,可降低细胞ATP水平;②3-溴丙酮酸(3-bromopyruvate)可抑制HK活性和离体线粒体呼吸功能;③根皮素(phloretin)是葡萄糖转运载体抑制剂,可显著抑制细胞内ATP水平,增强柔红霉素的抗癌作用;④二氯乙酸盐(DCA)是丙酮酸脱氢酶激酶(PDK)抑制剂,可促进糖酵解转向糖有氧氧化分解;⑤Apoptolidin是线粒体ATP合酶抑制剂,与LDH抑制剂;⑥草氨酸盐合用可明显引起多种恶性肿瘤细胞死亡。G-6-P:葡萄糖-6-磷酸;LDH:乳酸脱氢酶;PDH:丙酮酸脱氢酶;PDK:丙酮酸脱氢酶激酶
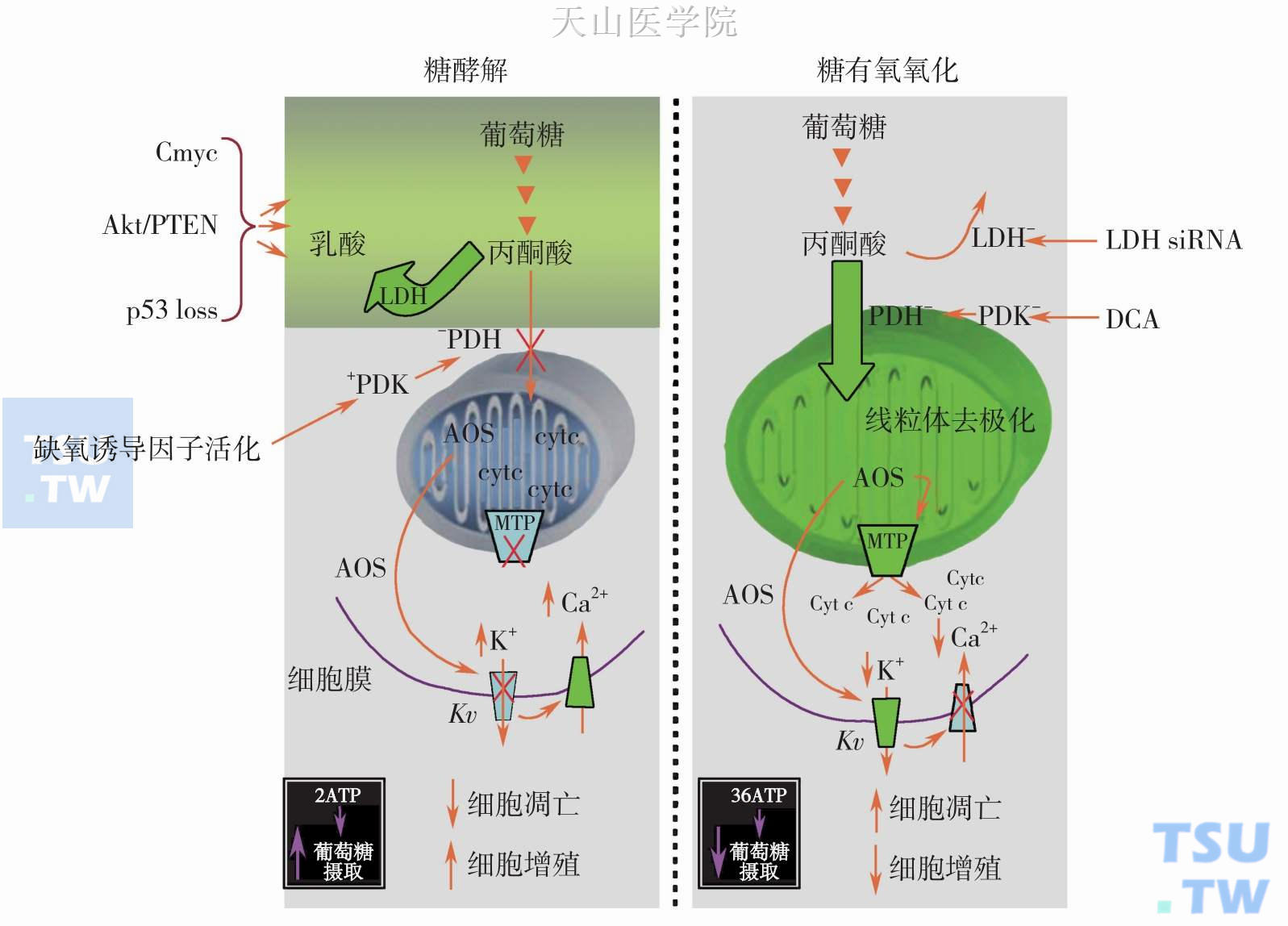
图10-4-5 糖酵解及有氧氧化与抗凋亡及促进增殖状态的关系
本图说明糖酵解环境与抗凋亡及促进增殖状态有关,这是大多数实体瘤的特征。无论通过增加DCA或抑制乳酸脱氢酶活性使丙酮酸进入线粒体,都将促进葡萄糖有氧氧化,从而使细胞凋亡增加,肿瘤增殖及生长减少
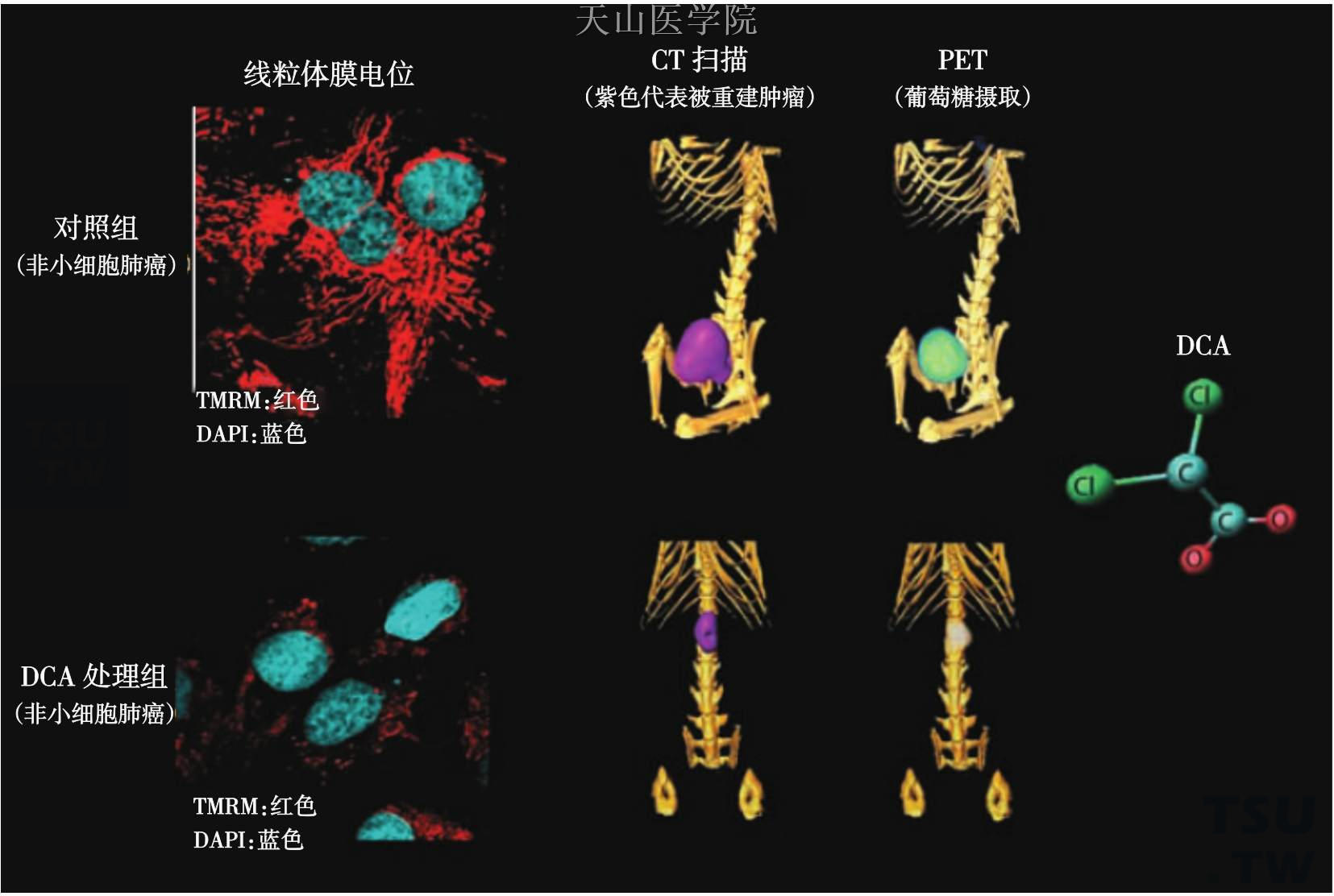
图10-4-6 DCA使线粒体去极化及抑制体内肿瘤的生长
左图表示非小细胞肺癌经DCA治疗前后的四甲基罗丹明(tetramethylrhodamine,TMRM)荧光标记(红色荧光越深代表线粒体膜电位越高,蓝色显示为细胞核)。相同的细胞注射于裸鼠的侧腹。右图为这些裸鼠的PET-CT成像,CT和PET的FDG-葡萄糖摄取成像均显示DCA治疗能减少肿瘤的大小及葡萄糖摄取
长久以来,人们认为癌细胞通过整个细胞获得能量,而不是通过特定的细胞组织线粒体,这种糖原酵解能量效率非常低下,需要消耗大量糖原。该现象可能是由于肿瘤无法为其线粒体获得足够的氧以维持正常工作,为了生存下去,这些细胞便关闭了它们的线粒体,而开始通过糖原酵解获得能量。然而线粒体另一个关键作用是能激活不正常细胞的自我毁灭过程。当细胞将线粒体关闭后,这些细胞就可以“永生”了,由于它们比其他细胞都活得长久,于是渐渐地成为了主宰。DCA能逆转癌细胞的这种独特特性,唤醒癌细胞的线粒体,新激活的线粒体便会使肿瘤细胞的糖酵解过程转变为有氧氧化,从而启动这些非正常细胞的自我毁灭程序,解除肿瘤细胞的凋亡抵抗状态,达到消灭肿瘤的目的(图10-4-5)。还有研究表明DCA具有免疫调节活性,能通过诱导白介素12-干扰素γ通路调节Th-1细胞功能,从而达到治疗肿瘤的目的。目前正在进行DCA对肿瘤的临床试验,应用在人体的正电子发射断层扫描(positron emission tomography,PET)技术监测代谢干预的效果,增强了这种治疗的可行性(图10-4-6)。
总之,利用肿瘤细胞Warburg效应进行抗肿瘤的靶向治疗是一项极具价值的研究,糖酵解过程是正常细胞和恶性肿瘤细胞糖代谢的共同途径,筛选和确定肿瘤细胞特异性表达的糖酵解酶及其功能是解决肿瘤治疗的关键问题。同时,由于肿瘤细胞特异性及微环境的多变性,糖酵解酶表达及活性可能会发生多种变化,因而单一糖酵解的靶向治疗作用相对有限,针对多个糖酵解靶点的联合治疗可能会获得更好的治疗效果。
糖的供给原则
肿瘤恶液质患者的内源性糖生成和糖的氧化等糖代谢出现明显亢进,机体能量代谢的主要功能是利用糖、脂肪等能量底物通过三羧酸循环氧化生成ATP,机体优先利用的能量底物为葡萄糖,恶液质发生时,机体能量需要增加,经口摄入不足导致葡萄糖缺乏时,一般通过脂肪来补充能量,而脂肪在氧化后也进入三羧酸循环产生能量,同时脂肪氧化供能一般仅限于外源性葡萄糖和体内葡萄糖利用能力低下的情形。
糖的供给应基于对各种疾病状态下的底物利用的了解,一般来说,糖的供给为总供给能量减去蛋白质和脂肪的供给量之后剩余的量。在疾病状况下,一般占总供给量的50%~60%,必须了解不同疾病状况供给量各异,包括最低供给量、最高供给量及供应速度。红细胞和中枢神经系统组织,因只能利用葡萄糖作为能量来源,故每天至少供给葡萄糖100~150g。当经口摄入或供给葡萄糖不足时,机体通过糖异生过程合成。一般情况下,葡萄糖供给量的上限为7g/(kg•d),静脉滴注给予上限速度应低于5mg/(kg•min)(表10-4-1)。在葡萄糖耐量正常情况下,若葡萄糖供给量和给予速度在要求上限以下时,高血糖和糖代谢异常的风险还是较低的。
表10-4-1 碳水化合物的适宜供给量

肿瘤患者的能量需要量及能量底物的氧化速度的显著变化已经明确,但到目前为止,有关肿瘤状况下能量需要量较健康时增加、不变、减少的研究结果均有报道,还没有取得共识。其原因可能与患者间的差异如肿瘤类型,进展速度,经口摄入的程度等不同有关。与此相对应的,研究者一致认为其葡萄糖转换率增加,同时乳酸、丙酮酸、甘油来源的糖异生也增加,相对应的糖异生速度也增加。多数研究认为是激活了乳酸和丙酮酸可相互转换及再利用的Cori循环,通过增加的糖异生来满足必需营养底物的供给。
对于肿瘤患者来讲,不仅糖异生增加,其葡萄糖的利用及氧化也是亢进的。糖异生为糖酵解的可逆途径,是机体对能量需要的一种必要反应,用以补充不足的葡萄糖。因此,给予肿瘤患者补充充足的葡萄糖或糖异生利用的乳酸、丙酮酸、甘油等非常必要。
思考题答案
1. 根据2011国际恶液质专家共识提出的具体诊断标准为:(1)无节食条件下,6月内体重下降>5%,或(2) BMI<20(中国人<18.5)和任何程度的体重下降>2%,或(3)四肢骨骼肌量指数(appendicular skeletal muscle index)符合肌肉减少症标准(男性<7.26kg/m2,女性<5.45kg/m2)及任何程度的体重下降>2%。计算患者6个月内体重下降为(68-52)/68=23.5%;且患者BMI=52/1.722=17.57,均符合肿瘤恶液质诊断标准。
2. 从病因分析,该患者因恶性肿瘤本身的代谢紊乱(代谢方面、神经内分泌方面和营养合成方面)导致肿瘤恶液质,因此属于原发性恶液质。因该患者预计生存小于3个月,且对抗肿瘤治疗无效,因此属于恶液质难治期。
3. 糖的供给为总供给能量减去蛋白质和脂肪的供给量之后剩余的量。恶液质时,一般占总供给量的60%~65%,每日供给量为350~450g,至少供给葡萄糖100~150g。一般情况下,葡萄糖供给量的上限为7g/(kg•d),静脉滴注给予上限速度应低于5mg/(kg•min)。
(叶磊光 陈公琰)
