概况
厌食/食欲缺乏(anorexia)是指进食欲望的减退或消失,可同时伴有早饱、味觉和嗅觉改变以及恶心、呕吐、腹胀等相关症状,使患者出现严重的营养摄入不足,也是导致体重丢失的重要原因。在恶液质状态下,患者可能不是单纯的对食物无兴趣,而是对“吃”没有一点欲望。不同于原发性厌食或神经性厌食症,继发性(即疾病相关)厌食是一种相当常见的症状,并经常作为慢性疾病的伴随症状而存在。继发性厌食的发病机制非常复杂,很多因素均参与其中,目前认为厌食发生的主要原因是机体罹患慢性疾病时产生的一些促炎介质如肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素-6((interleukelin-6,IL-6)、瘦素等影响了中枢神经系统中一些神经递质的释放,导致下丘脑对食欲和厌食刺激的正常反应受到干扰、出现功能紊乱。临床上,恶液质患者伴随的厌食症往往因不被重视而漏诊,事实上,如不能用药物或营养素进行及时、合理干预,可导致恶液质患者营养状况极度恶化。
因为厌食是患者对进食欲望是否强烈的一种主观感觉,所以临床上一般是通过询问患者自己来对食欲状况进行评估。这种简单的定性评估,因不同患者的自我感觉差异而对结果判断影响较大。此时,最好同时为患者提供视觉模拟评分表或其他可以量化的问卷调查表,以便得到一个更为客观的评估。在肿瘤患者中,已开发了特定的工具来诊断厌食,主要是基于对食欲缺乏和食欲相关症状做一个全面的评估。最常用的是厌食/恶液质治疗功能评估(Functional Assessment of Anorexia/Cachexia Therapy,FAACT)问卷调查表和北美肿瘤中心治疗组(the North Central Cancer Treatment Group,NCCTG)的厌食/恶液质问卷表。这两种工具都对癌性患者厌食提供了定性和定量评估。FAACT问卷表已被证实可以协助临床医生对抗厌食症/恶液质进行疗效验证。问卷分为五个部分、39个项目,其中12项是直接与营养相关的问题,也包括食欲(表8-2-1)。与FAACT类似,NCCTG厌食/恶液质问卷表包括15个项目,其中10个问题与营养直接相关,其中也包括食欲。类似的调查问卷都可对患者食欲状况进行定性和定量评估。
表8-2-1 FAACT问卷调查表(根据最近7天的身体实际状况进行选择)
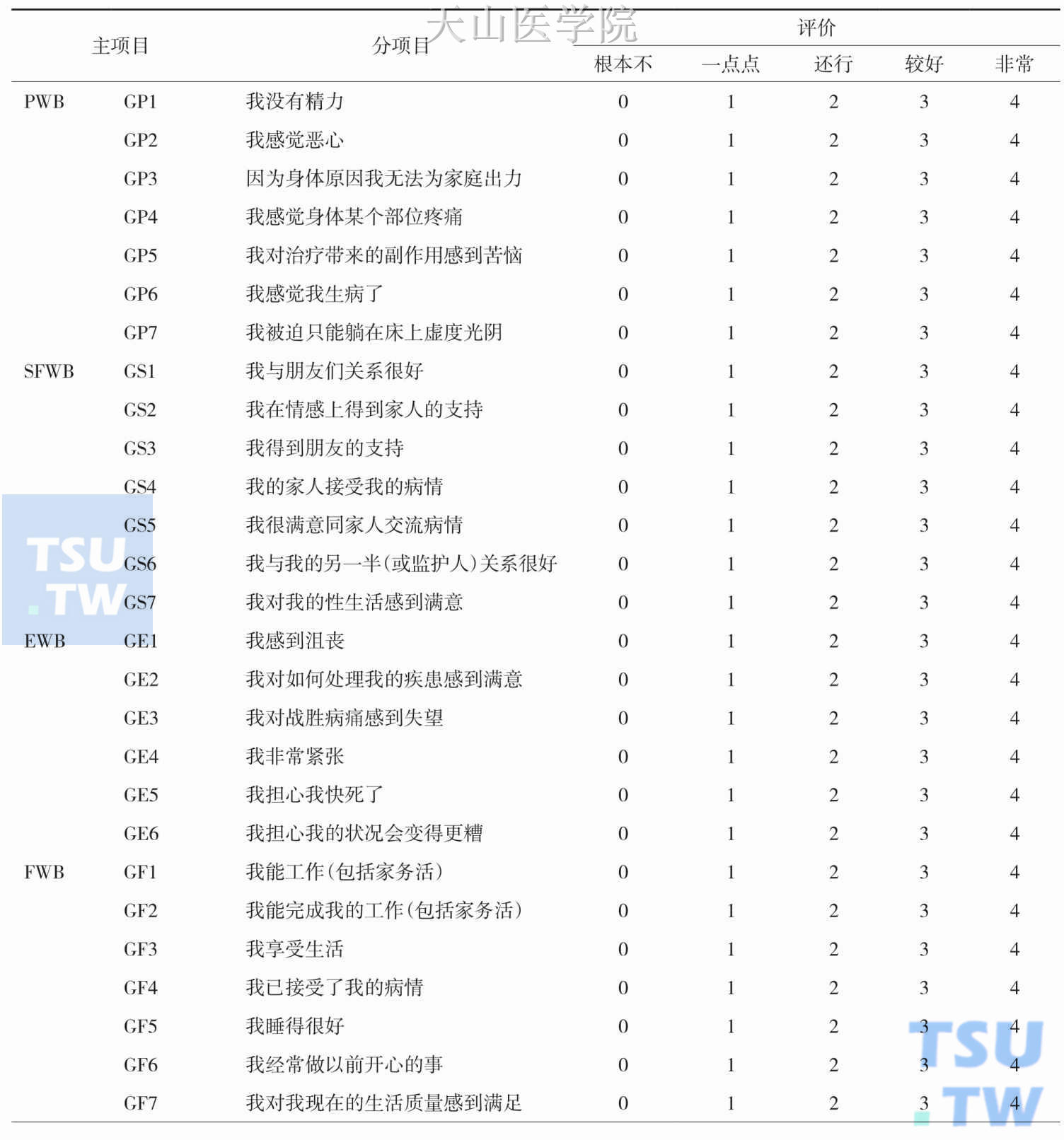
续表
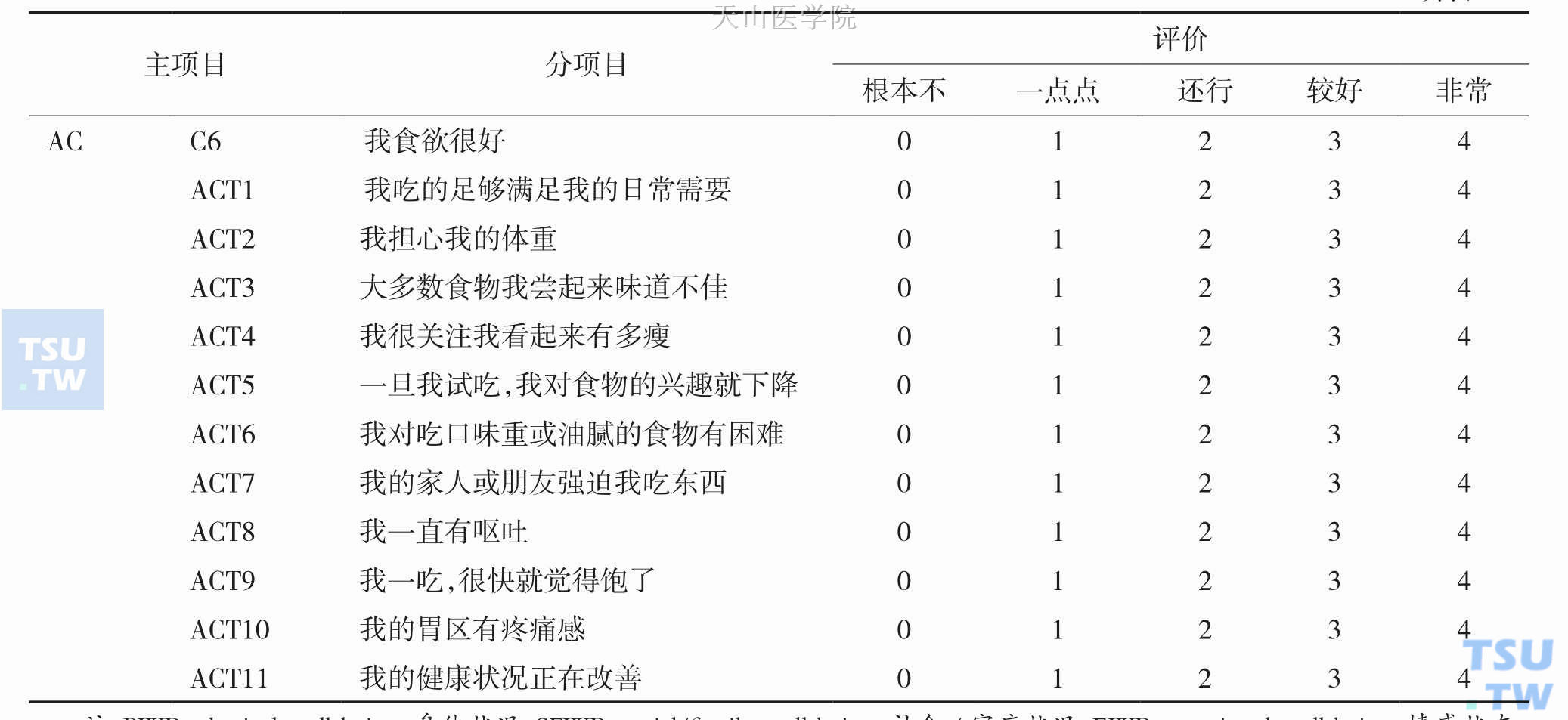
注:PWB:physical well-being,身体状况;SFWB:social/family well-being,社会/家庭状况;EWB:emotional well-being,情感状态;FWB:functional well-being,功能状态;AC:additional concerns,其他关注事项
正常食欲维系机制
哺乳动物已进化了一套复杂的进食调控体系,用来调节食物摄取和维持合适的能量储备。正常食欲的调控和维系涉及多条周围和中枢的信号通路,其中正常的外周食欲控制包括饥-饱循环的四个相。
1. 胃动力相(gastricmotility phase):通过由孤束核和邻近的背核发出的迷走神经信号控制着胃的动力。
2. 后吸收相(postabsorbtive phase):由十二指肠释放的胆囊收缩素介导,后者可与迷走神经胆囊收缩素-a受体结合,通过孤束核减少肠的蠕动功能。
3. 代谢相(metabolic phase):由下丘脑弓状核分泌神经肽Y(neuropeptide-Y,NPY)的神经元调控,并与肝葡萄糖、胰岛素和脂肪细胞释放的瘦素等共同作用。
4. 最后是回肠相(ilealphase):其中包括胰高血糖素样肽-1对胃动力的抑制以及对下丘脑NPY释放的抑制。
中枢性食欲调节依赖于能量摄入和静息能量消耗之间的平衡,而这一平衡由起源于下丘脑弓状核分泌阿片黑素皮质激素原(proopiomelanocortin,POMC)和NPY的神经元共同调控。如出现能量负平衡时,下丘脑弓状核的神经元细胞分泌释放NPY并减少POMC的分泌,前者表达和分泌增多可刺激食欲增加并促使机体降低能量损耗;而后者的作用正好相反。
NPY和POMC主要由瘦素和5-羟色胺调控,甲状腺素释放激素、促肾上腺皮质激素释放激素、催产素、增食欲素/胖素(orexin)和黑素皮质素浓缩激素(melanocortin-concentrating hormone)也有一定的作用。NPY和刺豚鼠基因相关转录因子是两个独立但有协同作用的中枢性刺激食欲的神经递质。而POMC通过与NPY相反的方式影响着食欲。瘦素是由白色脂肪组织分泌的负向NPY的外周调节因子。5-羟色胺通过与突触后的5-羟色胺1b和1c受体结合来抑制NPY神经元的活性而引起早饱感。此外,NPY和POMC共同调节、维持着正常食欲信号和基础代谢率的协调一致。前者可增加副交感神经的活动并降低静息能量消耗,而后者正好相反,POMC增加交感神经活动并提高静息能量消耗。
当然,对能量稳态的维系是一个复杂但控制精密的过程,其影响因素也很多,如食物的优劣、疾病状况、精神因素等都会影响这一正常机制的有效性(图8-2-2)。
厌食相关因素与可能机制
往往是由于控制饮食行为的内在生理机制发生改变导致了疾病相关厌食的出现,当然,抑郁、精神疾患、疼痛、吞咽困难等状况,也可能涉及其中。一些相关的症状如恶心/呕吐、厌油、早饱、味觉和嗅觉的变化等伴随着厌食症的发展过程。
与肿瘤相关的厌食的发生机制是非常复杂的,往往涉及多个因素的共同作用,导致调节食欲的中枢和外周通路协调功能障碍,影响患者食欲。
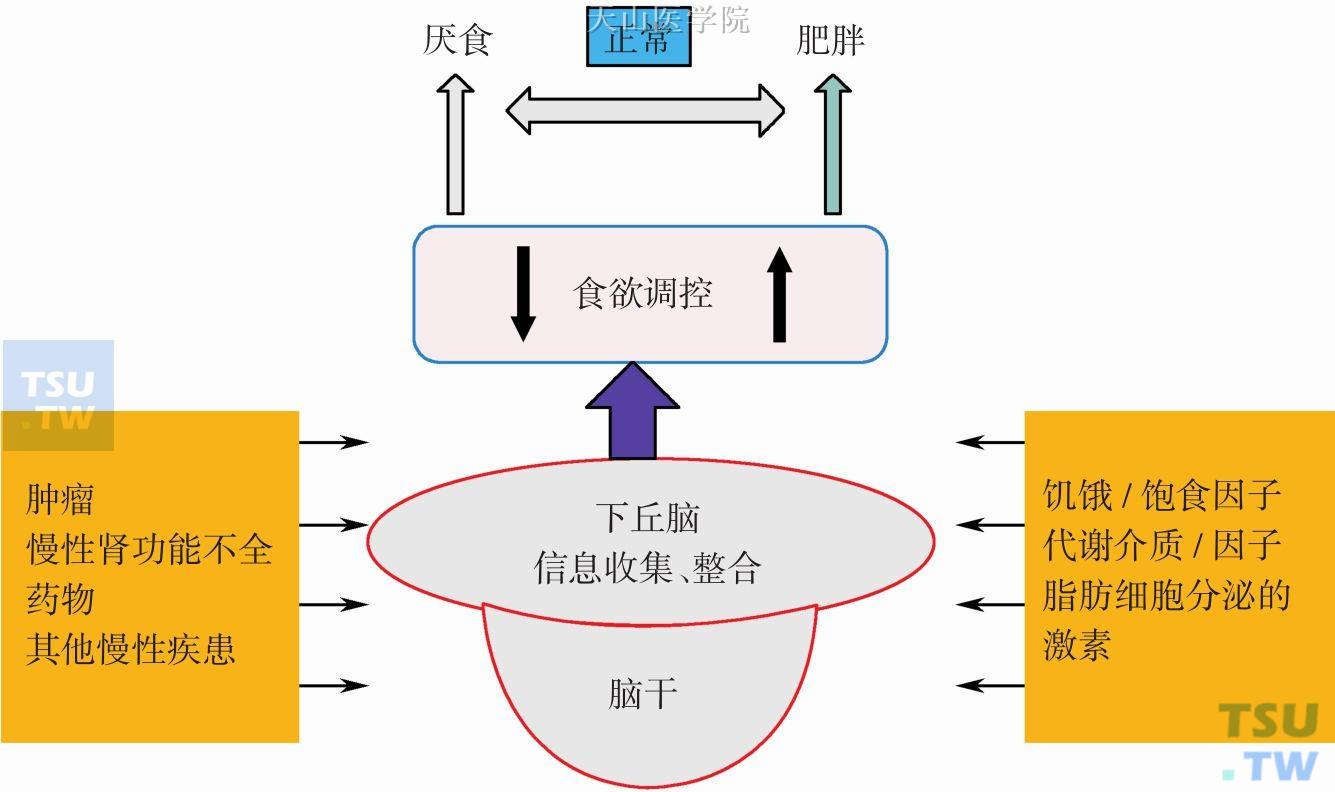
图8-2-2 食欲调节的生理和病理因素
临床相关因素
肿瘤患者,特别是那些消化道肿瘤,可能较常遭受消化道梗阻、疼痛、便秘、消化-吸收不良、身体虚弱或治疗的副作用,如鸦片类药物、放疗或化疗,以及疾病导致的精神抑郁等均可导致食欲缺乏和摄入量下降。此外,部分肿瘤导致的高钙血症,同样也可引起恶心、呕吐以及其他不良的副作用,使患者出现厌食症状。而食欲的好坏和进食的能力通常被认为是影响患者生活质量中最重要的因素之一,所以,食欲缺乏对患者而言,是一种非常糟糕的状态。然而,有研究者在调查了大量的肿瘤和肿瘤恶液质患者后发现,临床上引起进食减少的原因并不都是显而易见的。
细胞因子(cytokines)
肿瘤患者产生厌食症状可能是肿瘤细胞、肿瘤微环境中的其他细胞以及宿主对肿瘤反应后产生的细胞因子进入循环所致,其中某些细胞因子也与恶液质的发生、发展密切相关。
(1) Satietin D:伴随肿瘤患者食欲下降的早饱现象,可能是由于肿瘤产生的一些细胞因子作用于下丘脑中与进食相关的感受细胞导致的。这些可能的因子包括satietins,尤其是satietin D,现已从人血浆中纯化。尽管satietin D在厌食发展过程中扮演的具体角色尚不明确,但将其注入实验大鼠体内后确实可产生持久的食欲抑制效果。
(2) 5-羟色胺(Serotonin):厌食另一个可能的原因,是肿瘤恶液质患者由外周血液进入脑内的色氨酸过多,导致的中枢神经系统内5-羟色胺的活性增加。目前已观察到在进食下降的肿瘤患者中,血浆游离色氨酸浓度的升高与厌食存在明确的相关性。事实上,大脑对色氨酸与支链氨基酸的摄取呈竞争性抑制的关系,所以,也有研究者尝试使用支链氨基酸来降低脑内色氨酸的含量,确实对食欲的恢复有一定的作用。一般而言,体重丢失可强烈刺激机体去主动摄取食物进行补偿,但在肿瘤患者中,这种适应性调节减弱或丧失,使患者的厌食状况持续存在,而这种适应性调节在正常人群中是非常有效的。
(3) 瘦素(leptin):脂肪组织所分泌的一种激素——瘦素,是目前已知的体重识别和调控机制中的重要组成部分。现已发现,体重丢失可引起瘦素水平的降低,且其降低程度与脂肪的丢失量成正比,提示瘦素在饥饿引起的适应性调节中起着重要的作用。中枢神经系统内低水平的瘦素可使下丘脑的食欲信号活动增强从而刺激进食和抑制能量的消耗。在禁食的实验动物模型中发现,促进食欲的大部分信号是上调的,表明这些信号在促进体重恢复中发挥重要的作用。产生于下丘脑的神经肽Y与邻近下丘脑细胞中的受体(Y-5)结合,这反过来又可提高对神经肽Y的敏感性和刺激影响基础食欲的神经元。进一步研究还发现,瘦素也可同Y-5结合,抑制神经肽Y活性并产生早饱感。近来还发现,胰高血糖素样肽1和尿皮质醇也被证明与食欲抑制相关。
(4) 黑素皮质激素(melanocortins):也称黑皮素,属于调节肽家族,这一家族包括促肾上腺皮质激素和促黑素细胞激素,被认为与厌食和恶液质相关。这类肽及其受体在维持机体的记忆、行为、免疫力以及食欲调节和体温维持方面具有重要作用。黑素皮质激素系统在癌性恶液质动物模型体内仍处于活跃状态,而正常情况下机体对体重明显下降的反应应该是下调导致食欲下降的黑素皮质激素信号,以节省能量,延缓体重丢失的进程。此外,阻断黑素皮质素受体可逆转动物的厌食和恶液质状态,进一步说明此系统在恶液质厌食中的作用。
尽管恶液质-厌食综合征与其相关的各种因素的具体作用尚未完全阐明,但大多数学者还是认为,厌食症的产生与那些导致癌性恶液质代谢紊乱的介质也密切相关。单独使用抗厌食症的药物可提高肿瘤患者的生活质量,但不能缓解因厌食导致的相关合并症的发生率和死亡率。因为激素在碳水化合物中间代谢环节中具有重要作用,学者们也对它们在厌食症中的具体作用进行了广泛的研究,如胰岛素、肾上腺素、肾上腺皮质激素、生长激素和胰岛素样生长因子等,均参与了恶液质厌食症的发生、发展过程。在饥饿早期阶段,胰岛素水平下降,胰高血糖素和肾上腺皮质激素水平升高导致环磷酸腺苷和蛋白激酶活化,后两者均可激活激素敏感性脂肪酶,从而动员、利用脂肪储备。而在恶液质患者,这一正常的调控机制受到削弱或失效,所以相对于饥饿状态下的健康志愿者,恶液质患者甘油和游离脂肪酸比例增加相似。
(5) 其他相关因子:在一些肿瘤患者中,肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白细胞介素-1(interleukin-1,IL-1)、白细胞介素-6 (interleukin-6,IL-6)和巨噬细胞抑制因子-1/生长分化因子-15(macrophage inhibitory cytokine-1/growth differentiationfactor 15,MIC-1/GDF15)在血液中水平升高并与肿瘤引起的食欲缺乏有关。α干扰素(interferon α,IFN-α)、γ干扰素(interferon γ,IFN-γ)和白血病抑制因子(leukemia inhibitory factor,LIF)也是被认为与肿瘤恶液质厌食症状相关的细胞因子。尽管还没有证据证实这些因子是诱导恶液质发生的必要条件,但持续、缓慢给予这些细胞因子,无论是单独还是联合,确实能够诱导肿瘤恶液质样厌食症状的出现。这些细胞因子可通过产生和释放瘦素和(或)通过模拟类似瘦素样的负反馈信号来影响下丘脑抑制食欲和摄食,削弱由食物摄入减少和体重丢失触发的进食补偿机制。由此看来,肿瘤患者与那些由单纯饥饿造成的健康人群的体重丢失是截然不同的。
新近的研究发现,在肿瘤动物模型中存在一种酸性肽,这种肽具有降解脂肪的活性,它可导致动物出现一些类似肿瘤恶液质的表现。这一因子可能是一种蛋白多糖,已被证明能从动物的脂肪组织中动员游离脂肪酸、从肌肉组织中动员氨基酸,提示这类肿瘤产物具有动员营养物质给肿瘤组织、促进肿瘤生长的作用。而该蛋白多糖的拮抗剂——二十碳五烯酸,在人类厌食-恶液质综合征的治疗中具有一定疗效。目前仍在对该蛋白多糖是否广泛存在于肿瘤恶液质、及其导致的病理生理改变是否与肿瘤厌食-恶液质综合征的表现类似等进行深入研究。
此外,在肿瘤及其治疗过程中也会出现化学感受器的改变,这种改变对患者的味觉和嗅觉影响显著,即使是以前患者喜欢的食物,此时的感觉也截然不同,使患者丧失对食物的兴趣而影响食欲,加重厌食及疾病的进展。已证明锌在味觉感受中发挥重要的作用,如那些接受放射治疗、尤其是头颈部的放疗患者,可导致味觉的明显减退。锌是味蕾顶孔膜受体的辅助因子,因此,锌含量和利用率的改变会导致这些孔隙的构象发生改变,从而改变此区域对食物刺激的反应,引起味觉降低。低锌状态是否与味觉反应有关一直有争论,尽管对那些接受放疗的患者同时补充锌,并没有完全恢复其味觉,但确实减轻了症状的严重性、部分恢复对味觉刺激的敏感性。
如前面所述,应该是多种相关因子而不是单一的因素介导了厌食-恶液质综合征的代谢和病理生理紊乱。肿瘤细胞产生多种活性肽或糖肽,它们一方面可刺激宿主的免疫细胞产生更多的细胞因子或淋巴因子,另一方面这些肽类物质也可造成由恶性肿瘤引起的代谢应激的激素异常反应。两者结合,共同导致了厌食综合征的发生(图8-2-3)。
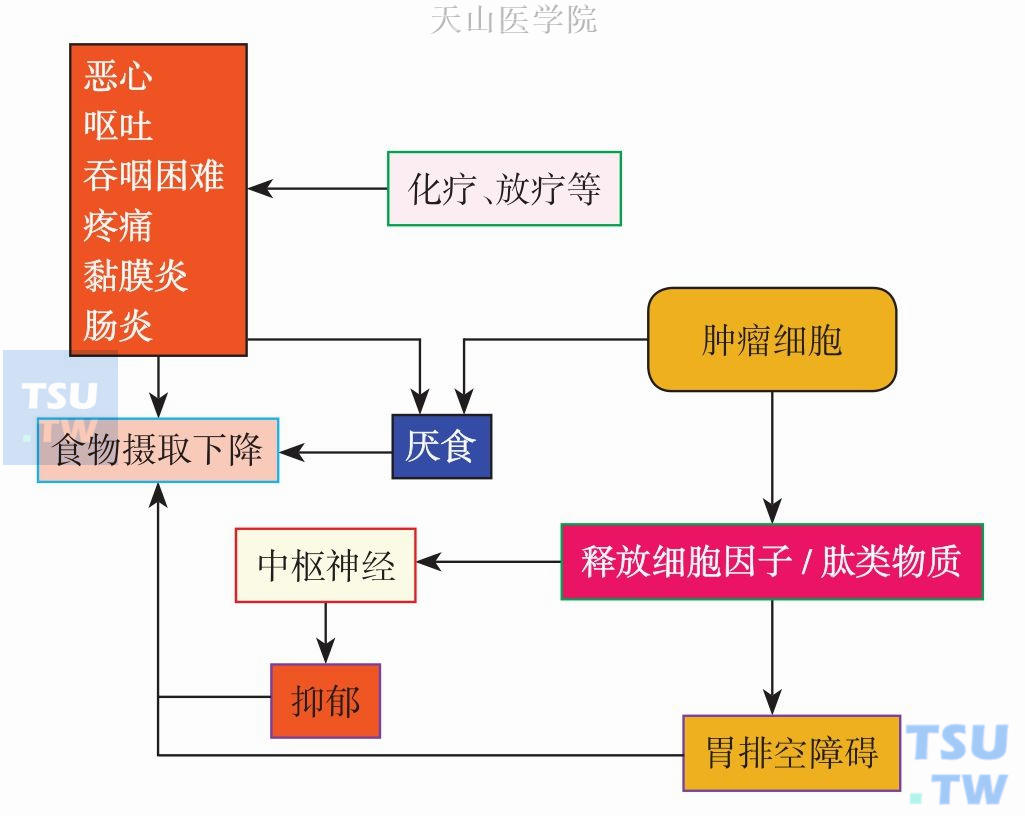
图8-2-3 恶液质时导致厌食/食欲缺乏的机制
