欧洲在恶液质研究领域前后有多部指南发布。包括:ESPEN慢性消耗性疾病厌食恶液质特别兴趣小组(special interest group,SIG)在2010年推出慢性消耗性疾病厌食恶液质及老年营养,肌肉减少症、恶液质及恶液质前期的共识定义,针对定义和诊断问题进行了充分的阐述,尤其是清楚区分了年龄相关肌肉减少症与恶液质的鉴别诊断。同一年,欧洲姑息治疗研究合作组(The European Palliative Care Research Collaborative,EPCRC)推出了恶液质指南,其主要针对晚期患者,合并进展期恶液质或难治性恶液质。指南中充分阐述了恶液质的定义、分期、评价方法、治疗等方面,尤其是比较详尽的介绍了目前恶液质的治疗手段。另外,意大利肿瘤患者筛查工作组(SCRINIO)认为Fearon等在2006年提出的定义及Evans等2008年推出的指南定义均为定性定义,而临床需要操作性强、有具体指标的定义,由于它们不利于临床实践,该组织于2009年提出了一种恶液质定义及分类方法。以下分别阐述三部共识指南。
ESPEN慢性消耗性疾病厌食恶液质特别兴趣小组
该小组在2010年推出慢性消耗性疾病厌食恶液质及老年营养,肌肉减少症、恶液质及恶液质前期的共识定义。
ESPEN慢性消耗性疾病厌食恶液质特别兴趣小组成立于2005年,旨在研究和传播恶液质相关的基础与临床知识,同时提高健康领域专家对恶液质的重视,制定相应的预防及治疗指南。由于缺乏简单通用的关于恶液质的定义,从而导致临床上诊断的失误、延迟,最终致使恶液质不断恶化。因此,该特别兴趣小组首要任务便是确定恶液质的定义、评估和分期。
对于恶液质的定义,特别兴趣小组同意采用恶液质协会(Evans等)制定的共识定义,并提高其临床适用性。此外,该共识强调了炎症在恶液质发生中的作用。由于慢性疾病的一个共同特征就是系统性炎症,促炎因子(TNF-α,IL-1,IL-6,IFN-γ)和抑炎因子(IL-4,IL-12,IL-15)的失衡对恶液质的发生起到重要作用。
该共识强调,鉴别的原因对于恶液质的诊断非常重要,因为恶液质的诊断离不开肌肉丢失,或肌肉减少,而其又不同于其他原因引起的肌肉减少。因此,恶液质共识首先阐述了年龄相关肌肉减少症与恶液质的鉴别诊断。
肌肉减少症诊断标准
肌肉减少症特征为肌肉减少和肌力降低。肌肉占人体蛋白储备的60%,当机体出现代谢应激时,肌肉蛋白分解动员以给免疫系统、肝脏、肠道提供氨基酸,尤其是谷氨酰胺。肌肉丢失时会降低这种蛋白储备,也会导致呼吸功能减退。主要发生在老年人身上,但也出现于失用性肌肉萎缩,营养不良,恶液质患者中(图13-3-1)。
肌肉减少症诊断标准为:
1. 低肌肉量,肌肉量比例低于同性别和种族年轻人群平均值的2个标准差以上。以第三次美国健康及营养调查的18~39岁的数值作为标准参考值。推荐的诊断的T值与骨质疏松症的诊断相近。
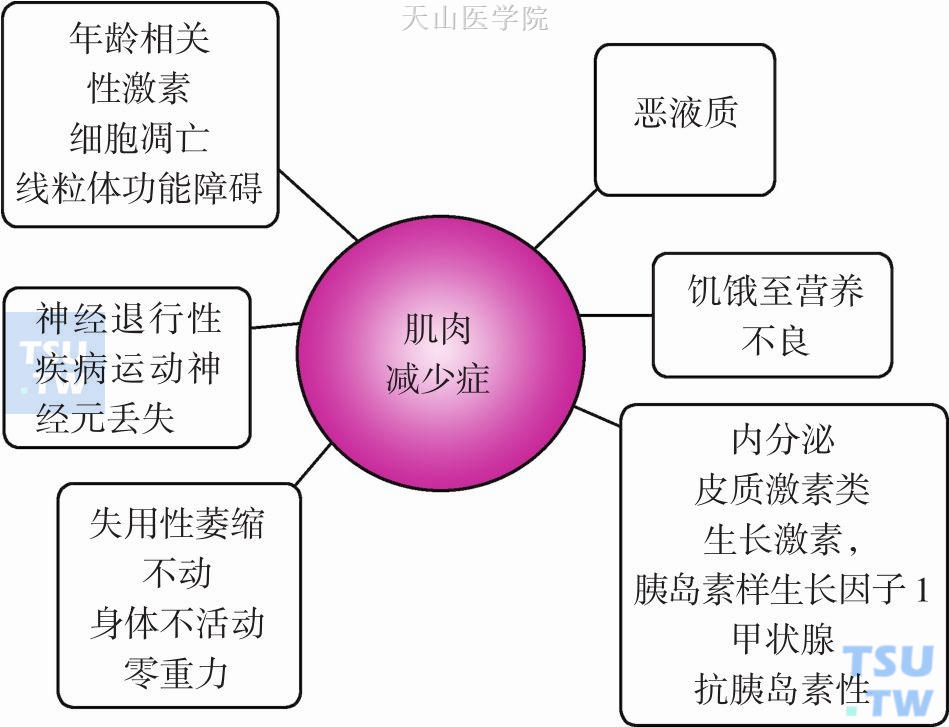
图13-3-1 肌肉减少症发病机制
2. 步行速度降低。4米步行测试低于0.8米/秒。
年龄相关肌肉减少症
与年龄相关的肌肉丢失和肌力下降。其特征包括:肌肉量及横断面积减少,脂肪和连接组织浸润,2型肌纤维体积和数量减少,1型肌纤维内部的原子核的积累,肌丝和Z线的紊乱,脂褐素和杆状体杆结构的累积,运动单位数量的减少等。年龄相关发生的因素有内因和外因之分。内因主要是合成激素(睾酮、雌激素、生长激素、胰岛素样生长因子-1)分泌减少,肌纤维凋亡增加,促炎因子增多,自由基增多导致的氧化应激,肌细胞线粒体功能改变,α运动神经元数量减少。外因包括能量和蛋白摄入不足。此外,维生素D摄入降低与老年人功能状态降低相关。急慢性合并症也参与了肌肉减少症的发生,一方面与活动减少,卧床增加,另一方面促炎因子分泌增多也促发蛋白分解。老年人肌肉减少症有时与恶液质是有重叠的,多种致病因素参与其中,哪种因素起到最主要作用有时很难区分。
营养不良及厌食
营养不良在很大程度上容易被忽视,不能得到及时治疗,等进入到恶液质状态,治疗基本也无作用。因此,针对营养不良迫切需要早期发现及早期干预,而不是对末期的治疗。营养不良与恶液质在临床中经常较难区分。营养不良是由于能量、蛋白质、营养素缺乏或过量导致的体质、功能和临床结局的不良结果的状态。其中,营养素摄入降低同样也在恶液质的发生中发挥着作用。因此,不能将两者混淆。需要注意的是不是所有的营养不良患者都是恶液质,而恶液质患者一定是营养不良的。
另外,恶液质相关厌食症状为继发性厌食(亦即疾病相关),常伴随慢性疾病发生,其不同于神经性厌食。主要发生机制是炎症导致下丘脑食欲调节中枢功能紊乱。厌食及摄入降低如果不予以药物或营养干预,往往导致恶液质的进展。肿瘤恶液质相关厌食的诊断主要依据主观症状判断。目前,已研发多种诊断问卷工具,如FAACT厌食恶液质问卷和NCCTG厌食恶液质问卷。其中,FAACT问卷已被证实可以有效地诊断厌食。
恶液质分期
该特别兴趣小组在共识中详述了恶液质分期的必要性:①目前所有的治疗手段对晚期恶液质均无效;②提高对可能发展为恶液质的状态的认识;③分期有利于恶液质早期指标的确定;④共识一致认为恶液质的预防比治疗更重要;⑤早期和晚期恶液质没有线性时间关系;⑥分期可支持治疗时机及多模式治疗的选择。另一方面,特别兴趣小组认为分期过多会混淆临床诊断、增加诊断难度,因此建议分为恶液质前期和恶液质期。
其中,恶液质前期的诊断为:慢性疾病,过去6个月内非自主体重丢失小于平时体重5%,伴随慢性或常发的系统性炎症,厌食或厌食相关症状。系统性炎症的认定指血浆CRP水平的升高。厌食可以通过特异性问卷或营养摄入量降低小于需求量的70%确定。除此之外,恶液质前期还可能出现早期代谢改变,如糖耐量受损(口服糖耐量试验)、炎症相关贫血或低蛋白血症等。
此外,该共识首次提出肥胖人群的恶液质诊断问题。肥胖人群如何诊断恶液质前期?肥胖肿瘤患者表现为超重,同时伴随非自主体重丢失及系统性炎症。肥胖患者定义为高BMI指数,瘦体组织丢失及功能下降。强调瘦体组织的测量及体重的变化为诊断要点。
恶液质的表型
恶液质导致患者体成分改变,最为显著的标志就是体重丢失,主要是由于瘦体组织和脂肪组织的丢失。但在进展期恶液质,由于低蛋白血症等原因导致的水潴留常导致患者体重未下降,而掩藏了体质的丢失。
另外,不管什么原因导致的恶液质,骨骼肌丢失被认为是恶液质最重要、临床相关性最强的表型。骨骼肌丢失导致肌力下降、呼吸功能下降、体力状态下降、生活质量下降。肌肉丢失是由肌肉蛋白分解加速引起肌肉合成与分解代谢失衡导致的。系统性炎症参与这一过程,另外激素、肿瘤分泌的蛋白诱导因子、卧床、摄入不足均参与其中。然而,肌肉丢失并不是恶液质特异性症状,也见于年龄相关肌肉减少症、饥饿、营养不良、卧床、体力活动减少、失重等情况。因此如前所述,区分恶液质肌肉丢失与其他情况导致的肌肉丢失非常重要,尤其是年龄相关肌肉减少症。
肌肉丢失是恶液质的最主要的特征,然而并不总是恶液质。没有体重丢失,没有厌食,没有可检测到的炎症反应可能是肌肉减少症,但不是恶液质。此外,急性炎症应激、老年、低级别的炎症反应或胰岛素抵抗可能会促发肌肉减少,但不能诊断为恶液质。老年相关的肌肉减少症可以通过阻力训练及药物和营养支持得以改善,而恶液质进展期却难以纠正。
目前的恶液质分期,分出了恶液质前期,但需要进一步的研究,包括队列研究,以及设计干预的临床试验研究。特别兴趣小组下一步的目标是制定预防、诊断和治疗恶液质及肌肉减少症的指南。
欧洲姑息治疗研究合作组推出恶液质指南
欧洲姑息治疗研究合作组(EPCRC)于2010年推出恶液质指南主要针对晚期患者,合并进展期恶液质,或难治性恶液质。该指南是在英国国立卫生及临床优化机构关于指南制定的标准进行制定的,证据级别采用2005版GRADE分级方法,共识采用德菲法(Delphi)进行。指南中针对恶液质的治疗叙述比较详尽。
恶液质的定义
EPCRC采用恶液质国际共识(Fearon等 2011)的定义:以持续性骨骼肌丢失(伴有或不伴有脂肪组织丢失)为特征,不能被常规营养支持完全缓解,逐步导致功能损害的多因素综合征。病理生理学特征表现为低摄入量及代谢异常导致的蛋白及能量负平衡。
肿瘤恶液质的代谢改变
肿瘤恶液质的代谢改变包括:静息能量消耗增加,由肿瘤或机体分泌的促进脂肪分解因子导致脂肪组织丢失,蛋白合成下降及降解加速导致的骨骼肌丢失。其中,蛋白降解途径包括:泛素蛋白酶途径和溶酶体途径的亢进。肿瘤分泌的蛋白降解诱导因子,机体分泌的促炎因子,血管紧张素Ⅱ,和糖皮质激素的增多都导致分解代谢状态增强。
该指南明确提出,恶液质是炎症反应的结果,通过炎症因子介导,下丘脑参与,通过神经递质影响食欲和代谢。
肿瘤恶液质的分期
该指南采用恶液质国际共识(Fearon等 2011)的分期标准,根据患者的临床特征和情况来分期。恶液质难治期诊断标准:符合恶液质定义标准,生存期预计小于3个月,PS评分3或4分,对抗癌治疗无反应,持续分解状态,对营养支持无效。
除恶液质分期外,评估消耗的严重性也非常重要。其严重性取决于体重丢失速度,以及能量储存及体蛋白量消耗程度(低的初始储备也相关)。例如:4周内丢失5kg体重较8周内丢失5kg体重更加严重。另外,同样的BMI和丢失程度,伴有肌肉丢失出现的较肌肉蛋白群正常的风险要大。
这与欧洲肠外肠内营养学会特别兴趣小组(SIG)提出的分期类似,分为恶液质前期和恶液质期,但未分出恶液质难治期。
预后的评价
该指南主要针对晚期肿瘤患者,因此建议对预后作评价,要考虑到肿瘤姑息治疗的恶液质患者往往都处于恶液质难治期,要考虑此种状态下的恶液质治疗策略。
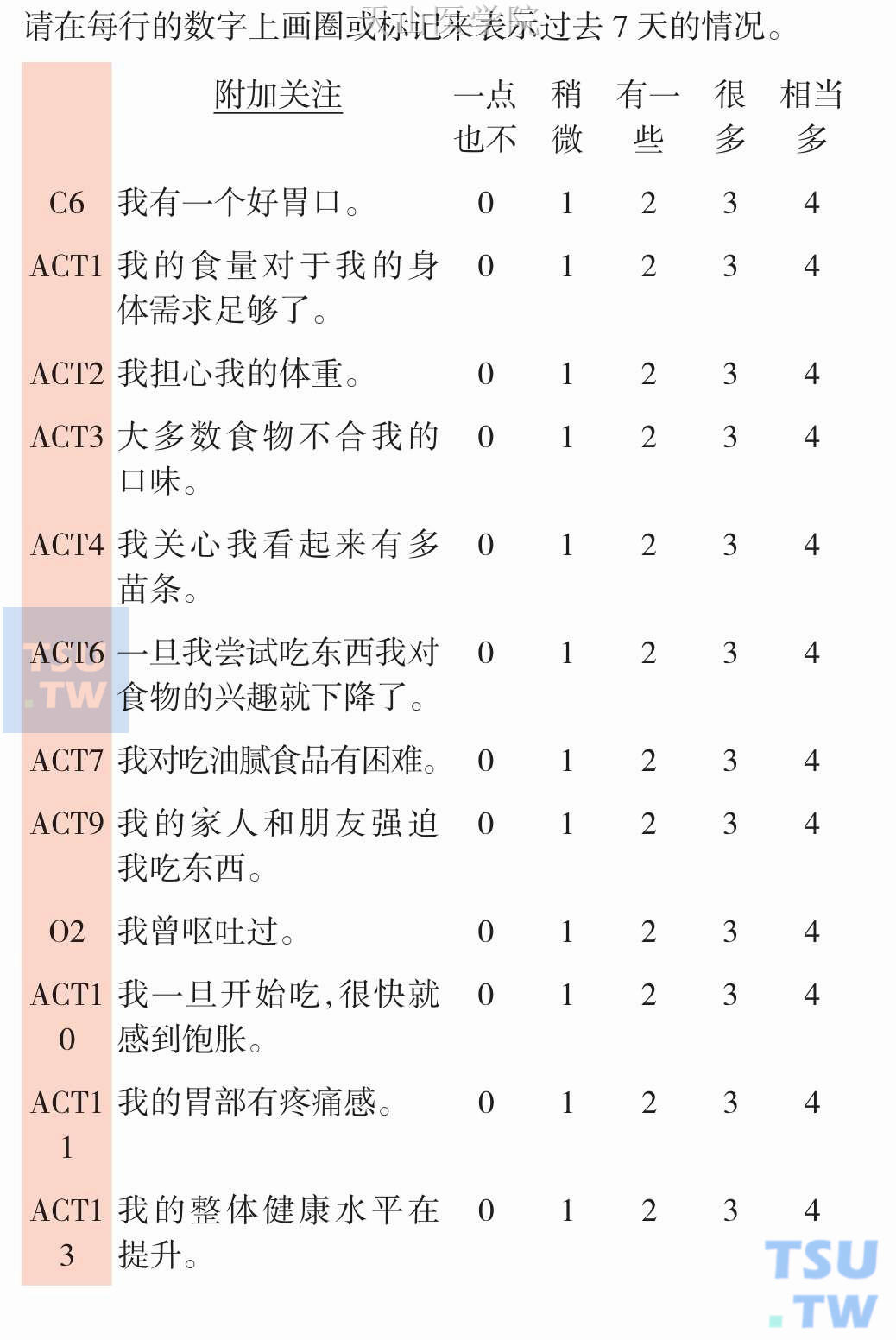
治疗前要进行一系列评估:包括主观症状,既往史,临床查体,实验室检查,活动能力,体成分。推荐应用SIPP问卷推荐作为评估工具(表13-3-1)。其中,主观症状的评估也可通过厌食恶液质治疗功能评估FAACT问卷进行(表13-3-2),包括15个问题,其中10个是营养问题,包括食欲。患者主观整体评估(Patient-Generated Subjective Global Assessment,PG-SGA)和微型营养评定(mini nutritional assessment,MNA)也被用来对患者进行自我评估。
表13-3-1 SIPP问卷
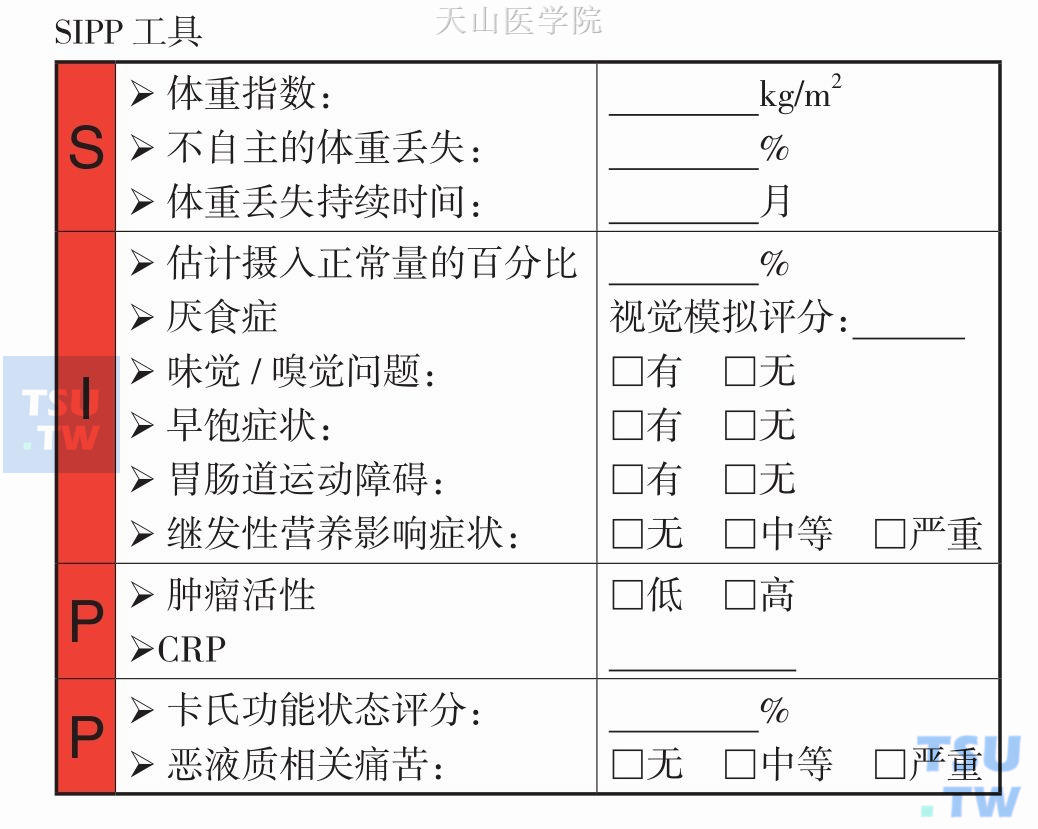
表13-3-2 恶液质治疗功能评价FAACT问卷(第4版)
难治性恶液质的治疗手段
该指南强调对于晚期肿瘤合并的难治性恶液质,应该关注患者的生活质量,治疗目的以减轻患者症状为主,而不是阻止或逆转体重丢失。建议多同患者及亲属沟通,重视患者的社会心理问题,了解患者的诉求、问题及关心的事情,考虑让患者了解病情的深度和参与治疗决策的意愿。更为重要的是,对于晚期肿瘤合并的难治性恶液质,建议必要时咨询或联合多学科的专家综合治疗,如姑息治疗专家、营养学家、心理学家、护理师等。
该指南系统阐述了营养治疗在恶液质治疗中的应用证据,证据来源主要为已发表的指南和重要文献。
1. 肠内营养的应用证据
肠内营养指为特殊医学用途设计的食品的应用,途径包括经鼻胃管、经鼻肠管和经皮胃管或肠管,以及口服补充营养素。
以下三种情况建议给予肠内营养支持从而提高或维持营养状况:摄入不足导致的体重丢失;预计7天不能进食;超过10天进食量降低不足60%。另外,对于无法治愈的患者,只要患者同意,并且未进入濒死阶段,建议给予肠内营养支持以减轻体重丢失。但是当存在系统性炎症时,单纯通过肠内营养恢复体细胞群非常难。
Strasser报道表示:对于晚期患者的支持需要考虑伦理问题,包括自主性(患者自主决定是否接受医疗的权利),益处(是否能给患者带来大的益处),兼顾公平(所需要的资源对于所获得的益处是值得的)后首选肠内营养支持,但也应注意副作用,包括:误吸、肺炎、瘘、腹泻、梗阻、肠管堵塞、喂养管移位、呕吐、吸收不良、电解质紊乱、高血糖和感染等。
美国癌症协会知情选择指导中指出对于大多数进展期肿瘤患者需要调整饮食模式以适应营养需求,同时可以有效控制症状及副作用。对于患者不能摄入足够固体食物满足营养需求时,建议补充营养剂。
总体推荐:肠内营养支持对部分选择性患者是有效的。对于难治性恶液质阶段,在不增加进食相关不适的情况下,可给予肠内营养支持。
2. 肠外营养支持证据
ESPEN指南推荐肠外营养应用于预计生存期超过2个月、肠功能衰竭不能进食的患者。然而,美国医师协会(1989)指出肠外营养与损害相关,肿瘤患者不能够从肠外营养获益。
Bosaeus(2008)详细说明肠外营养不仅不会带来生存获益,反而常导致并发症,尤其会增加感染并发症。对于进展期肿瘤患者,单纯营养支持不能带来生存获益,但当联合抗感染治疗及针对代谢异常治疗时,可能会有阳性结果。
Torelli(1999)报道对于生存期较短患者给予肠外营养支持,不管是支持治疗或是接受积极抗肿瘤治疗,都不能改善生活质量或生存期。
Strasser(2003)报道中指出,对于进展期恶液质伴有进食障碍的患者,给予肠外营养,可能导致并发症的增加,包括:感染、导管相关并发症、容量、电解质、糖代谢紊乱,而且还会增加治疗费用。仅小部分患者可能存在应用指征,包括:不能进食及进行肠内营养,体力评分较好,生存期预计大于3个月,对治疗的作用和副作用充分了解,对自己的生存期有确切的认识。
美国癌症协会指出对于知情选择肠外营养的应用要注重个体化及对可能的并发症风险要充分认识。美国肠外肠内营养学会及美国营养学会均提示肠外营养的应用要有选择性及警示性。
总体推荐:针对进展期肿瘤患者,肠外营养在极少数情况下需要应用,大部分情况不推荐使用,特别是对于难治性恶液质,肠外营养所带来的副作用往往大于益处。
3. 维生素和矿物质的应用证据
对于维生素和矿物质的应用目前没有充分的证据做推荐。但对于不能充分摄入每日所需维生素及矿物质的患者,可以进行补充以维持平衡。
4. 非药物治疗应用证据
目前,已有证据表明非药物治疗对于肿瘤恶液质的治疗是有效的。
5. 营养咨询和教育的应用证据
接受抗肿瘤治疗的患者同时接受营养咨询有益于营养状态及生活质量的提升。此外,尚无证据支持或反对进展期肿瘤患者进行营养咨询及教育的益处。
6. 心理干预的应用证据
有证据表明心理干预(放松治疗)可提高生活质量,但其是否影响营养状态尚没有证据。
7. 体力锻炼及其他体力治疗的应用证据
体力锻炼及其他体力治疗对于肿瘤患者保持体力状态有效,但主要针对治愈目的的患者,对于进展期肿瘤、难治期恶液质没有研究证明有效性。
8. 药物治疗的应用证据
(1) 沙利度胺:没有足够证据证明沙利度胺或细胞因子拮抗剂的益处。
(2) 屈大麻酚:没有足够证据支持应用。
(3) ω-3脂肪酸:对于进展期肿瘤难治期恶液质患者,ω-3脂肪酸的益处没有足够证据达成共识。但达到一定有效血浓度的患者,可能有效。更多的研究应该关注顺应性及参与复合方案中的效果。
(4) 甲地孕酮及甲羟孕酮:可刺激食欲及增加体重,但不增加瘦体组织。对于进展期恶液质可应用甲地孕酮改善食欲、减轻症状。
(5) 甾体激素:对于难治期恶液质,甾体激素可改善食欲及提高生活质量。但推荐疗程小于2周,长期应用可能增加副作用发生和降低肌力。
(6) 非甾体抗炎药:单独应用有较小益处,联合用药时效果更佳,但不推荐对于难治期恶液质患者使用。
(7) 促动力药:推荐对于早饱、恶心、消化不良和胃轻瘫患者应用,但不能改善进展期肿瘤、难治期恶液质患者的营养状况。
治疗恶液质的最佳方法是治愈肿瘤。然而,对于持续进展患者,需慎重考虑是否采用姑息抗肿瘤治疗药,不推荐为减轻恶液质而进行抗肿瘤治疗。
相对于上述多种单一治疗方法,采用联合营养支持、药物治疗、非药物治疗等的多模式联合治疗方案更加有效。对于有体重丢失风险的患者,应当及时进行预防性干预,包括营养咨询和体力训练等,这些措施可有效延缓或预防厌食恶液质综合征的发生。
意大利肿瘤患者筛查工作组恶液质指南
意大利肿瘤患者筛查工作组(SCRINIO)认为Fearon等在2006年提出的定义及Evans等专家2008年推出的指南定义,均为定性定义,而临床需要操作性强、有具体指标的定义。由于它们不利于临床实践,因此该组织于2009年提出一种恶液质定义及分类方法。
该指南建议对恶液质的分期依据为:根据体重下降程度及是否有症状对肿瘤患者进行分类,从而能够对不同临床表现、体力状态及营养风险的患者进行分类(图13-3-2)。
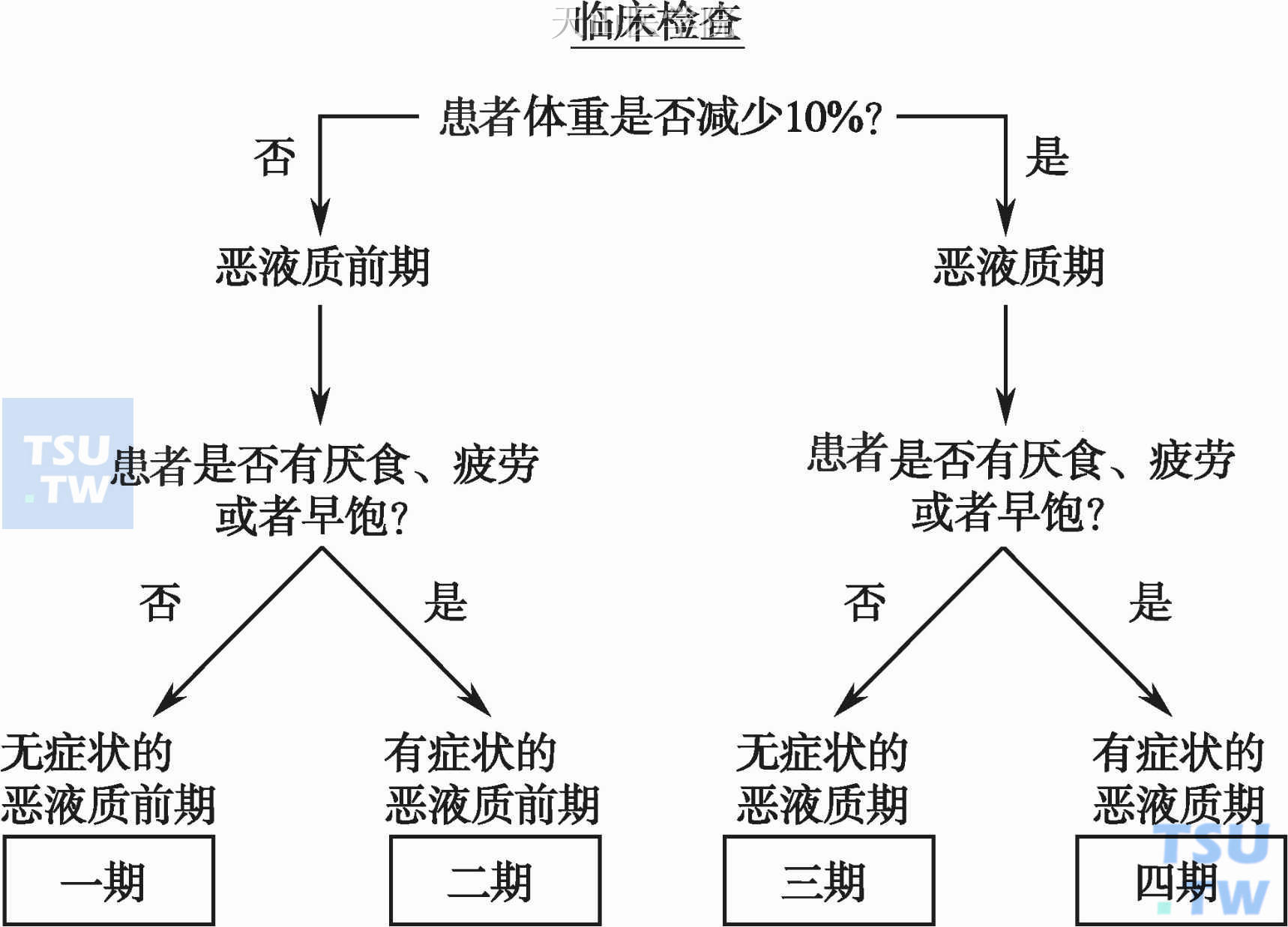
图13-3-2 意大利肿瘤患者筛查工作组恶液质分期
恶液质该分期标准包含了厌食及乏力,理由是这两个症状是肿瘤恶液质最常发生,最具有特征性的症状,其发生与促炎因子诱发的代谢改变有关,直接与患者的生活质量相关。此外,早饱也包括在症状内,其预示着胃肠功能降低,可能与IL-1对下丘脑的作用有关。分期不但利于预后判断,也有利于指导营养干预手段。无症状恶液质前期,根据临床情况,从简单的随访到积极的营养支持均可实施。对于大部分恶液质前期患者,通过膳食指导、口服补充营养素即可达到较好的临床效果。然而,对于恶液质期的治疗不乐观,肠外营养亦无明确效果。
