恶液质的发生是多因素的,免疫、代谢、内分泌和神经递质之间形成复杂的关系。炎症被认为是恶液质发生最主要的原因——前炎症细胞因子,例如IL-1β、TNF-α和白血病抑制因子(LIF)的水平被发现在肿瘤恶液质状态均有所增高,并与肿瘤的进展呈正相关。这些前炎症细胞因子,由外周免疫细胞对感染、肿瘤和组织破坏起反应产生,并通过旁分泌或内分泌作用于靶细胞。体外实验发现,前炎症细胞因子可直接作用于骨骼肌和脂肪组织来促进分解代谢。除此以外,前炎症细胞因子对代谢的影响,很大程度上与中枢神经系统的细胞因子信号通路有关。
在中枢,下丘脑及脑干多组神经元表达神经内分泌肽参加对进食和代谢的调控。在恶液质的发生过程中,这些神经元受到异常量细胞因子的作用,而使下丘脑对机体的能量消耗状况负反馈敏感性的下降,引起能量调节失衡,最终导致食欲下降、进食量减少、肌肉及脂肪量减少、体重下降的恶液质状态。
NPY与恶液质
研究证实在食欲下降的肿瘤负荷大鼠身上,NPY系统失去其促进食欲的功能。与对照组相比,在由甲基胆蒽诱发肉瘤的大鼠下丘脑内注射NPY刺激进食的效能大大地降低了,这种情况在实验大鼠发生食欲下降前就能观察到,在发生食欲下降之后,两组的差距则更明显了。肿瘤负荷时,下丘脑NPY受体的亲和力下降以及由NPY引起的腺苷酸环化酶活性增强提示突触后NPY信号通路在肿瘤负荷大鼠下丘脑中发生了改变。肿瘤负荷小鼠下丘脑合成的NPY水平较对照组相同体重的正常饥饿小鼠显著性降低。在健康大鼠脑室内注射IL-1β,浓度与恶液质肿瘤负荷大鼠脑脊液内IL-1β浓度相同,可以拮抗NPY所诱导的进食行为。IL-1β可特异性地降低下丘脑NPY mRNA水平。而NPY也可以拮抗IL-1β所引起的食欲下降。由此说明,细胞因子与神经内分泌肽之间互相影响。
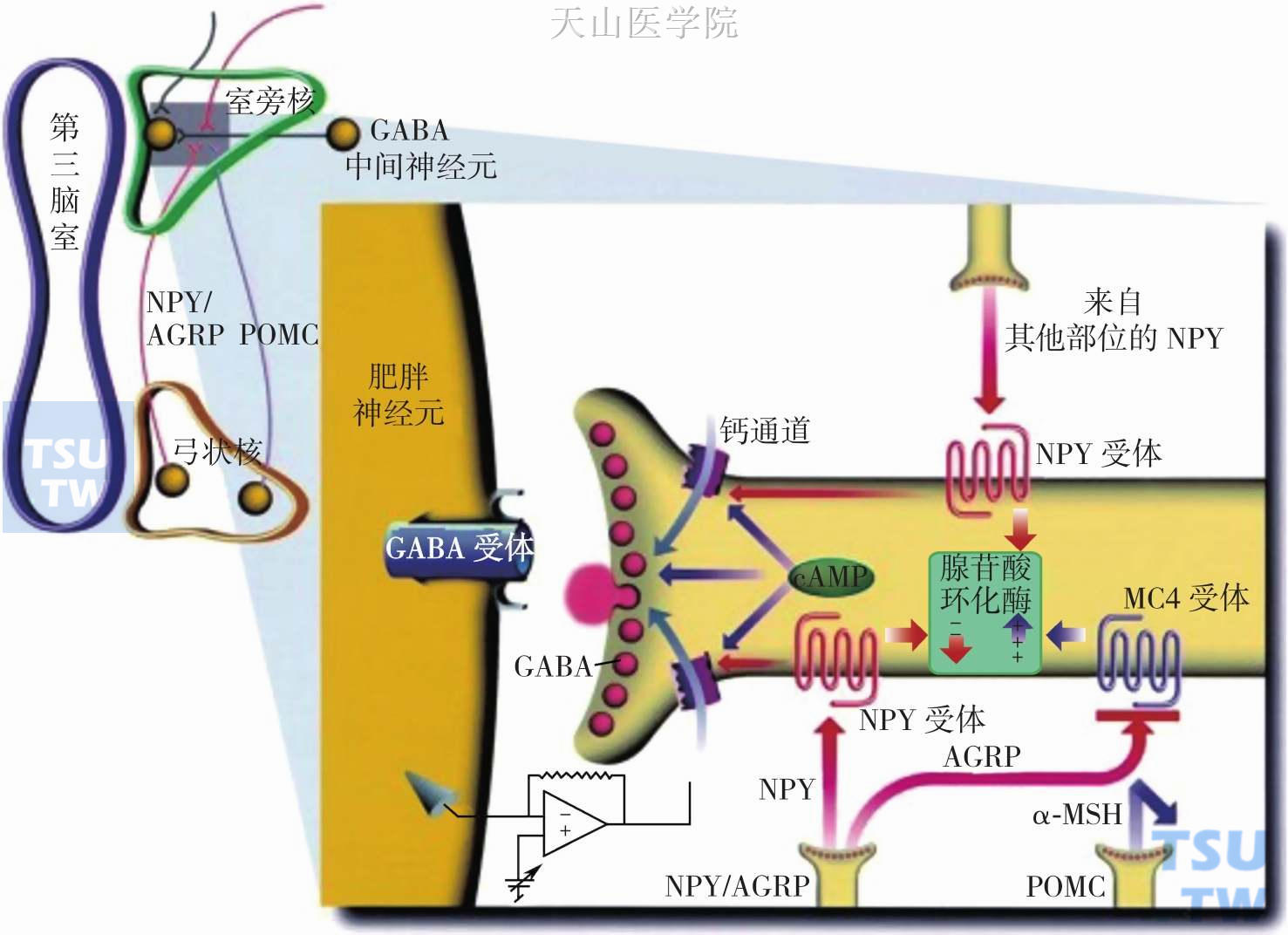
图2-3-5 MSH、NPY、AgRP和黑皮质素系统的共同作用
α-MSH、NPY、AgRP和黑皮质素系统共同调节脂肪积累的分子模型:弓状核POMC神经元、NPY/AgRP神经元以及其他部位例如脑干的NPY神经元均投射至室旁核的GABA能中间神经元,GABA能中间神经元膜表面分布有NPY受体和黑皮质素受体
睫状神经营养因子(ciliary neurotrophic factor,CNTF)是由外周神经胶质细胞施万细胞和中枢神经胶质细胞分泌的一种神经细胞因子。据报道,CNTF较其他细胞因子有更强更持久的抑制食欲的效果。在肿瘤或其他消耗性疾病,中枢的CNTF合成明显增加,下丘脑的NPY系统受其严重干扰。CNTF可抑制下丘脑弓状核基础及饥饿诱导的NPY基因表达,同时也抑制由饥饿诱导的NPY受体的表达,从而产生与瘦素相似的抑制NPY信号通路的厌食、体重下降的效应。
黑皮质素系统与恶液质
根据大量实验证据,厌食-恶液质综合征与黑皮质素系统失去其正常调控功能密切相关:过度激活POMC神经元及过度抑制AgRP神经元,引起下丘脑对有关能量消耗的外周信号不敏感。
弓状核POMC和AgRP神经元与NPY系统相似,也受到前炎症细胞因子的影响。POMC 和AgRP神经元均表达IL-1受体,IL-1β可刺激α-MSH分泌并抑制AgRP合成。另外,在禁食过夜小鼠脑内注射IL-7,与对照组相比,在重新喂食以后,POMC mRNA水平更高而AgRP基因表达下降。Grossberg等学者最近证实,POMC神经元是中枢白血病抑制因子LIF信号的直接靶点,POMC神经元表达LIF受体mRNA。急性脑室内注射LIF可一过性地抑制进食及促进α-MSH分泌。缺乏gp130 (LIF受体复合物信号转导亚基)的转基因小鼠,在脑室内注射LIF后缺乏厌食反应。
5-HT、CRF与恶液质
患有肿瘤的人或动物的下丘脑5-HT水平较正常人或动物的下丘脑5-HT水平高,同时5-HT受体表达增多。另外,当肿瘤负荷大鼠厌食发生时,室旁核5-HT水平也是增高的,此时能检测到AgRP水平下降以及α-MSH水平的升高,从而激动下游的黑皮质素系统导致食欲下降、进食量减少、体重下降的恶液质状态。当肿瘤切除后,下丘脑5-HT水平恢复正常,食欲及进食量也有所提升。下丘脑内注射5-HT2C受体拮抗剂,均可使肿瘤负荷大鼠食欲情况和胃肠蠕动功能有所恢复。
除了参与激动黑皮质素系统,5-HT在中枢通过激动5-HT2C受体,独立调节生长激素释放肽的分泌。5-HT2C受体在中枢很多部位均有表达,但也仅限表达在中枢。双神经组化标记发现大概有一半的室旁核促皮质素释放因子CRF神经元表达5-HT2C受体的mRNA。脑室内注射CRF可降低饥饿大鼠血浆酰化的生长激素释放肽水平。这提示:CRF神经元在5-HT调节生长激素释放肽分泌过程中起作用。下丘脑5-HT及CRF水平受到循环中前炎症细胞因子的调节。实验证实,CRF受体拮抗剂能改善肿瘤-厌食恶液质综合征,注射5-HT2C受体拮抗剂可降低肿瘤负荷大鼠下丘脑CRF水平及焦虑相关的行为,改善营养及精神状况,这类能通过拮抗5-HT2C受体显著改善焦虑的药物,如日本传统草药Rikkunshit,可以给肿瘤患者带来更好的生活质量(图2-3-6)。
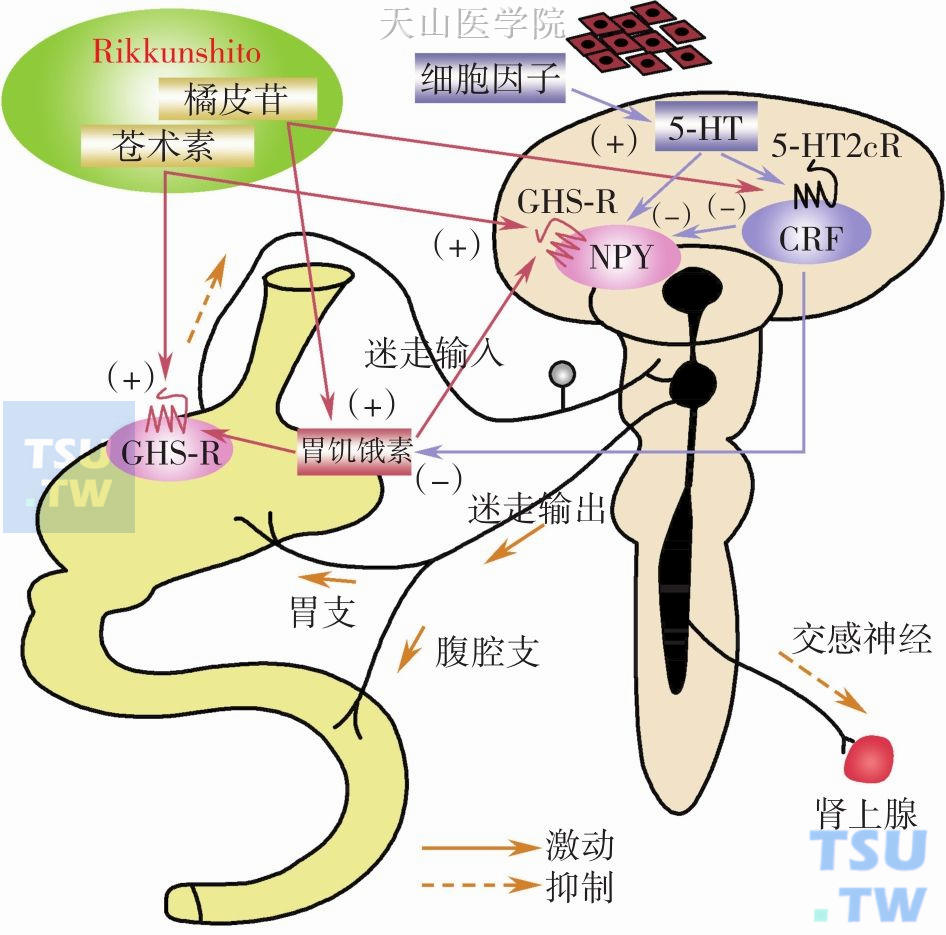
图2-3-6 Rikkunshito的作用机制
肿瘤产生大量细胞因子,通过5-HT为中间介导作用于下丘脑CRF神经元表面的5-HT2C受体而激动CRF神经元,抑制胃饥饿素的分泌,从而在癌症-厌食恶液质发生过程中起重要作用。Rikkunshito所含苍术素,可显著增强胃饥饿素与GHS-R的结合活性以及刺激下丘脑弓状核NPY神经元释放NPY。Rikkunshito所含橘皮苷,可拮抗5-HT2B/2C受体,从而增加胃饥饿素的分泌
