生长激素释放肽(ghrelin)是一种含有28个氨基酸的多肽,是生长激素促分泌素受体(growth hormone secretagogue receptor,GHSR-1a)的内源性配体。生长激素释放肽在不同物种之间结构高度保守,大鼠与小鼠生长激素释放肽结构完全相同,与人类生长激素释放肽只相差2个氨基酸(人:Arg11-Val12;鼠:Lys11-Ala12)。大部分循环中的生长激素释放肽由胃底部黏膜泌酸腺的X/A-like细胞合成及分泌,小部分由小肠、垂体前叶、胰腺细胞、肺、肾、淋巴细胞、胎盘、睾丸、卵巢和脑(下丘脑及皮质)分泌。循环中的生长激素释放肽存在酰化及去酰化两种形式,由生长激素释放肽氧-酰基转移酶(ghrelin-O-acyltransferase,GOAT)来完成酰化,只有酰化的生长激素释放肽具有生物活性(图2-3-3)。
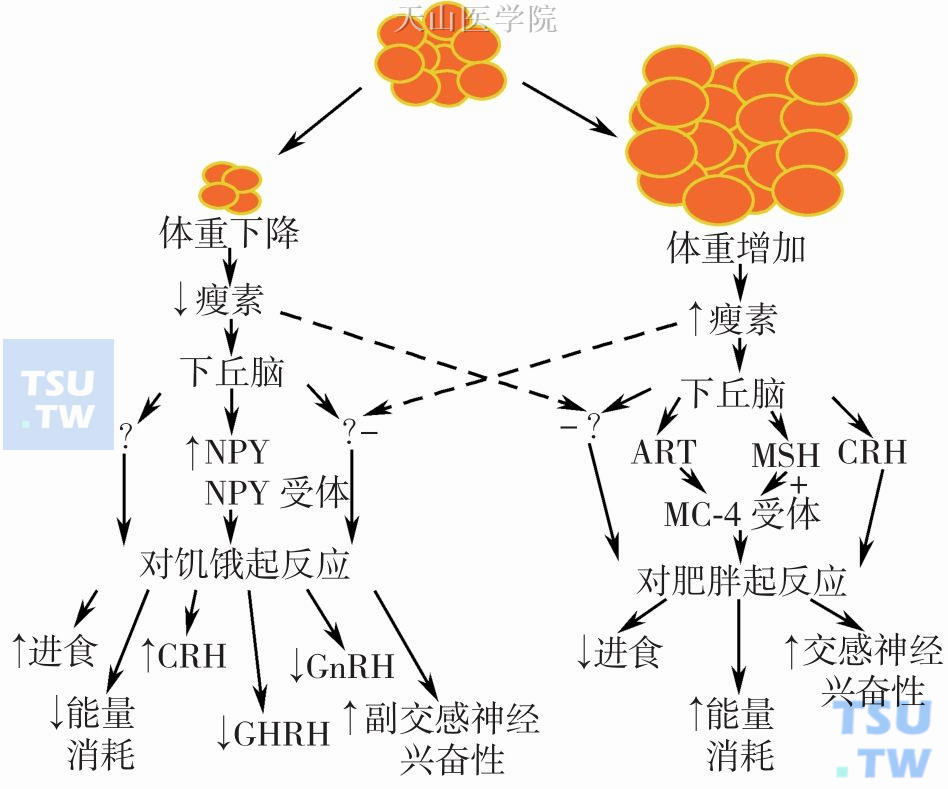
图2-3-2 瘦素与体重调节
身体脂肪组织量减少时,瘦素水平下降,下丘脑表达NPY水平相应增高,最终效应为进食量增加、能量消耗减少;当身体脂肪量增加时,瘦素水平增高,下丘脑表达CRH、MC4-受体及其配体MSH水平增高,最终效应为进食量减少、能量消耗增加
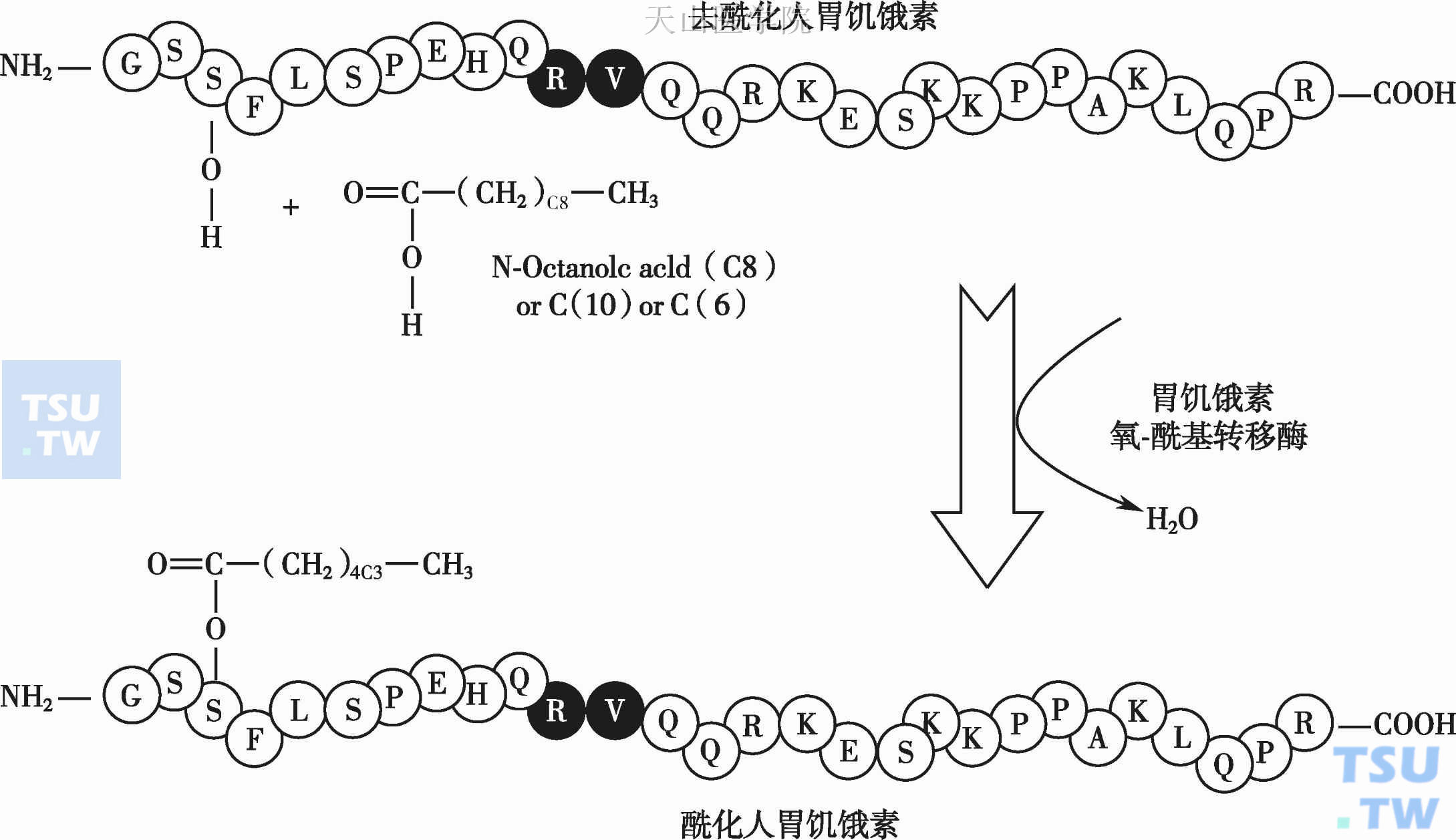
图2-3-3 胃饥饿素(即生长激素释放肽)在体重及代谢调节中的作用
GHSR-1a是一个经典的G蛋白耦联受体,在下丘脑弓状核NPY/AgRP神经元及垂体前叶神经元均呈高密度分布。生长激素释放肽与垂体GHSR-1a结合,使生长激素分泌增加;与NPY/ AgRP神经元的GHSR-1a结合,激动NPY/AgRP神经元,产生促进食欲、体重增加的作用。实验证实,注射生长激素释放肽可使NPY和AgRP表达增加,AgRP mRNA比NPY mRNA表达得更多,而使用NPY受体拮抗剂或毁损NPY/AgRP神经元均能抵消全部生长激素释放肽正能量平衡的效应,提示生长激素释放肽主要是通过NPY、AgRP来起到促进食欲、增加体重的效应,其中AgRP与下丘脑黑皮质素受体系统的相互作用可能占主导作用。
生理情况下,当机体处于饥饿或能量消耗大于摄入时,血浆中生长激素释放肽的水平会升高,同时在下丘脑弓状核的NPY/AgRP神经元细胞膜表面的GHS-1a受体表达升高。在进餐后1小时内,血浆生长激素释放肽水平迅速降低,降低的幅度与摄入的能量成比例。
在肿瘤负荷情况下,大鼠血浆中的酰化生长激素释放肽水平比自由进食正常大鼠高,但显著低于配对进食的正常大鼠,并且与血浆中瘦素的浓度呈相反的变化关系。尽管静脉注射生长激素释放肽可以刺激进食,但由于出现生长激素释放肽抵抗,这种效应在肿瘤负荷大鼠身上大大减弱。可推测,生长激素释放肽水平的降低以及生长激素释放肽受体的敏感性下降是肿瘤厌食-恶液质综合征形成的重要原因之一。
多种疾病均可导致恶液质,实验发现患有肺癌、慢性心力衰竭、慢性肾衰竭、慢性肝病和神经系统厌食的恶液质患者,与实验肿瘤负荷大鼠情况相同,他们血浆生长激素释放肽水平是升高的,这可能是对机体消耗状态的一种代偿反应。当分开研究生长激素释放肽不同亚型在恶液质状态的变化时发现,酰化的生长激素释放肽和酰化生长激素释放肽比总生长激素释放肽比值均在肿瘤恶液质中升高,与BMI值成反比。生长激素释放肽水平升高也许反映了在恶液质状态存在生长激素释放肽抵抗现象。
由于生长激素释放肽有着独特且联合的促进合成作用,例如刺激生长激素分泌、促进摄食、增加胃酸分泌和胃肠蠕动,在正常动物模型身上长期使用生长激素释放肽可显著增加脂肪质量。因此以生长激素释放肽或生长激素释放肽信号通路为治疗靶点成为改善恶液质的方向之一,然而恶液质患者出现“生长激素释放肽抵抗现象”又成为这个方向的主要障碍。
