肿瘤患者恶液质的发生主要表现为骨骼肌的减少,这主要是由于食欲减少和早饱,减少了肌肉蛋白的合成,或者是增加了肌肉蛋白的降解,而炎症反应与这些过程的机制密切相关。早在19世纪的时候,Virchow就提出了炎症反应与肿瘤有关系的观点设想。炎症反应除了在肿瘤的发展和进展的过程中起作用外,还与恶液质的发展有关。正是由于炎症与肌肉蛋白的降解率的提高、肌肉蛋白的合成率的减少和氨基酸的摄入减少有关,从而引起恶液质,炎症反应在恶液质介导引起的骨骼肌减少的机制中起着重要的作用。
炎症反应引起恶液质的机制主要包括以下几个方面:
厌食
厌食是一种复杂的进食障碍,是引起肿瘤患者发生恶液质的因素之一。食欲丧失是恶性肿瘤患者常见的症状,同时还常伴有饱感、味觉改变、恶心、呕吐等。厌食的原因很多,主要是大脑进食调节中枢功能障碍所致。炎症反应释放的炎症因子可以引起大脑进食中枢的抑制,从而使肿瘤患者食欲减退,造成营养不良,为恶液质的发生发展奠定基础。
瘦素(leptin)是肥胖基因的表达产物,由ob基因编码,主要由脂肪组织合成与分泌,它作为脂肪组织和中枢神经系统间网络联系的外周信号,具有保持机体脂肪以及能量代谢平衡的作用,从而在一定程度上控制着人体的胖瘦情况。血液循环中的瘦素以一种可饱和的运输形式通过血-脑屏障到达下丘脑,作用于位于下丘脑的瘦素受体,抑制了神经肽Y(neuropeptide Y,NPY)的分泌。NPY是一种刺激食欲的肽类神经递质,瘦素通过抑制神经肽的分泌从而抑制食欲、减少摄食、增加能量的输出,最终造成体重减轻。目前认为瘦素与体质指数和脂肪组织的含量呈显著的正相关,血清瘦素的水平可以反应体内脂肪的含量。
炎症反应发生时,机体内由于炎症反应引起的炎症因子——TNF-α的水平大大提高。TNF-α具有调节免疫应答,促进细胞生长分化等多种生物学功能,与机体炎症免疫反应有密切关系。正常情况下,TNF-α在体内的浓度较低。适量的TNF-α对机体起着必要的保护作用,但是过量的TNF-α则对机体产生损伤反应。肿瘤患者的TNF-α含量升高,破坏了细胞因子间的正常协同作用,细胞因子网络调节失调,诱导产生IL-1、IL-6、IL-8、INF-γ和抑制了免疫效应细胞对肿瘤细胞的细胞毒性作用。
TNF可以直接作用于脂肪组织,诱导胰岛素抵抗,刺激脂肪降解,抑制脂肪合成,诱导脂肪细胞和前脂肪细胞的凋亡,TNF-α系统的激活与人类能量消耗增加和体质量降低有关。TNF-α引起产生食欲下降的机制可能是其作用于下丘脑或抑制胃排空而起作用的。近年来的研究表明,TNF-α除有肿瘤溶解活性、参与炎症和免疫过程外,还可通过自分泌或旁分泌在组织局部调节脂细胞的能量代谢。TNF-α的作用与瘦素有某些相似之处,均可减少脂肪的体积和重量,限制脂肪的增长,且人体与动物实验均表明,给予TNF-α、IL-1α等能引起厌食的细胞因子,可显著增加血清瘦素水平及脂肪细胞ob的RNA的表达,由此提出“细胞因子-瘦素”的学说,认为感染、肿瘤等引起的食欲减退、恶液质与多种炎性细胞因子诱导瘦素生成增加有关系。
炎症反应产生的另一种炎症因子——IL-1,是一种恶液质因子,它直接作用于下丘脑饱食中枢和外周部位。与下丘脑食物调节中枢的IL-1受体结合产生厌食。实验表明,IL-1引起大鼠进食改变与肿瘤恶液质早期表现相似,开始是进食种类减少,然后是数量减少。中枢神经系统内IL-1浓度与动物进食呈负相关,IL-1通过作用于下丘脑腹侧核而引起厌食。同时还发现,在大鼠下丘脑腹侧注射IL-1受体拮抗剂,动物厌食现象明显改善。同时,动物实验表明IL-1的厌食作用与5-羟色胺密切相关。肿瘤生长刺激宿主免疫系统,产生IL-1及其他一些细胞因子,影响机体物质代谢,血浆色氨酸浓度增加并通过血-脑屏障,大脑中色氨酸水平增高,使5-羟色胺合成、释放增加,而引起厌食。因此,炎症反应产生的IL-1在恶液质发生发展中也有重要的作用。
脂肪组织消耗增多
肿瘤产生的炎症反应,通过炎症因子引起脂肪组织和其他肌肉和脂肪代谢通路的障碍,从而引起恶液质的发生。虽然癌性恶液质和肥胖代表完全不同的营养和代谢平衡的紊乱,但是他们在细胞、分子和信号通路上有着重叠的地方。在癌肿恶液质中,循环中炎症反应产生的炎症因子对肌肉、脂肪、棕色脂肪组织(brown adipose tissue,BAT)及肝介导的几个信号通路之间及代谢有着潜在的影响,这将会引起主要的代谢通路的紊乱。
肿瘤衍生因子,如IL-6及TNF被认为是引起脂肪分解和脂肪消耗的重要介质。在肿瘤患者中,恶液质的发生,与患者的脂肪组织的消耗有密切的关联。棕色脂肪组织的消耗,主要是由于脂肪分解作用的增加,脂肪生成的不健全,脂肪贮存和全身能量储备的减少。为了增加产热而加强脂肪组织的分解活动会引起脂肪及葡萄糖利用上的浪费,这与肿瘤患者食物摄入减少一起加剧了患者恶液质的进展。炎症反应产生的炎症因子与脂解作用及棕色脂肪的激活存在着潜在的联系。肿瘤细胞释放的细胞因子可以通过儿茶酚胺激活β受体调控棕色脂肪组织中的中心交感活动(图2-6-1)。
β3肾上腺素能受体(beta3-adrenoreceptors,b3AR)的下调,蛋白激酶A(Protein Kinase A,PKA)激活脂解作用,增加激活解耦联蛋白1(uncoupling protein,UCP1)所需要的可利用的游离脂肪酸,因而加强线粒体呼吸作用的解耦联。此外,IL-6可以选择性地通过磷酸化信号传导与转录活化因子3(signal transducers and activators of transcription,STAT3)改变BAT的基因表达,从而对BAT中代谢的昼夜节律进行调整。IL-6对脂肪的动员也有直接的影响,因为它不仅可以在人体的脂肪组织中刺激脂解作用,同时也能够在单独的脂肪细胞中起作用。因此,IL-6 介导的脂解作用增加循环中的游离脂肪酸(free fatty acids,FFAs)和BAT中的局部脂肪滴中能够供应激活UCP1的游离脂肪酸。另外一个可以下调AR/PKA信号介导棕色脂肪产热作用的步骤是磷酸化p38丝裂原激活的蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK),引起过氧化物酶体增殖活化受体γ共激活因子-1a (peroxisome proliferator-activated receptor-gamma coactivator,PGC-1a)和UCP1表达的上调,增加线粒体的生物合成。除了Janus激酶(Janus kinase,JAK) -1/STAT通路中,IL-6还通过作用于Ras/raf/ MAPK信号通路,因此,我们推测IL-6能够直接地激活BAT中的p38而增加UCP1的丰富度,从而增加或绕过儿茶酚胺介导的刺激。
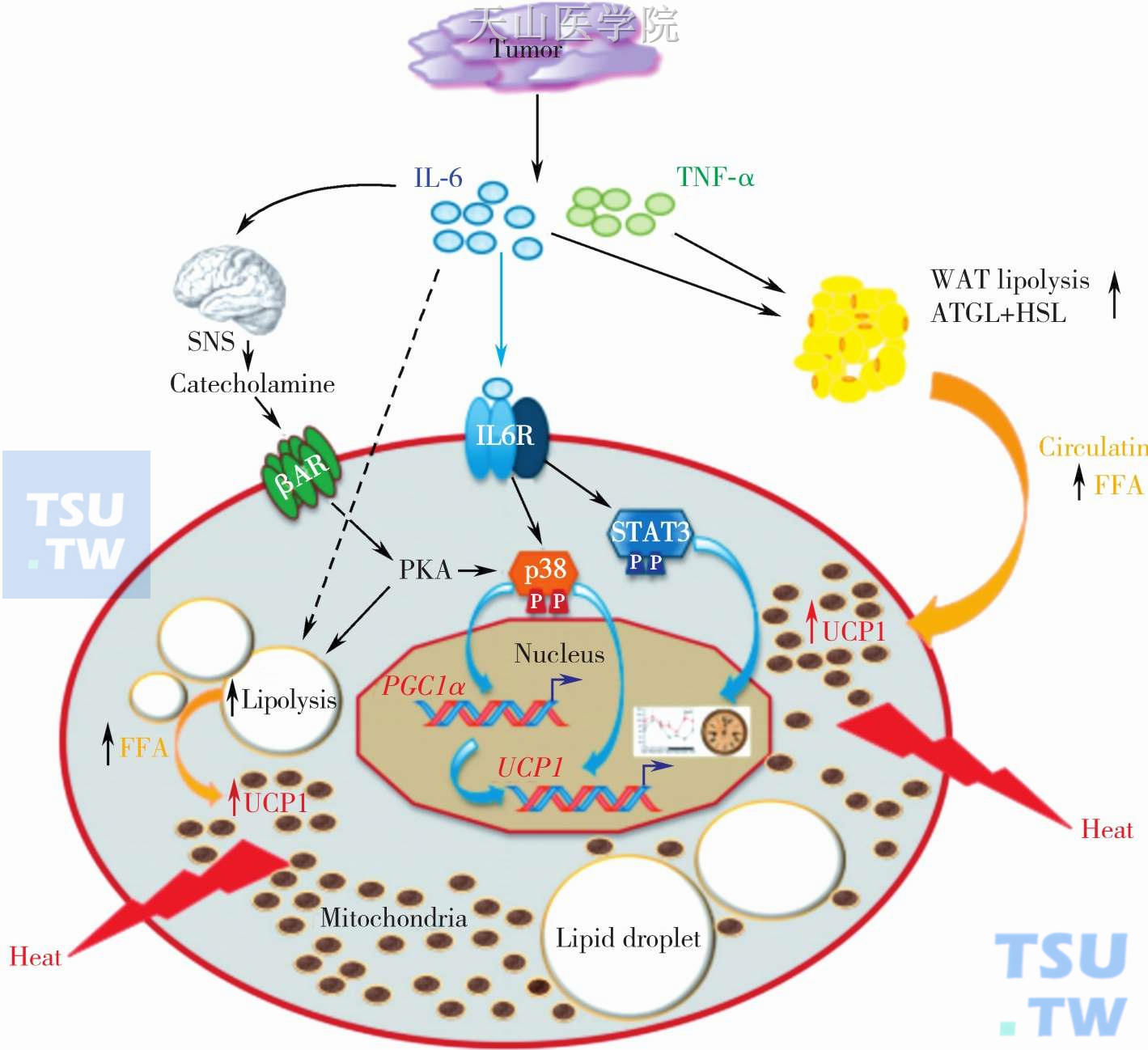
图2-6-1 肿瘤衍生因子介导的脂肪分解和脂肪消耗
Circulating FFA
在肥胖者中,由脂肪组织巨噬细胞或其他的浸润的免疫细胞产生的亲炎症因子和化学因子,如IL-1β、IL-6、TNF-α、INF-γ、癌性恶液质趋化配体2 (CC-chemokine ligand 2,CCL2)、癌性恶液质趋化配体3(CC-chemokine ligand、3,CCL3)和CXC趋化因子配体8(CXC-chemokineligand 8,CXCL8)可刺激局部和全身的炎症反应,从而引起高甘油三酯血症、胰岛素抵抗、肝脂肪变和心血管疾病。由此可见,肥胖和恶液质的代谢有着共同的特征:包括胰岛素抵抗,脂解作用加强,游离脂肪酸和神经酰胺酸类增加及代谢通路的独特性损害。此外,在肿瘤患者中,系统性炎症反应的出现将会调节脂肪细胞内的巨噬细胞的反应,会引起恶液质患者恶心从而引起食物摄入的减少(图2-6-2)。
缓慢释放入循环中的肿瘤因子将会扰乱控制多种器官代谢的神经内分泌,同时还会干扰肌肉因子和脂肪因子的作用。代谢有限的可用性和异常的利用对恶液质的能量平衡的失调有着重要的影响。代谢通路的失调,尤其是代表能量需求增加的BAT激活产热,会引起恶液质患者能量需求的失衡、恶心和食欲减少的反应。这也在一定程度上促进了肿瘤患者恶液质的发生发展。
肌肉蛋白合成受损
炎症介导的信号通过多种机制限制肌肉蛋白的合成。炎症细胞因子如TNF和IL-6在这种调节中起着重要的作用。
MyoDI是骨骼肌细胞肌源分化因子(myogenic differentiation antigen,MyoD)家族的抑制因子,是骨骼肌分化和修复损伤组织的一个重要的转录因子。正常成人骨骼肌中MyoD表达水平相对较低。但在某些病理情况下包括肿瘤恶液质、创伤和炎性病变,MyoD在增殖分化的成肌细胞中增强表达。MyoD被激活后可以启动和促进骨骼肌分化过程中成肌细胞融合成多核肌细胞,对骨骼肌修复起着重要的作用。研究表明,TNF能够激活NF-κB的转录,增加恶性肿瘤患者MyoDI的表达,这将会抑制肌肉特异转录因子MyoD的合成,因此抑制其分化。在肿瘤恶液质患者,由于MyoDI表达,对抗了MyoD对骨骼肌的修复作用,因此即使行常规的营养支持,也难以促进患者机体骨骼肌蛋白质的合成及细胞的增殖分化,再加上癌细胞对营养的消耗,使得患者恶液质难以纠正。
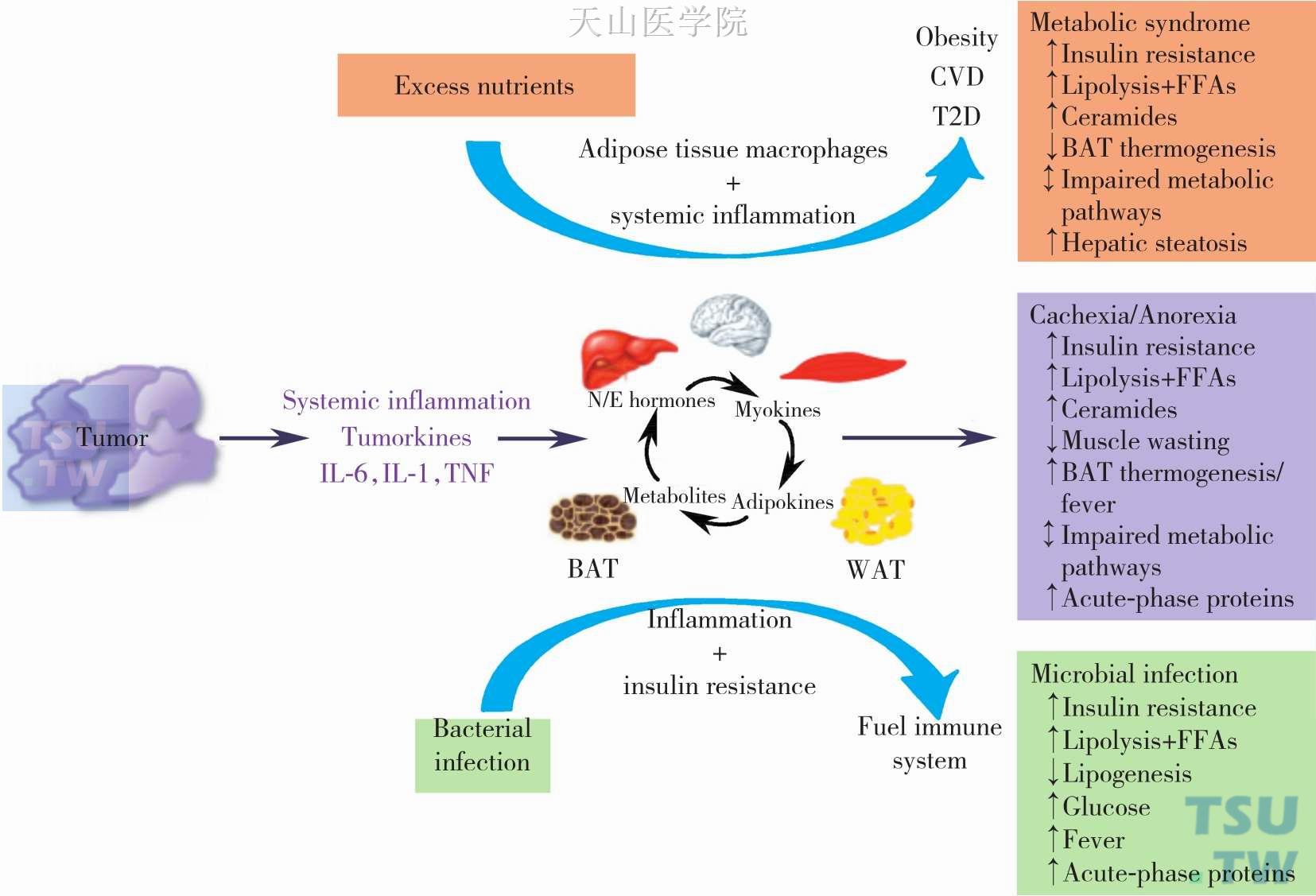
图2-6-2 肥胖、肿瘤及感染导致的代谢变化比较
肌肉抑制素是肌肉体积的负调剂因子,抑制肌源性的增生和分化。缺少肌肉抑制素的抑制作用,人类和动物的肌肉体积将会大大增加。虽然,人类对恶液质患者肌肉抑制素的研究还停留在初始阶段,但是初始的研究表明,在恶液质患者中肌肉抑制素的水平大大升高。动物模型的研究表明炎症因子,如TNF-α对肌肉抑制素的增加有着重要的作用。
此外,炎症反应引起中心食欲减少通路的发生,限制了食物营养的消耗。mTOR信号通路是骨骼肌中食欲减少反应的主要介质。TNF也影响蛋白同化的mTOR通路。而氨基酸,尤其是亮氨酸,对肌肉蛋白的合成是必需的,氨基酸的可利用性的减少对恶液质患者由炎症反应引起的肌肉的减少有着重要的作用。除了氨基酸供应的减少外,食欲减少也会减少对肌肉合成有促进作用的胰岛素的释放。由胰岛素或氨基酸激活的mTOR可以激活下游目标核起源因子与4E蛋白和核糖体S6激酶1结合,这将会促进翻译的起始子,核延伸因子的转录,从而刺激引起延伸(图2-6-3)。
研究表明,mTOR信号通路在恶液质患者中是处于抑制状态的,这可能与多种机制有关,如食欲减退引起的氨基酸摄入的减少和与mTOR信号通路相对立的炎症介质如TNF等。
