病例与思考
男性患者,52岁,因腹胀,排便、排气停止2天入院。该患者半年前确诊为胃低分化腺癌Ⅳ期,伴大网膜、腹膜转移。近2个月自觉腹胀,排便、排气困难,间断恶心,无呕吐,进食量明显减少,以半流食为主,可进少量固体食物。近2天排便排气停止,伴有恶心、呕吐,基本未进食。体重下降,与入院前6个月相比体重减轻15kg,与入院前1个月相比体重减轻7.5kg,与入院前2周相比,体重下降5kg。体格检查:消瘦,体脂消失,肌肉中度减少,皮肤略干燥,身高180cm,体重55kg,卡氏功能评分(Karnofsky Performance Status,KPS)评分50分,预计生存期>3个月。CT提示小肠及多部位结肠梗阻。留置肠梗阻导管,每日引流液800ml左右。
- 该患者是否存在营养不良?应用哪种筛查评定工具进行判断最适宜?
- 分析患者营养不良的原因?
- 根据2011国际恶液质专家共识提出的诊断标准该患者是否可诊断为恶液质?
概述
营养不良(malnutrition)是指营养物质不足、过量或比例异常,与机体的营养需求不协调,从而对细胞、组织、器官的形态、组成、功能及临床结局造成不良影响的综合征,包括营养不足和营养过度两个方面,涉及摄入失衡、利用障碍、消耗增加三个环节,肿瘤营养不良特指营养不足。恶液质(cachexia)是以骨骼肌块(skeletal muscle mass)持续下降为特征的多因素综合征,伴随或不伴随脂肪块(fat mass)减少,不能被常规的营养治疗逆转,最终导致进行性功能障碍。其病理生理特征为摄食减少、代谢异常等因素综合作用引起的蛋白质及能量负平衡。
营养不良可分为饥饿相关性营养不良和疾病相关性营养不良,恶液质是疾病相关营养不良的特殊形式,在多方面其区别于单纯饥饿所致营养不良。摄食减少是单纯饥饿所致营养不良的主要原因,而对于恶液质相关营养不良,其仅是病因之一,而更为突出的病因却是炎症介质所致代谢紊乱;饥饿时主要以脂肪消耗、利用为主,蛋白质得以保存,而在恶液质中,以蛋白质过度消耗为主;饥饿所致体重下降,主要以脂肪减少为主,而恶液质体重下降主要以肌肉减少为主,伴有或不伴有脂肪减少,例如神经性厌食症患者,体重下降的3/4 是由脂肪丢失所致,仅小部分是肌肉丢失所致,但癌性恶液质患者体重下降则是以骨骼肌量减少为主,也就是说,当体重下降相同时,癌性恶液质丢失的肌肉大于神经性厌食;单纯饥饿所致营养不良经过营养支持治疗,改善显著,但恶液质相关营养不良应用营养支持难以逆转。部分营养不良可以进展为恶液质。值得注意的是,所有营养不良的患者不都是恶液质状态,但所有恶液质的患者却都是营养不良的。
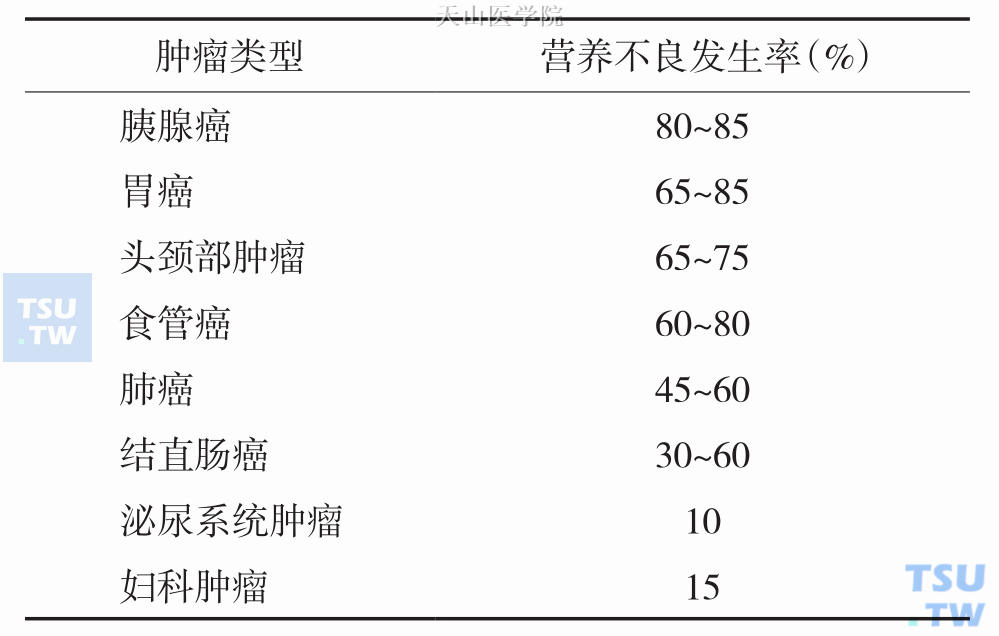
至今,在全世界范围内营养不良仍然是一个比较突出的问题,国内外统计数据显示住院患者营养不良的发生率约占20%~50%。慢性消耗性疾病,如肿瘤、获得性免疫缺乏综合征(acquired immune deficiency syndrome,AIDS)、慢性阻塞性肺病(chronic obstructive pulmonary diseases,COPD)、终末期肾衰等,尤其是老年患者,营养不良、恶液质发生率更高。恶性肿瘤患者营养不良的发生率可高达40%~80%,胃癌、食管癌、胰腺癌和头颈部肿瘤的患者更易发生肿瘤相关性营养不良。50%的肿瘤患者在诊治时体重下降超过10%,约20%的患者死于恶液质。表6-2-1列举了部分营养不良发病率较高的肿瘤。
表6-2-1 不同类型肿瘤营养不良发生率
营养不良病因及病理生理机制
营养不良可继发于饥饿或各种急、慢性疾病,恶液质相关营养不良均为疾病相关性营养不良。任何一种急、慢性疾病都可能通过多种途径导致营养不良。厌食、味觉改变、恶心、呕吐、腹泻、消化道梗阻、消化道黏膜炎等情况所致营养物质摄入、消化、吸收减少,能量及蛋白质需求增加,消耗、丢失增多,以及由多种神经内分泌因子、细胞因子参与的代谢紊乱是导致疾病相关营养不良的主要因素。另外,治疗毒副作用、心理因素、社会经济等因素也与营养不良发生和进展相关。图 6-2-1简介了疾病相关性营养不良发生发展机制。表6-2-2中简要概括影响营养代谢的激素和细胞因子。
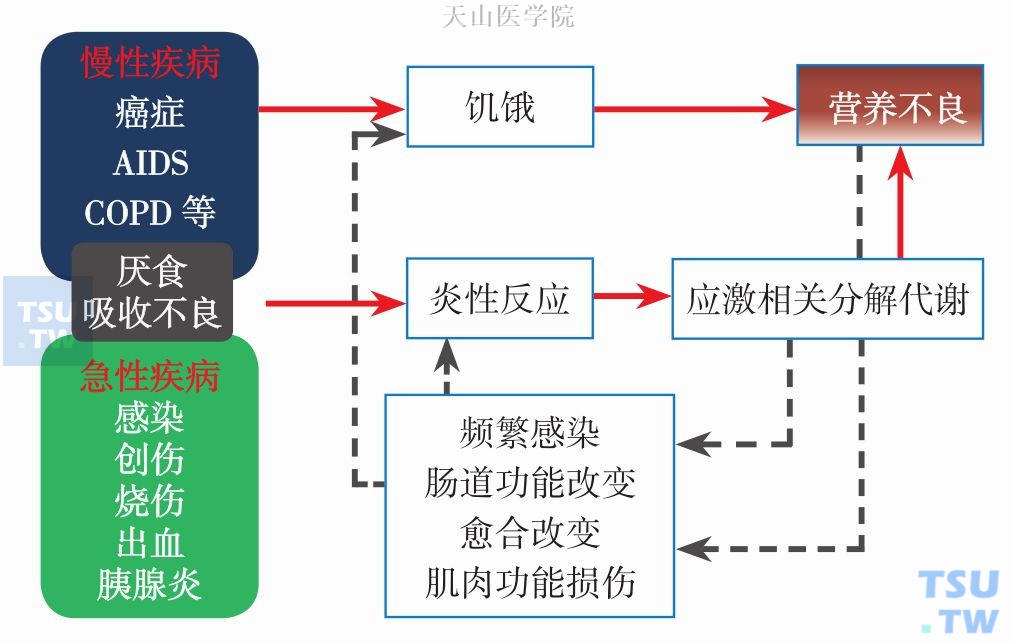
图6-2-1 疾病相关性营养不良发生发展机制
表6-2-2 影响营养代谢的激素和细胞因子

恶性肿瘤是导致营养不良及恶液质的最常见疾病之一,巨大的能量消耗和低效率的能量利用被认为是肿瘤患者营养不良、恶液质的重要原因,由肿瘤产生的代谢分解物质如蛋白水解诱导因子(proteolysis-inducing factor,PIF)、脂肪动员因子(lipid mobilizing factor,LMF)和炎症介质如白细胞介素-1 (interleukin-1,IL-1)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factorα,TNF-α)、γ干扰素(Interferonγ,IFN-γ)的作用是核心病理生理机制(图6-2-2)。本节将以肿瘤相关营养不良、恶液质为例进一步阐述。
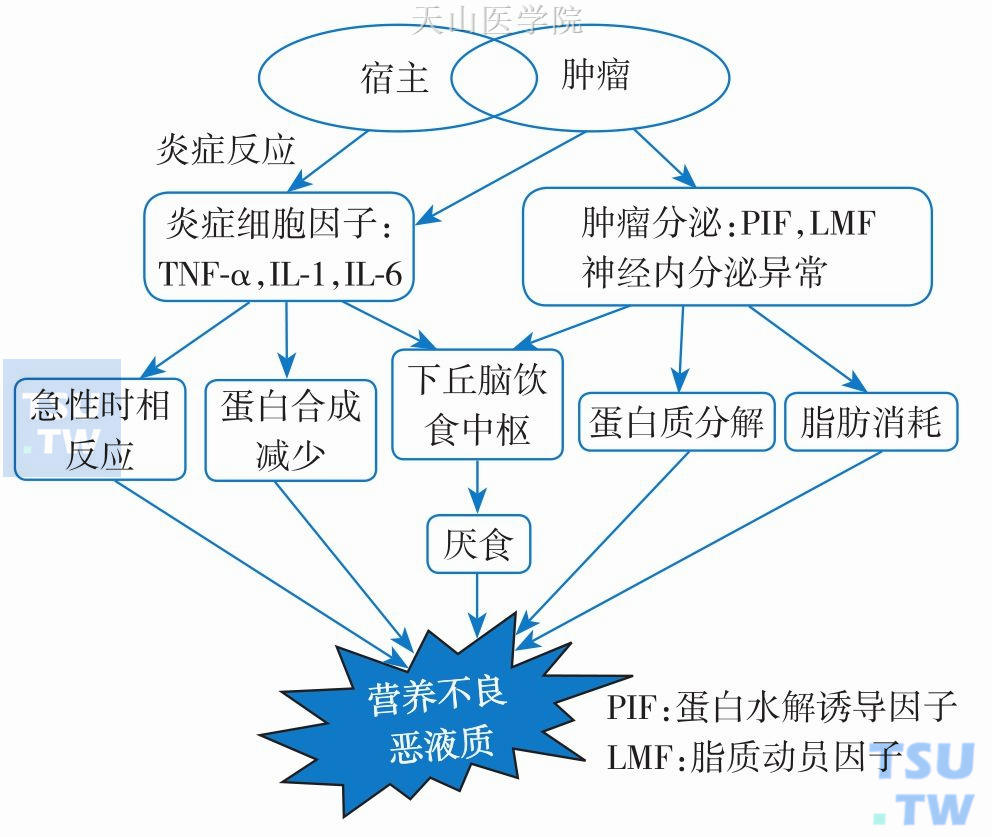
图6-2-2 肿瘤相关营养不良及恶液质病理生理机制
肿瘤所致代谢异常对营养状态的影响
1. 能量消耗增加
肿瘤患者耗损增加,使静息能量消耗(resting energy expenditure,REE)增加。体重显著下降者及低体重者REE升高更加明显。尽管不同肿瘤患者的REE差异非常大,但是肿瘤患者的平均REE水平>110%,提示肿瘤患者整体上处于高代谢状态。生理条件下,REE升高会自主增加摄食量,以满足机体的能量需求。肿瘤患者REE与摄食量之间的反馈调节机制丧失,肿瘤患者的摄食量没有随着REE升高而相应增加,或者说没有增加到应有水平,从而造成巨大的能量差,进而导致营养不良、恶液质。
2. 肿瘤细胞及宿主相关营养物质代谢异常
(1) 肿瘤细胞异常物质代谢:
肿瘤细胞异常糖代谢:最重要的代谢特征就是葡萄糖的有氧酵解,即瓦博格效应(Warburg Effect)。多种类型肿瘤细胞的研究证实,肿瘤细胞的糖酵解能力是正常细胞的20~30 倍,糖酵解增强与肿瘤生长速度成正比,与分化程度成反比,还与肿瘤的侵袭性生长密切相关。
肿瘤细胞异常蛋白质/氨基酸代谢:为了满足细胞不断增殖的需要,肿瘤细胞常常加强蛋白质合成和增加一些氨基酸的摄取和代谢,包括谷氨酰胺摄取和分解代谢加强,蛋氨酸依赖性增强,支链氨基酸摄取和氧化分解增加,精氨酸需求增加而再合成能力下降等。
肿瘤细胞异常脂肪代谢:主要表现是脂肪酸从头合成以及磷脂和胆固醇合成增强。这可能与肿瘤细胞不断增殖、需要合成大量膜脂有关,还与肿瘤细胞恶性表型(侵袭和迁移等)有关。
(2) 肿瘤宿主异常物质代谢:
肿瘤相关性营养不良的代谢紊乱包括影响三大营养物质代谢的改变,代谢亢进是最普遍的形式。总的来说,表现为胰岛素抵抗、糖耐量下降、糖异生增加、糖原利用下降、脂肪分解增加、脂肪合成减少、肌蛋白质分解增加、急性反应期蛋白合成增加、低蛋白血症、负氮平衡,最终导致患者体重下降、营养不良、恶液质。
肿瘤宿主异常糖代谢:主要表现为一定程度的胰岛素抵抗和葡萄糖利用障碍。大约30%的肿瘤患者其血糖升高(空腹血糖>6.1mmol/L),30%以上肿瘤患者的胰岛素敏感性和处理葡萄糖能力降低、糖耐量异常,肿瘤患者葡萄糖摄入急性诱导胰岛素分泌的幅度减少40%~50%。同时,肿瘤患者的乳酸-葡萄糖循环(即Cori循环)增强,恶液质患者更加明显。葡萄糖利用效率明显下降是肿瘤患者消瘦的部分原因。
肿瘤宿主蛋白质/氨基酸异常代谢:主要表现为骨骼肌不断降解、瘦组织群下降、内脏蛋白消耗和低蛋白血症。恶液质患者的体重下降30%时,其骨骼肌蛋白丢失即可高达75%,且食物补充不能逆转肌肉消耗。同时,肝脏急性期反应蛋白合成增加,使机体总蛋白质转化率和净蛋白分解率增加,但白蛋白合成减少。蛋白质代谢异常、肌肉进行性消耗是导致恶液质的重要原因及标志性改变,是区分其他营养不良状态的关键。
肿瘤宿主异常脂代谢:主要改变是高血脂,血浆脂蛋白、甘油三酯和胆固醇升高,外源性脂肪利用下降,脂肪动员增加。脂代谢异常是肿瘤的一个早期改变,研究发现非侵袭性肿瘤且没有营养摄入减少时,其腹膜后储存脂肪即有严重下降。表6-2-3概括了肿瘤宿主的三大物质异常代谢。
3. 肿瘤引起的潜在介质的异常
肿瘤所致介质的异常是营养不良,尤其是恶液质发生的重要原因。以炎症介质为核心介导的代谢紊乱严重影响患者的营养状态,并恶性循环,最终导致不可逆转的恶液质状态。
急性期的蛋白应答在肿瘤营养不良及恶液质的发生中起作用。急性期蛋白应答主要是在炎症因子的刺激下急性期蛋白在肝脏合成的增加,主要包括C反应蛋白(C-Reactive protein,CRP)和甘露糖结合蛋白。急性期蛋白应答同代谢亢进和去脂肪体重减少有关,加速消瘦,减少生存期。
表6-2-3 肿瘤宿主的三大物质异常代谢

促炎症因子(如IL-1、IL-6、TNF-α和IFN-γ)与抗炎症因子(如IL-4、IL-12、IL-15)的失衡在恶液质的发生发展中起重要作用。促炎症因子能引起一些级联反应,包括对代谢和食欲的影响,同时也对急性期蛋白有间接影响。TNF-α、IL-1可直接作用于下丘脑导致厌食,抑制脂蛋白酶的活性,导致脂肪贮存减少、促进肌肉萎缩,引起促肾上腺皮质激素释放增加,使食欲减少,代谢紊乱。IL-6可作用于下丘脑产生厌食,还可介导蛋白质分解增强。IFN-γ可能通过减少脂肪合成,降低食物摄入,促使体内组织消耗直接或间接与恶液质发生发展相关。
神经内分泌因子紊乱,如黑皮质素、胰岛素、氢化可的松和胰高血糖素在恶液质的发生中也起重要的作用。氢化可的松是一种分解代谢激素,然而胰岛素具有合成作用,因此,在恶液质患者中氢化可的松/胰岛素比例的升高产生高代谢状态。
肿瘤衍生因子,如肿瘤PIF能引起肌肉和体重的丢失。PIF的作用机制主要是上调ATP-泛素依赖的蛋白水解途径导致骨骼肌分解代谢增强。LMF在肿瘤患者活性增强,其作用方式类似于脂解激素,直接作用于脂肪组织,脂肪分解增强,释放游离脂肪酸和甘油。研究表明,肿瘤患者中,血清和尿液中的脂肪动员因子的水平同消瘦呈线性关系。
肿瘤相关症状对营养状态的影响
肿瘤患者可出现原发肿瘤、抗肿瘤治疗、伴随疾病或三者共同作用所引起的生理及精神症状,包括早饱、厌食、恶心、呕吐、疼痛、发热、腹泻、便秘、梗阻、焦虑、恐惧、失眠等,其中以食欲下降最为常见,从而直接或间接导致营养物质摄入减少、基础代谢增加、消耗增加,最终产生营养不良、恶液质。
上述症状在肿瘤的整个病程中均可出现,早期肿瘤患者即已存在这些症状,一个肿瘤患者常常同时合并多种症状,一个症状可见于多种不同的肿瘤患者。体重明显下降的患者,出现的症状更多。这些症状与营养的关系非常明确:症状越多,营养不良越重。
治疗模式对营养状态的影响
抗肿瘤治疗对营养的影响是营养不良的另外一个重要原因。
几乎所有的化疗药物都可能导致营养相关副作用,最常见的两种急性反应是恶心和呕吐。化疗的毒副作用一般开始于化疗后数小时,化疗后1~2天最为突出,化疗后5~7天消退。化疗可以直接影响新陈代谢,或因引起恶心、呕吐、腹泻、味觉改变、食欲减退以及畏食而间接影响营养物质的摄入。
放疗对营养的影响取决于患者状态、肿瘤位置、放射线类型、照射野尺寸、治疗剂量和持续时间,放射剂量和解剖部位是潜在副作用的决定因素。放疗对营养的影响可以概括为两个“远”,即:远隔效应与远期效应。远隔效应是指非腹部的放疗可以引起严重的小肠黏膜损伤,影响患者的消化与吸收,导致营养不良;远期效应是指放疗的毒副作用出现较晚,持续时间较长,可以数月甚至数年。因此,总体上说,放疗对营养的干扰可能较化疗更大。
手术作为一种外源性创伤,可以从多方面影响营养状况。一方面,术前的焦虑、烦躁、恐惧、禁食可能导致营养摄入不足;另一方面,术中机械性创伤、术后感染、炎症反应可能导致大量炎症介质的分泌,激发机体一系列代谢变化,进而造成营养素的消化吸收障碍;第三方面,手术后创伤修复营养物质需求增加、手术后营养补充不足,都可能导致能量负债。图 6-2-3概括肿瘤相关营养不良、恶液质的病因。
营养不良的后果
大量的前瞻性临床研究及meta分析结果显示营养不良是患者不良临床结局的独立风险因子。营养不良或具有营养风险的患者其发病率、死亡率、合并症发生率更高,住院时间延长,医疗费用增多,对治疗的耐受性减低,生活质量差,预后差。
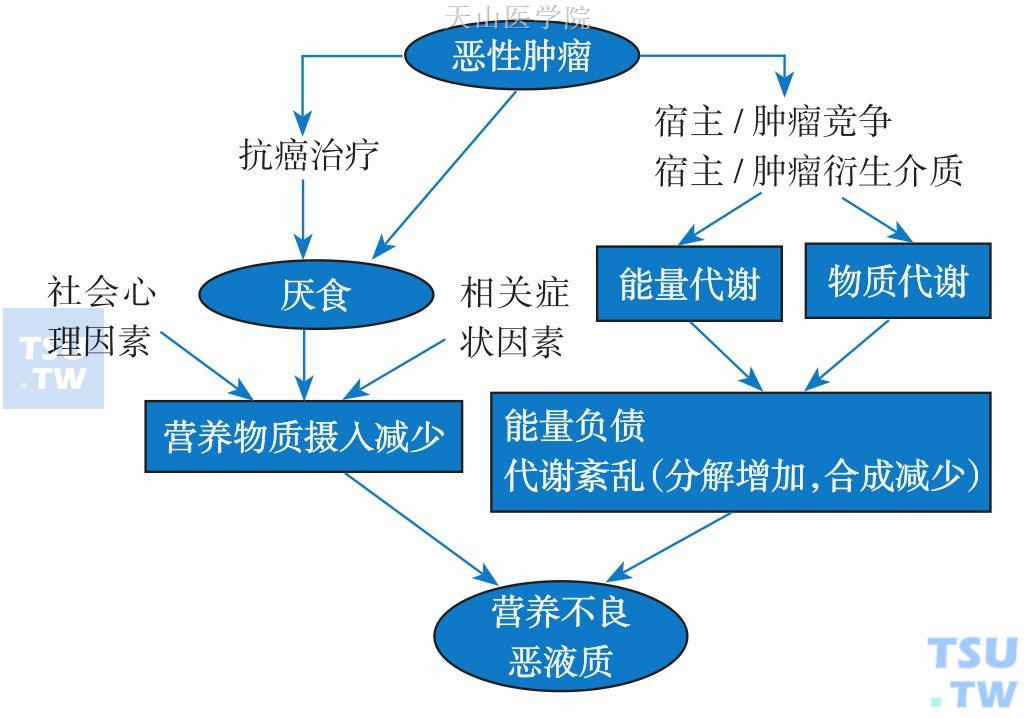
图6-2-3 肿瘤相关营养不良、恶液质的病因
营养不良对患者的影响包括细胞、生理及心理三个层次。细胞水平上,营养不良削弱了机体对病原微生物的防御能力,增加了感染风险,延缓了伤口愈合,降低了肠道营养吸收,改变了凝血、肾脏等多系统器官功能。生理水平上,营养不良导致呼吸肌、心肌等肌肉及脂肪的丢失,导致内脏生命器官的萎缩。研究发现,体重非主观下降15%可以导致呼吸肌肉力量的锐减;体重丢失23%可以导致体能下降70%,肌肉力量下降30%,抑郁升高30%。心理层面上,营养不良引起乏力、冷漠、畏食,进而延长了疾病恢复时间。总之,营养不良降低了生活质量、增加了并发症、削弱了治疗效果、升高了死亡率、缩短了生存时间、增加了医疗费用。
(一) 影响患者的生活质量
营养不良的患者常常因躯体功能障碍、疲乏、疼痛、恶心、呕吐、呼吸困难、食欲丧失等较差的健康状态以及减少的社会活动,而明显影响其生活质量。研究发现,体重下降者的生活质量评分明显低于体重无下降者。
(二) 影响患者的脏器功能
营养不良可影响各系统脏器功能,如循环系统:可导致心肌重量减少、收缩功能降低、心排血量下降、心律失常、心衰、周围循环衰竭等;呼吸系统:可导致呼吸肌结构受损、质量及收缩力量下降、呼吸衰竭、合并肺炎增多等,肿瘤患者之所以非常容易发生肺部感染,除免疫功能下降之外,更加重要的原因是呼吸肌丢失、咳嗽反射减弱、排痰能力下降;消化系统:肠黏膜屏障功能受损、吸收不良、腹泻、食欲减退等;精神神经系统:可产生焦虑、抑郁等症状,并可使大脑正常生理功能受损等;免疫系统:可使细胞及体液免疫缺陷、胸腺萎缩,明显降低抗感染能力等。
(三) 影响患者治疗效果及预后
营养不良时,血浆蛋白水平降低,治疗药物的吸收、分布、代谢及排泄出现障碍,明显影响药物的药动学,药物的毒性作用因此增加,对治疗的耐受性下降。
研究发现,与营养良好、体重稳定的肿瘤患者相比,营养不良者其规范化疗完成率明显下降,体重下降者化疗有效反应率显著降低;体重下降的肿瘤患者尽管接受初始化疗的剂量更小,但是其剂量相关性毒副作用(手足综合征、口疮等)更加频繁、更加严重。同样,营养不良的肿瘤患者其放疗耐受力下降、敏感性降低、毒副作用增加;手术的并发症和死亡率升高。肿瘤患者的体重下降是不良预后的重要预测参数。与静态体质指数(body mass index,BMI)相比,体重的动态变化更有意义。体重下降者体能状态评分低于体重稳定者。体重下降、营养不良者的生存时间显著短于体重稳定、营养良好者;术前平均营养预测指数(prognostic Nutritional Index,PNI)低的肿瘤患者(即营养不良)其5年生存率显著低于PNI高者。说明营养不良明显影响肿瘤患者的预后,即营养不良的肿瘤患者预后差,死亡率高。
(四) 增加经济负担
营养不良患者住院治疗时间延长、住院频次增加、再次入院风险升高、就诊次数增多、营养治疗费用增加、占用医疗资源增加,从而导致医疗费用增加,患者个人、家庭及国家的经济负担加重。
营养不良风险筛查与评定
营养风险筛查与营养状态评定的共同目的是发现具有营养风险和营养不良的患者,确定营养治疗的对象,进而实施营养治疗。对患者进行早期营养风险筛查与评定意义重大,因为只有在早期阶段发现营养相关问题,适时给予正确的靶向营养指导及个体化治疗才会取得良好效果,患者一旦已进入恶液质期,此时的营养干预治疗疗效甚微。
相关定义
营养风险(nutritional risk)欧洲肠外肠内营养学会(European Society of Parenteral and Enteral Nutrition,ESPEN)的定义为“现存的或潜在的与营养因素相关的导致患者出现不利临床结局的风险”。这里所强调的营养风险,是指与营养因素有关的,出现临床并发症的风险,而不是出现营养不良的风险,与营养不良的风险(risk of malnutrition)是截然不同的两个概念。
营养风险筛查(nutritional risk screening)美国营养师协会(American Dietetic Association,ADA)指出,“营养风险筛查是发现患者是否存在营养问题和是否需要进一步进行全面营养评估的过程”。美国肠外肠内营养学会(American Society for Parenteral and Enteral Nutrition,ASPEN)的定义为:“营养风险筛查是识别与营养问题相关特点的过程,目的是发现个体是否存在营养不足和有营养不足的危险”。ESPEN认为,“营养风险筛查是一个快速而简单过程,通过营养筛查如果发现患者存在营养风险,即可制订营养计划。如果患者存在营养风险但不能实施营养计划和不能确定患者是否存在营养风险时,需进一步进行营养评估”。
营养评定(nutritional assessment)是在大量临床资料中收集相关资料,如一般状况、饮食情况、身体测量指标和生化指标,按营养状态对患者进行分类:营养良好或营养不良,并评估患者营养不良的程度,从而进行相应的营养治疗。
营养风险筛查
恶性肿瘤患者一经明确诊断,即应进行营养风险筛查。筛查方法强调简便、快捷和灵敏。目前常用的营养筛查工具包括:营养风险筛查2002 (Nutritional Risk Screening 2002,NRS 2002)、主观整体评估(Subjective Globe Assessment,SGA)、患者主观整体评估(Patient-Generated Subjective Global Assessment,PG-SGA)、微型营养评估(Mini Nutritional Assessment,MNA)、营养不良通用筛查工具(Malnutrition Universal Screening Tools,MUST)等。国内以NRS2002、PG-SGA应用较多。
NRS2002:由丹麦肠外肠内营养协会发展,ESPEN、中华医学会肠外肠内营养学分会(Chinese Society for Parenteral and Enteral Nutrition,CSPEN)推荐使用。其适用对象为一般成年住院患者。该评估方法建立在循证医学基础上,简便易行。具体步骤包括:①初步营养风险筛查,要求回答4个问题:BMI<18.5kg/m2吗?过去3个月有体重下降吗?在过去的1周内有摄食减少吗?有严重疾病吗?②再次营养风险筛查,对上述4个问题有任何一个肯定回答者需要接受再次营养风险筛查,具体内容包括疾病严重程度评分,营养状态受损评分及年龄评分三项。总分≥3分提示营养风险存在。
PG-SGA:是在SGA基础上发展而成的,专门为肿瘤患者设计的营养状况评估方法。由患者自我评估及医务人员评估两部分组成,具体内容包括体重、摄食情况、症状、活动和身体功能、疾病与营养需求的关系、代谢方面的需要、体格检查7个方面,前4个方面由患者自己评估,后3个方面由医务人员评估,最后结果包括定性评价及定量评价两种。研究显示,PG-SGA是一种有效的肿瘤患者特异性营养状况评估工具,是ADA推荐用于肿瘤患者营养筛查的首选方法,中国抗癌协会肿瘤营养与支持治疗专业委员会推荐使用。
营养评定
通过营养风险筛查,确定患者存在营养风险,但同时存在代谢或功能方面的障碍,或无法确定患者是否存在营养风险时,应该对患者实施进一步的营养评定,内容如下:
1. 病史:询问病史、肿瘤类型、病理诊断、临床分期、并存疾病、治疗反应、既往病史、饮食改变、体重变化、身体功能变化、胃肠道症状、用药情况、经济状况等,了解患者的营养需求,找出营养不良的可能原因,判断患者对营养治疗的接受程度及可能效果。
2. 体格检查:观察脂肪组织、肌肉组织消耗程度,水肿和腹腔积液,头发和指甲的质量,皮肤和口腔黏膜等,有助于评价能量和蛋白质缺乏的严重程度。
3. 实验室检查:主要检测血常规、肝功能、肾功能、血脂谱、血浆蛋白、CRP、免疫功能、矿物质和维生素水平等。
4. 人体测量:动态监测体重是最方便、最直接的方法,但易受干扰,如液体潴留、患者昏迷、瘫痪、水肿、巨大肿瘤等。另外,很多患者往往难以追溯末次准确称量的时间和具体数值。其他指标有BMI、上臂围、小腿围、肱三头肌皮褶厚度(triceps skinfold,TSF)、上臂肌围(arm muscle circumference,AMC)、日常活动能力、握力、体力活动受限程度、液体平衡与组织水肿等。
5. 人体成分分析:包括体脂肪量、体脂肪率(%)、非脂肪量、肌肉量、推定骨量、蛋白质量、水分量、水分率(%)、细胞外液量、细胞内液量、基础代谢率、内脏脂肪等级、体型等。
营养治疗
针对营养不良的发生机制给予合理的营养支持与治疗,有利于改善营养状态、防止进一步恶化,预防临床并发症,减少治疗失败率,改善机体代谢紊乱及可能的心理问题,降低医疗费用,从而达到提高生活质量、改善临床结局的总效应。但值得注意的是,应早期发现或预测患者可能存在的营养问题,及时给予科学的营养建议及治疗,才能够产生疗效,如果患者已经出现严重的代谢紊乱、恶液质情况,营养支持治疗难以逆转病情。因此,预防恶液质的发生比纠正恶液质更为重要。去除病因的治疗,是解决疾病相关营养不良的关键所在。
大量的临床前研究、随机对照临床研究及Meta分析结果显示,营养支持与治疗可使患者获益。例如,数个Meta分析结果显示对于存在营养不良及营养风险的住院患者给予经口营养支持治疗,可以明显降低死亡率及合并症的发生率;在多个临床指南中列举了大量存在营养风险或营养不良的肿瘤患者给予营养支持治疗的循证医学证据。
对于恶液质相关营养不良的治疗,仅给予足够的能量-蛋白质摄入是远远不够的;在营养支持治疗的基础上联合应用药物,如增加食欲药物、抑制炎症介质药物等,可有一定效果,但仍需更多、更确切的临床研究来验证;对恶液质相关营养不良最有效的治疗是去除病因的治疗,即治疗疾病本身,如抗肿瘤治疗等。
恶性肿瘤的本质是一种慢性、低度、持续、不可逆的炎症反应,是一种以代谢适应不良为特征的异常代谢综合征,所以治疗肿瘤患者的营养不良应该多管齐下,具体包括:抗肿瘤,代谢调节,抑制炎症及营养支持(补充与治疗)4个对策。目前对于癌性恶液质疗效证据最充分的药物是甲地孕酮和糖皮质激素,一段时间内可维持患者体重、增加食欲、提高生活质量,主要机制是抑制炎症介质;另外其他一些药物如ω-3脂肪酸、沙利度胺、非甾体抗炎药、环氧化酶-2(cyclooxygenase,COX-2)抑制剂、IL-6单克隆抗体等,都是可能对癌性恶液质潜在有效的治疗药物,但尚需更多、更大型、更好的临床研究来验证。
小结
肿瘤相关性营养不良是多种因素共同作用的结果,包括肿瘤的全身和局部影响、宿主对肿瘤的反应以及抗肿瘤治疗的干扰,而摄入减少、吸收障碍、代谢紊乱、静息能量消耗增加是营养不良的主要原因。肿瘤本身产生或应答产生的物质,如促炎症因子(IL-1、 IL-6、TNF-α和IFN-γ)、激素(黑皮质素、胰岛素、氢化可的松和胰高血糖素)、肿瘤衍生多肽(PIF和LMF)在肿瘤恶液质中发挥重要作用。癌性恶液质是肿瘤相关营养不良的一种特殊表现形式,难以用常规营养支持治疗所纠正,恶液质、营养不良恶性循环。存在营养不良、恶液质的肿瘤患者对抗癌治疗的耐受力及敏感性下降、并发症增多、医疗花费增多、生存时间缩短。因此,对肿瘤患者应该常规进行营养筛查与评估,尽早发现营养风险及营养不良,并及时给予营养治疗。防治肿瘤营养不良及恶液质要多管齐下:确切的抗癌治疗是前提,规范的营养支持是基础,合理的代谢调节是关键,有效的炎症抑制是根本。
思考题答案
1. 目前研究显示,PG-SGA是一种有效的肿瘤患者特异性营养状况评估工具,是美国营养师协会推荐用于肿瘤患者营养筛查的首选方法,中国抗癌协会肿瘤营养与支持治疗专业委员会推荐使用。按照PG-SGA评价标准,患者定量评分≥9分,为重度营养不良,需要营养治疗。
2. 该患营养不良的原因主要有:①肿瘤相关症状:主要是肠梗阻,导致患者进食明显减少,伴有恶心、呕吐,这是导致该患营养不良的主要因素之一。②肿瘤所致能量及物质代谢紊乱:患者为进展期胃癌,静息能量消耗明显增加,由肿瘤细胞产生及宿主炎症反应产生的炎症介质介导的代谢亢进,表现为胰岛素抵抗、糖耐量下降、糖异生增加、糖原利用下降、脂肪分解增加、脂肪合成减少、肌蛋白质分解增加、急性反应期蛋白合成增加、低蛋白血症、负氮平衡,最终导致患者体重下降、营养不良、恶液质。这是患者营养不良的另一主要原因。
3. 根据2011国际恶液质专家共识提出的具体诊断标准为:无节食条件下,6月内体重下降>5%,或BMI<20(中国人<18.5)和任何程度的体重下降>2%,或四肢骨骼肌量指数符合肌肉减少症标准(男性<7.26kg/m2,女性<5.45kg/m2)及任何程度的体重下降>2%。该患符合前两条诊断标准,故为恶液质状态。恶液质是疾病相关营养不良的特殊类型,多数情况下,患者处于较严重的营养不良状态。
(王畅 李薇)
