病例与思考
患者,女性,63岁,确诊为小细胞肺癌广泛期,伴肝脏及椎骨多发转移。因咳嗽、咯血加重1周入院。饮食以半流食为主,可进食少量固体食物,总摄入量较平时明显减少,近期体重有所下降,3个月体重减轻5kg。查体:发育正常,营养中等,双下肢轻度水肿,轻度贫血貌,浅表淋巴结未触及肿大,腹平坦,触诊稍韧,上腹部轻压痛,无反跳痛及肌紧张,肝肋下3cm,剑突下5cm,移动性浊音阳,余查体未见异常。身高162cm,体重47kg。
- 该患者体重减轻的原因主要有哪些?
- 对该患者进行营养支持治疗是否会改善患者的预后?
- 针对该患者除了营养支持治疗,还有哪些治疗措施?
概述
人体因疾病或某些因素导致脂肪与蛋白质减少,体重减轻超过正常标准10%以上时,即称为消瘦,是恶液质最常见的临床表现之一(图6-3-1)。
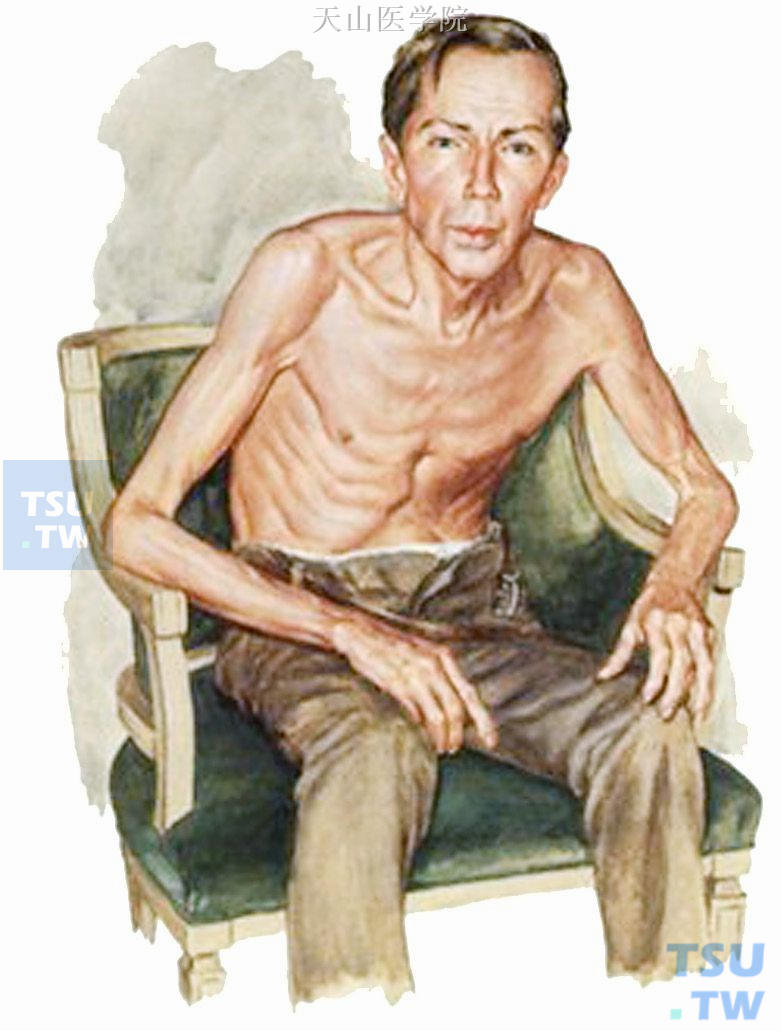
图6-3-1 恶液质患者的消瘦状态
体重减轻是任何急性或慢性疾病发生进展时非常重要的标志,当发生非常严重的体重减轻如骨骼肌及脂肪的减少时,常提示发生了恶液质,预后不良。
恶液质不同分期时,体重减轻的程度有所不同,恶液质前期时体重减轻一般≤5%,恶液质期时,体重减轻常>5%或>2%并伴有其他体质指数的异常或肌肉减少。
病因及发病机制
在所有导致恶液质发生的疾病中,最主要的是肿瘤性疾病,且无论肿瘤类型如何,39%~82%的肿瘤患者会发生不同程度的体重减轻,尤其是胰腺癌、胃癌、结直肠癌等消化系统肿瘤。此外还包括AIDS、慢性心力衰竭、慢性肾功能衰竭、类风湿关节炎、结核、慢性阻塞性肺病等慢性疾病均可以引起消瘦。
无论什么病因,当恶液质发生、机体出现消瘦时,主要是由于营养摄入不足及代谢异常这两大因素,导致体重减轻(图6-3-2)。
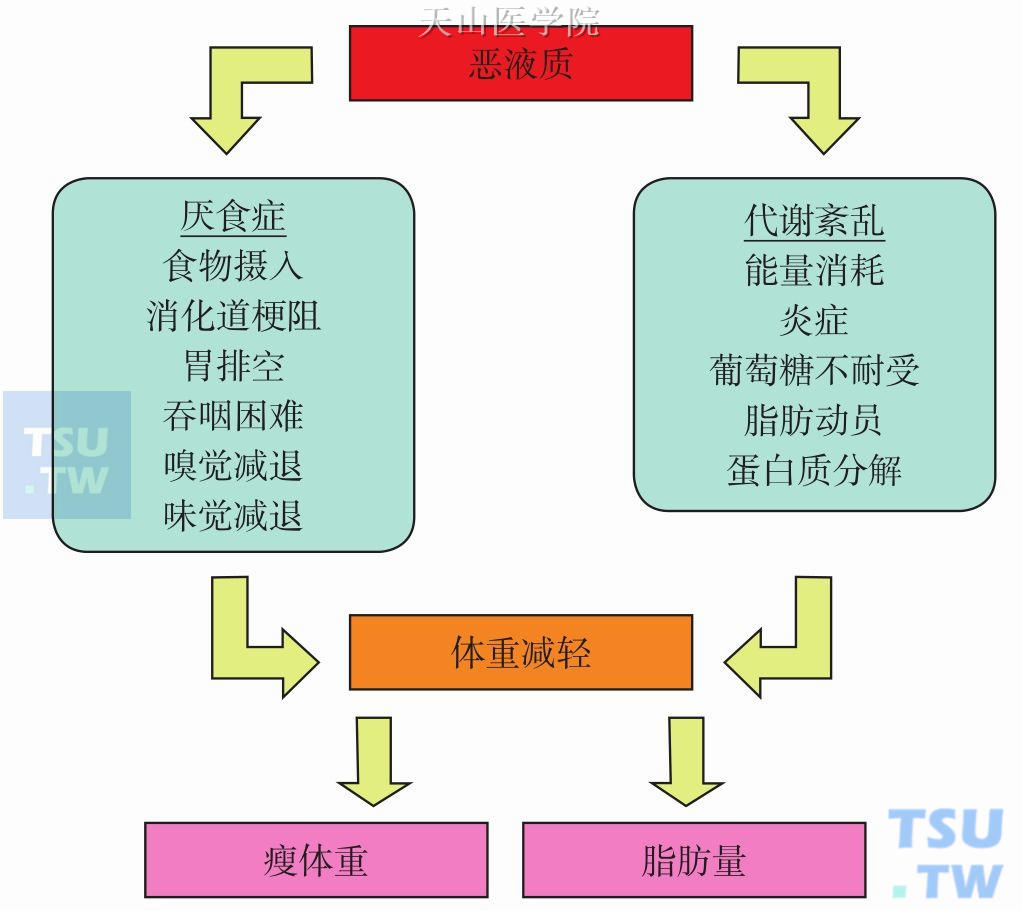
图6-3-2 恶液质患者体重减轻的原因
营养摄入不足
营养摄入不足的原因主要有食欲减退及消化、吸收不良。
1. 食欲减退
食欲减退在发生恶液质的患者中很普遍,30%~80%的肿瘤恶液质患者存在食欲减退,也是引起营养摄入不足的主要原因。导致食欲减退的原因主要有以下几点:
(1) 细胞因子的作用:恶液质发生时,各种原因如肿瘤和炎症等刺激免疫系统产生促炎性细胞因子以及肿瘤相关糖蛋白,如IL-1、IL-6、肿瘤坏死因子α(TNF-α)、α干扰素(interferon-α)以及β干扰素(interferon-β)等。而肿瘤本身也可以释放一些因子,如PIF、LMF等。这些细胞因子透过血-脑屏障作用大脑表面的内皮细胞来影响食欲。已发现在下丘脑区域存在TNF-α和IL-1的受体调节食欲。最近还发现在肿瘤患者中食欲减退及体重减轻的发生与转化生长因子(TGF)-β超家族成员巨噬细胞抑制因子-1(MIC-1)有关。细胞因子的作用是恶液质患者发生食欲减退最主要的原因(图6-3-3)。
(2) 局部作用:口腔、咽、喉、食管、贲门病变致吞咽困难,影响进食,肿瘤的局部压迫导致患者常出现早饱感,在进食少量食物后就会感觉到饱胀,特别是消化道肿瘤造成的压迫、梗阻、损伤及胃大部切除术后以及胃肠道的长期慢性炎症,会引起食欲减退,从而造成营养摄入不足。
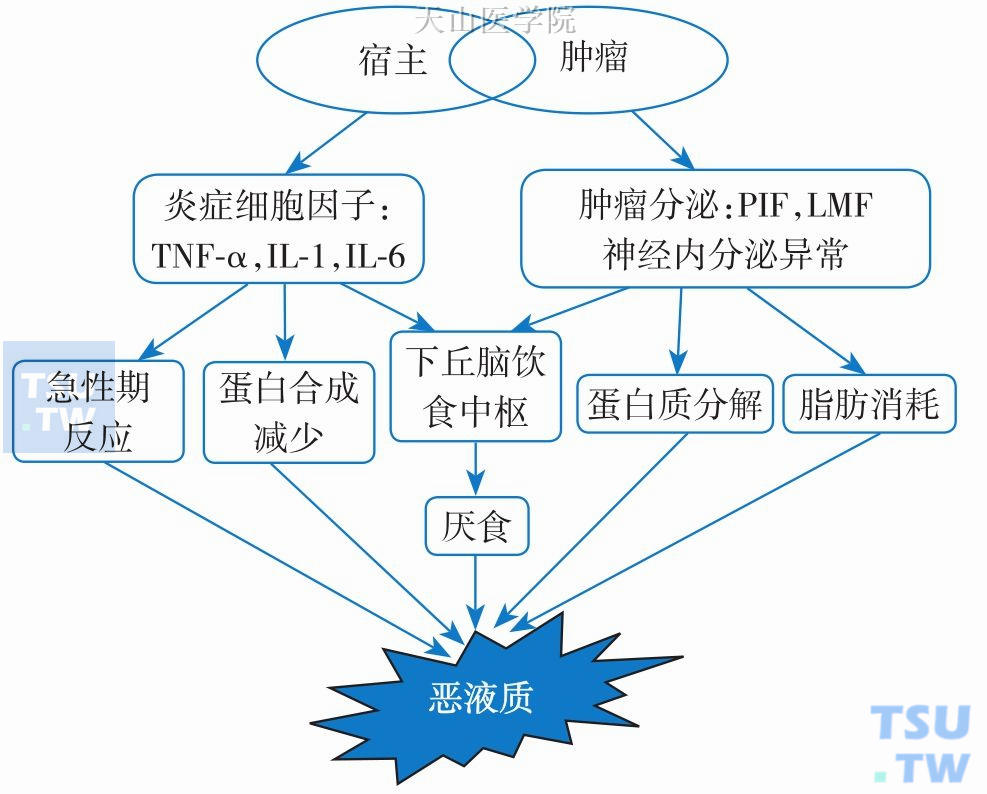
图6-3-3 恶液质患者发生食欲减退的分子机制
(3) 治疗相关的因素:如放疗、化疗等会引起恶心、呕吐,从而加重食欲减退,导致食物摄入减少,此外文献报道肠道术后患者进行肠外营养也是导致此部分患者食欲减退的重要原因。但在一项66名肿瘤患者的观察研究中发现,有61%的患者在没有接受化疗的情况下,在晚期仍出现明显的食欲减退,可见肿瘤仍是导致肿瘤患者食欲减退的独立因素,化疗引起的食欲减退在化疗结束可以逆转,但肿瘤对食欲的影响很难逆转。
(4) 精神心理因素:情绪波动、抑郁以及社会和经济因素也可能导致进食减少,往往也会影响患者的食欲从而导致食物摄入减少。
(5) 慢性疾病:重要脏器慢性病变或功能衰竭如肝功能损伤所致的腹胀、肾衰竭尿毒症均可导致食欲缺乏。
2. 消化、吸收不良
肿瘤、肠道慢性炎症及放化疗的刺激导致的恶心、呕吐,会导致营养物质以及胃液的丢失,重要脏器慢性病变或功能衰竭如心脏功能衰竭致肝脏及胃肠道充血、水肿,慢性肺心疾患致组织缺血、缺氧、严重肝病如肝硬化门脉高压所致的胃肠道淤血、水肿,肝功能损伤所致的腹胀、恶心、甚至呕吐、低蛋白血症,肾衰竭尿毒症所致的恶心、呕吐等导致营养物质消化、吸收不良。
代谢紊乱
食物摄入减少与体重减轻常伴随发生,但它不是造成体重减轻的最主要原因,恶液质时体重减轻的另一个更重要的原因是代谢紊乱。
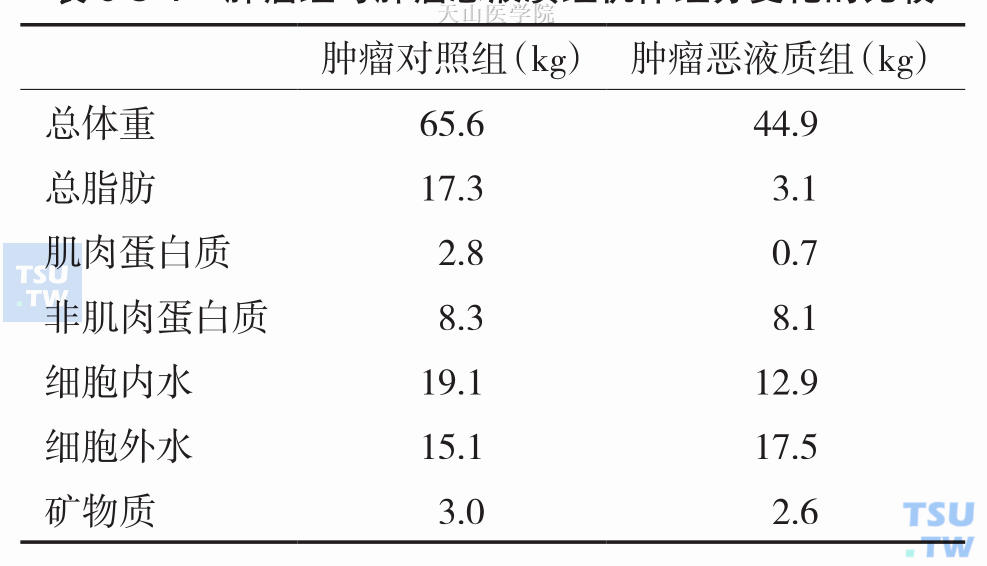
在一项297名实体肿瘤患者的临床观察中发现,患者体重减轻并不是单纯由食欲减退导致的食物摄入减少所引起,因为与体重保持稳定的对照组相比,体重减轻的肿瘤患者的总能量摄入并不少,反而比对照组多,但增加饮食摄入并没有逆转体重减轻的状况,动物实验也得出了相同的结论。事实上,与单纯的饥饿导致的体重减轻的机制不同,恶液质患者体重减轻时机体各组织成分的变化与创伤和感染时发生的变化相似,饥饿时消耗的主要为脂肪组织,肌肉的消耗比较少,而恶液质时机体脂肪组织及骨骼肌的大量消耗而非肌肉蛋白部分却被储存下来,脂肪组织和骨骼肌的消耗会随着疾病的加重而增加,这也是患者疾病晚期机体活动性差、生活质量下降、生存期短的主要原因。如表6-3-1中列出了一组发生了恶液质的肺癌患者,机体组分发生的变化。与同年龄、性别、身高但未发生恶液质的肺癌患者的比较,这些患者的体重均较病前组减轻了30%。
表6-3-1 肿瘤组与肿瘤恶液质组机体组分变化的比较
目前认为恶液质患者机体代谢率异常增高,合成代谢减少,分解代谢增加,导致机体进行性能量缺乏和自身组织不断消耗,最终导致体重减轻甚至消瘦。
代谢紊乱主要表现在以下几个方面:
一、糖代谢异常
恶液质患者的糖代谢异常主要体现在糖代谢调节作用丧失,胰岛素抵抗,生长激素和甲状腺素升高,胰岛素升高、葡萄糖摄取增加、葡萄糖需要量和碳水化合物氧化增加。分为宿主和肿瘤两方面:①宿主方面:胰岛素分泌下降、胰岛素抵抗和部分高血糖;葡萄糖利用减少;Cori循环增强,葡萄糖和ATP无效消耗增加;肝糖异生增强,并失去葡萄糖对其抑制,无效耗能增加;肝糖原合成减少。②肿瘤方面:对葡萄糖摄取增加;糖有氧酵解增强,耗氧减少;氧化磷酸化降低;葡萄糖产能效率低;乳酸产生和释放增加;磷酸戊糖通路增强。
糖代谢异常的主要机制为:肿瘤细胞在线粒体氧化磷酸化途径供给ATP不足时,将转而更多依赖糖酵解供能来满足其快速生长的需要,甚至在有氧环境下,肿瘤细胞优先进行糖酵解,并产生大量的乳酸,大部分肿瘤细胞都是利用糖酵解来获得ATP,这种现象被称作瓦氏效应。这是因为肿瘤细胞生长迅速,常需大量葡萄糖分解以提供能量,另外,肿瘤细胞繁殖需要大量的ATP以供应其合成RNA和DNA。而肿瘤尤其是实体瘤常存在缺氧的微环境,因此有些肿瘤甚至在氧气充足的情况下亦以无氧酵解为主。研究发现,除了肿瘤微环境的改变外,尚有基因突变或表达异常如原癌基因Ras、Myc 等的过表达;抑癌基因如P53等突变或活性降低;线粒体DNA 突变引起线粒体氧化磷酸化呼吸功能下降等;早期致癌因子诱发许多糖代谢的关键酶或载体活性/数量的改变,其中最重要的是己糖激酶Ⅱ(hexokinase,HK-Ⅱ)、ATP、柠檬酸水解酶(ATP-citrate lyase,ACL)和丙酮酸脱氢酶激酶(Pyruvate Dehydrogenase Kinases,PDK)。它们协同作用使肿瘤细胞以低效率的糖酵解来获取能量,而糖酵解除了直接启动肿瘤细胞对营养物质的摄取来为肿瘤细胞提供自主、直接的营养物质外;还可促进缺氧诱导因子1(hypoxia inducible factor-1,HIF-1)表达,通过其下游的信号传导途径促进肿瘤细胞增殖、启动肿瘤血管新生、躲避细胞凋亡程序等,同时HIF-1反过来可直接促进肿瘤细胞糖酵解,进而形成恶性循环。与充分氧化情况下的三羧酸循环途径相比,肿瘤细胞的生长需要高于正常40倍的葡萄糖。与正常组织相比,肿瘤细胞摄取葡萄糖的速率远远大于正常组织。
此外,乳酸从肿瘤组织来到肝脏,被重新合成葡萄糖,这是另一个不完全的过程,这个过程被称为乳酸循环,需要6mol ATP和2mol乳酸来生成1mol葡萄糖。与正常人相比,体重减轻的转移性结直肠癌患者的葡萄糖的生成率和再循环率显著的增高,而乳酸循环会造成肿瘤患者每天300kcal的额外能量消耗。
二、脂肪的代谢异常
恶液质患者的脂肪代谢异常主要体现在内源性脂肪动员增加、脂肪氧化增加、合成减少、脂肪酸氧化增加、甘油三酯转化率增高等。
一组有关肺癌患者身体成分的分析显示,当体重下降30%时,总脂肪量下降达85%,主要原因为脂肪细胞内脂肪分解增加,而且当脂肪量丢失达40%时,脂肪分解活动增加两倍,抑制激素敏感性脂肪酶(hormone sensitive lipase,HSL)和脂肪分解限速酶可使其减弱。恶液质患者体内的脂肪细胞HSL mRNA增加50%,导致脂肪分解增加、脂肪酸氧化增加,引起机体的储存脂肪下降,这是体重丢失的重要原因。
肿瘤状况下,脂肪酸是宿主利用的主要能源物质,肿瘤释放LMF,导致脂肪动员增加,对脂类的利用增加,当脂肪分解增加时,由脂肪分解而来的脂肪酸经过酯化转变为甘油三酯,整个过程需要消耗大量能量,这也是间接导致机体能量消耗的原因。
脂肪代谢的改变在肿瘤发生早期就已经存在,在体重丢失前已经存在了游离脂肪酸活动增加的表现,即使在此时给予外源的营养支持治疗,也很难抑制体内脂肪的持续分解以及氧化。
三、蛋白质及氨基酸代谢异常
肿瘤恶液质患者蛋白质及氨基酸的代谢异常主要表现为肌肉蛋白质合成的减少、分解增加,蛋白质转化率增高、低蛋白血症、内脏蛋白分解、负氮平衡等。
肿瘤恶液质患者的消瘦与正常非肿瘤患者发生消瘦时的代谢模式不同,肿瘤恶液质患者发生消瘦时,机体总的蛋白分解会明显增加,而且随着疾病的进展,蛋白质的分解速度会逐渐加快。骨骼肌约占人体体重的40%,是肿瘤患者内源性蛋白质丢失的主要场所,骨骼肌蛋白消耗的增加是导致肿瘤患者消瘦的重要原因。
肿瘤恶液质患者的肌肉蛋白合成减少,相反肝脏蛋白的合成速度却会明显增加,主要是纤维蛋白原以及急性期反应蛋白,这就意味着对氨基酸的需要进一步增加,这也会导致骨骼肌的进一步消耗,这样就引起了机体储备的氨基酸消耗进一步增加,这与患者体重减轻的程度、高代谢、肿瘤的复发率以及生存率的降低明显相关。此外肿瘤患者的蛋白质代谢改变可导致血浆氨基酸谱的变化如血浆色氨酸浓度的增高,色氨酸是大脑五羟色胺的前体物质,在进行性消瘦的患者中,色氨酸浓度增加,会刺激下丘脑饱食中枢,引起厌食,从而加重肿瘤患者的消瘦。
骨骼肌的蛋白分解代谢主要有四种通路:①溶酶体蛋白酶途径;②钙依赖的蛋白酶途径;③ATP-泛素-蛋白酶体途径;④非ATP依赖途径。在这四条通路中,ATP-泛素-蛋白酶体途径是大多数蛋白质分解最重要的通路,尤其是在消瘦的肿瘤患者中更加重要。目前认为细胞因子TNF-α、IL-1、IL-6、 IFN-α和蛋白降解诱导因子(PIF)等参与ATP-泛素-蛋白酶体途径的激活。另外,该途径的激活也与细胞信号传导通路之间的互相调节有关。
治疗
对于恶液质患者,体重减轻会影响患者的治疗反应,同时也严重影响到患者的预后及生活质量,约半数肿瘤患者出现体重减低,而肿瘤性体重下降的总发生率在临终前1~2周可达86%,每个月体重下降>2.75%是影响预后生存的独立指标。正确适当的治疗及护理不仅可以改善患者的营养状态,调节患者的心理和精神状态,提高患者的生存质量,同时能够延长患者的生存期,良好的营养状态也为进一步治疗提供了更好的基础营养支持,使患者的病情在一定程度上得到缓解。
针对恶液质导致的消瘦,最好的治疗方法就是病因治疗,消除引起恶液质的原因,此外还包括营养支持治疗、抑制炎症反应、代谢调节剂、免疫调节剂等治疗方法。
病因治疗
消除引起恶液质的原因,治疗原发病如抗肿瘤治疗、控制炎症反应、治疗脏器衰竭等。
营养支持治疗
主要是营养物质的补充和食欲刺激。
1. 营养物质的补充:主要是三大营养物素包括蛋白质、脂肪和糖类的补充,但大量营养干预的随机对照临床研究显示增加营养摄取并不能使体重增加、改善生活质量或生存期,因此目前对营养补充疗法的重视程度正逐渐下降。
2. 食欲刺激剂:此类药物通过改善患者的食欲增加饮食的摄入,与营养物质补充类似,对体重增加的作用有限。
(1) 孕激素类药物:为食欲刺激剂的首选药物,包括甲地孕酮和甲羟孕酮,为最早应用于临床也是最能够有效增加肿瘤患者体重、改善厌食等恶液质表现的药物,其改善食欲、增加体重的作用比较确切,但其不能增加肌肉的重量,对生存期也无明显改善。
(2) 皮质激素类药物:常用药物为糖皮质激素,它通过抑制TNF-α抑制前列腺素合成。然而大多数研究表明地塞米松仅在短期内可以明显地改善恶液质的各种症状,但很少有体重明显增加。泼尼松或其等效制剂改善食欲、短期内增加体重的作用比较明确,此外还可应用甲泼尼龙。
(3) 促胃肠动力药物:如甲氧氯普胺(胃复安),为多巴胺受体拮抗剂,对于改善肿瘤恶液质患者长期的恶心、呕吐、早饱感等症状可能有效,尤其适用于自主神经功能紊乱和接受阿片类治疗的患者,但需注意其用量过大时易引起锥体外系反应。
抑制炎症反应
包括抑制细胞因子分泌的药物如乙酮可可碱、褪黑激素、COX-2抑制剂和影响细胞因子活性的药物如抗细胞因子抗体、苏拉明、抗炎细胞因子等。但许多针对TNF-α、IL-1和IL-6等细胞因子的抗体或受体拮抗剂及阻断剂类药物尚处于动物模型的治疗研究中,应用于人体的临床获益目前并不理想,要得到封闭细胞因子作用的疗效往往需要超大剂量的抗体,而其昂贵的花费也限制了其临床应用。
代谢调节剂
作用相对确切的药物有二氯乙酸(dichloroacetic acid,DCA)和沙利度胺。沙利度胺具有较强的抑制血管新生和免疫调节作用,能通过促进TNF-α mRNA的降解从而降低TNF-α的蛋白合成,有效抑制单核细胞释放TNF-α,降低体循环TNF-α水平而改善因体内TNF-α升高所致的代谢紊乱。沙利度胺还能有效减少肿瘤患者放化疗所致的恶心、呕吐,并有助于改善睡眠质量、增加食欲。2003年Khan的一项临床研究显示沙利度胺可以减少食管癌患者的体重丢失。
免疫调节剂
主要有精氨酸、谷氨酰胺和ω-3脂肪酸。精氨酸可以刺激胰岛素和生长激素的释放,从而促进蛋白质的合成,还可以提高免疫水平,增加合成代谢。谷氨酰胺是蛋白、核酸合成的重要前体,参与蛋白的合成,它可以提高机体的免疫功能。ω-3脂肪酸,主要包括二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA),具有抑制蛋白水解,降低炎症因子的产生,稳定急性期反应蛋白的作用,可以阻断肌肉蛋白的分解,此外,EPA可以抑制肿瘤的活性,增强抗肿瘤效应同时减轻抗肿瘤治疗的副作用。
小结
消瘦是恶液质重要的临床表现之一,随着疾病的进展而逐渐加重。肿瘤是导致恶液质发生最主要的原因,肿瘤恶液质患者发生体重减轻主要是营养摄入减少以及恶液质状态下代谢的异常造成。患者摄入减少,能量消耗增加,更重要的是肿瘤患者脂肪组织及骨骼肌蛋白的大量消耗,这是造成肿瘤患者体重减轻的最主要原因。它的发病机制也比较复杂,是肿瘤与宿主之间相互作用的结果。对于消瘦的治疗主要通过治疗原发病、营养支持治疗、控制炎症反应、代谢调节和免疫调节等方面的治疗。恶液质患者消瘦时机体器官的功能会受到严重影响,生活质量较差,生存期短,而消瘦本身也是构成肿瘤患者死亡一个原因,严重影响了患者的生存和预后,因此应当给予足够重视,尽早给予治疗。
思考题答案
1. 该患者体重减轻的原因主要是营养摄入不足,最主要的是食欲减退及消化、吸收不良,此外该患者为肿瘤四期的患者,存在恶液质,机体代谢率异常增高,合成代谢减少,分解代谢增加,导致机体进行性能量缺乏和自身组织不断消耗,最终导致体重减轻。
2. 大量营养干预的随机对照临床研究显示增加营养摄取并不能使体重增加、改善生活质量或生存期,因此单纯进行营养支持治疗并不能改善患者的预后,还需要其他的治疗措施。
3. 治疗原发病抗肿瘤治疗,此外还包括抑制炎症反应、代谢调节剂、免疫调节剂等治疗方法。
(韩薇 李薇)
