病例与思考
患者,女,46岁,极度消瘦,因反复呕吐入院。患者意识清楚,但是不愿意讲话。患者体重下降明显,在过去的4天内未进食。一年前患者体重为56kg,她的丈夫不清楚患者现在的体重,但他说最近几个月,患者吃的很少。她的衣服都太大了,不合身。患者胃肠消化功能没有太大的变化,常常感到饥饿,但是进食后感觉腹胀,呕吐明显,以至于不能正常进食,只能进食少量流质。患者自觉口干舌燥。患者活动明显不如平常,卧床4天。体格检查发现患者虚弱,几乎触不到体脂和肌肉。患者口唇异常红润,头发干枯易脱落。皮肤干燥。身高159cm,体重40kg。胃镜提示胃癌并幽门完全梗阻,留置胃管,引流出胃液500ml。
- 该患者目前是否处于恶液质状态?
- 该患者营养支持的处方如何开出?
蛋白质代谢特点
恶液质是摄食减少,代谢异常等因素综合作用引起的蛋白质及能量负平衡,以骨骼肌块持续下降为特征。骨骼肌减少的具体诊断标准为:人体学测量上臂中点肌肉面积(男性<32cm2,女性<18cm2),双能X线吸收测量(dual energy x-rayabsorptiometry,DEXA),四肢骨骼肌量指数(appendicular skeletal muscle index)(男性<7.26kg/m2,女性<5.45kg/m2),CT测量腰椎骨骼肌指数(lumbar skeletal muscleindex)(男性<55cm2/m2,女性<39cm2/m2),生物电阻抗(bioelectrical impedance)测量身体不含骨量的无脂肪块指数(男性<14.6kg/m2,女性<11.4kg/m2)。Fearon K等认为骨骼肌减少的诊断应该根据不同性别正常参考值及标准体重进行标化,但是绝对肌肉量(absolute muscularity)低于正常值下限5个百分点是一个普遍认可的通用诊断标准。在水肿、巨大肿瘤及肥胖情况下,推荐直接测量肌肉量。
肿瘤条件下,骨骼肌减少的原因包括摄食减少以及肿瘤导致的异常代谢,后者作用更大。图10-5-1简要说明了肿瘤恶液质条件下骨骼肌代谢的调节特征。生理条件下,即使没有刺激(如运动),肌肉块仍然保存相当的稳定,蛋白质合成代谢与分解代谢保持平衡。肿瘤条件下,骨骼肌的平衡向蛋白质分解方向移位,最终导致体重下降、软弱无力、疲劳。近年来的研究表明:分解代谢因素如细胞因子、肌肉生长抑制素(myostatin)、泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)家族等是骨骼肌消耗的上调因素,合成代谢因素如胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)等是骨骼肌消耗的下调因素。
研究发现,肿瘤患者的骨骼肌耗损、体重丢失与血浆细胞因子尤其是白介素6(interleukin-6,IL-6)升高及急性期蛋白出现呈显著的正相关,作为系统性免疫的一部分,IL-6刺激肝细胞合成急性期蛋白,后者包括纤维蛋白原(fibrinogen)及血清淀粉样蛋白A(serum amyloid A,SAA)。Bonetto A等在结肠-26(Colon-26,C26)肿瘤恶液质小鼠模型上发现:接种C26肿瘤细胞后第19天,小鼠体重丢失10%,小鼠处于中度恶液质状态;接种后第24天,体重丢失15%,小鼠处于重度恶液质状态;股四头肌和腓肠肌重量下降;随着恶液质严重程度增加、病程延长,小鼠肝脏重量及肿瘤重量增加。中度及重度恶液质伴随血浆IL-6及IL-6家族细胞因子水平升高,骨骼肌基因表达表型相同;补体/凝血瀑布、蛋白酶体、MAKP信号、IL-6及STAT3等经典通路上调;肌肉pY705-STAT3升高,肌肉再生核(myonuclei)STAT3富聚。处于恶液质状态下的肌肉,STAT3目标基因(包括SOCS3 mRNA)及急性期反应蛋白高度可诱导;IL-6治疗及STAT3激活可以诱导体外培养C2C12肌管产生纤维蛋白原。研究结果提示:STAT3转录组(transcriptome)是肿瘤肌肉消耗的一个主要机制,通过IL-6/STAT3激活,骨骼肌被诱导产生急性期蛋白、从而构成IL-6升高、急性期反应蛋白升高与骨骼肌耗损的分子机制。
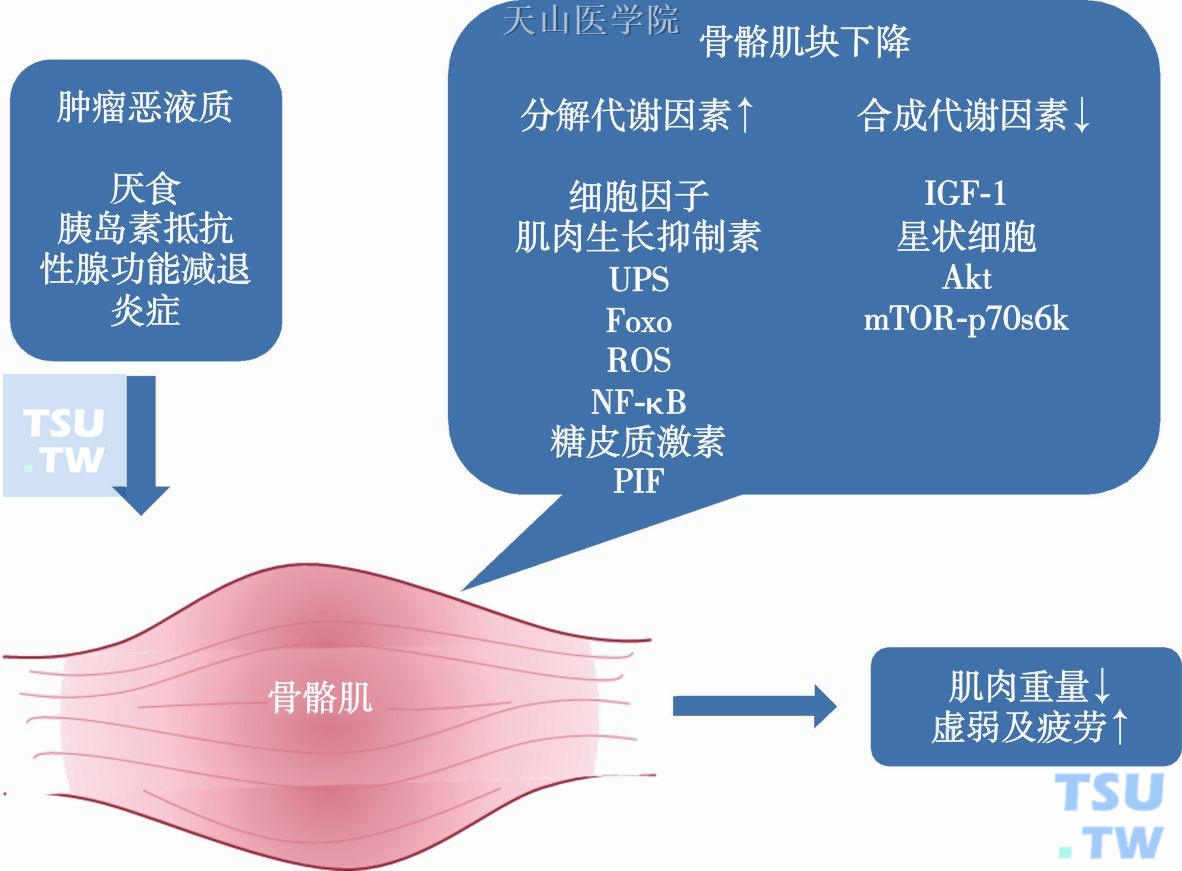
图10-5-1 肿瘤恶液质条件下骨骼肌的代谢调节
IGF-1,Insulin-like growth factor 1,胰岛素样生长因子1;FoxO forkhead box O,O型叉头框;UPS ubiquitin-proteasome system,泛素-蛋白酶体系统;ROS reactive oxygen species,活性氧家族;NF-κB,nuclear factor kappa-light-chain-enhancer of activated B cells,核因子活化B细胞κ轻链增强子;PIF,proteolysis-inducing factor,蛋白质水解诱导因子;mTOR mammalian target of rapamycin,哺乳动物西罗莫司靶向基因;p70S6K,Ribosomal protein 70 S6 kinase,核糖体蛋白70 S6蛋白激酶;Akt,also known as Protein Kinase B (PKB),蛋白激酶B
肿瘤恶液质条件下,不仅肌肉形态、肌肉重量发生变化,肌肉有氧功能及线粒体酶学也发生变化。研究发现,肿瘤条件下肌肉丙酮酸脱氢酶激酶同工酶4(pyruvate dehydrogenase kinase isozyme 4,PDK4)活性增强,使丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)失活,PDH活性下降使丙酮酸向乙酰辅酶A(acetyl-CoA)转化减少,ATP产生从而减少。Phillips BE等观察了一组结肠癌患者手术前后股外侧肌线粒体功能变化,发现与健康志愿者相比,结肠癌患者PDH活性显著下降,NF-κB显著升高,肿瘤根治术后6周PDH活性及NF-κB均恢复正常(图10-5-2,图10-5-3)。
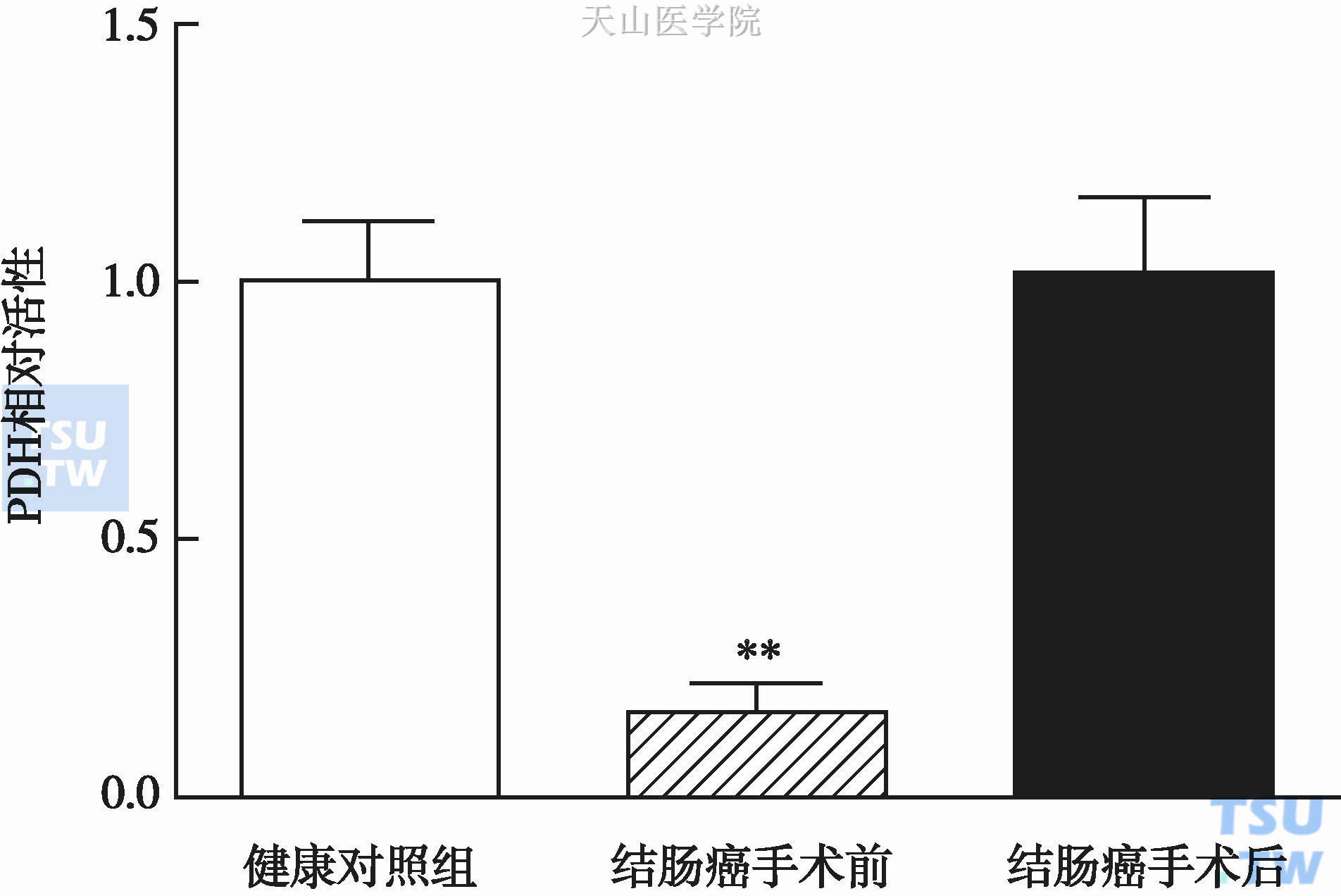
图10-5-2 结肠癌患者手术前后肌肉PDH活性变化
** P<0.001,与健康志愿者对照组比较
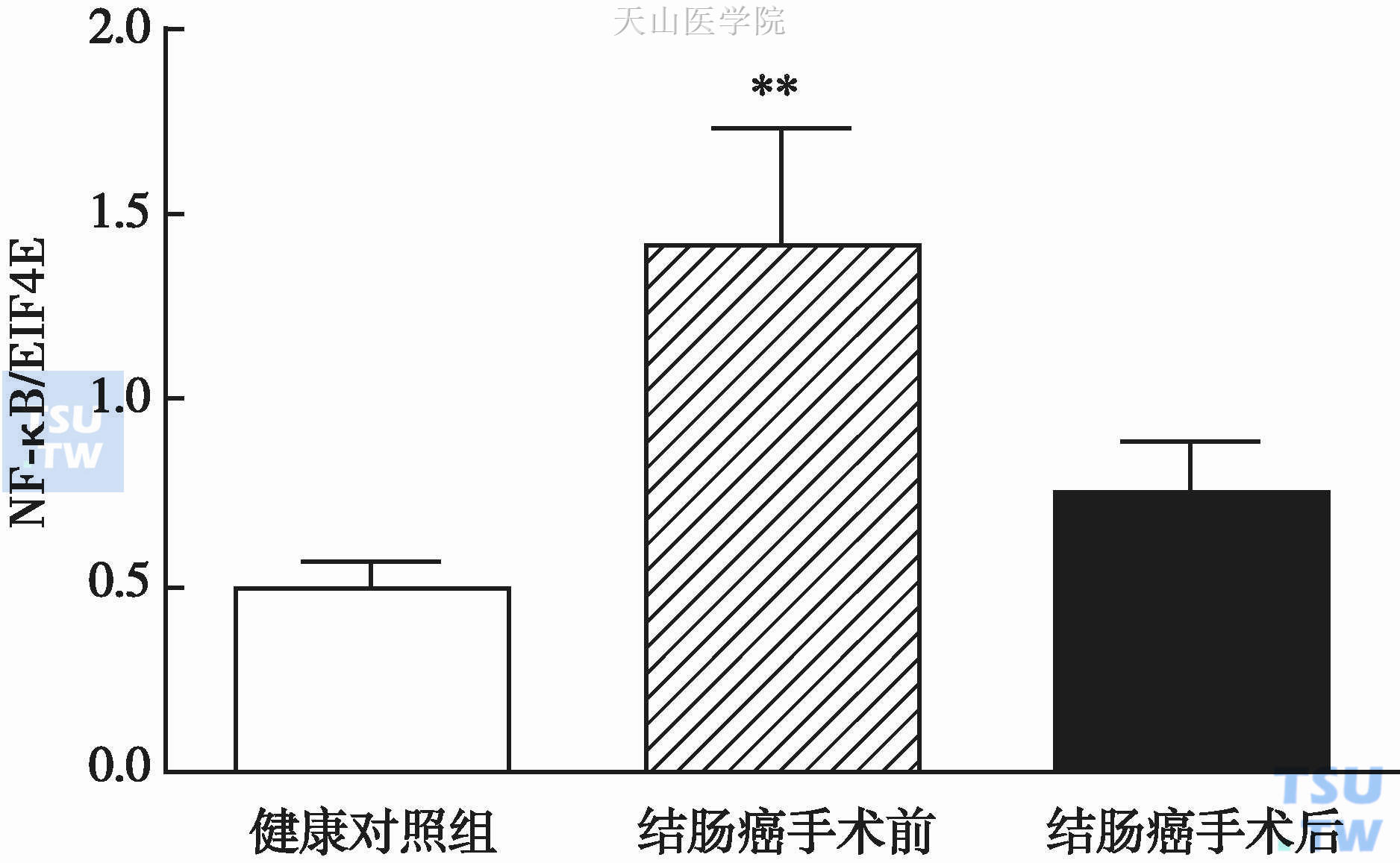
图10-5-3 结肠癌患者手术前后肌肉NF-κB活性变化
eIF4E,eukaryotic initiation factor 4E,真核起始因子4E;** P<0.001,与健康志愿者对照组比较
恶液质患者不仅瘦肉体减少,血浆蛋白水平也有显著变化,实验室检查应包括转铁蛋白、白蛋白、前白蛋白和维生素A结合蛋白。定量的机体成分检查有助于进一步评估患者营养状态和瘦体重。检查应该全面而仔细,因为水肿有可能造成虚胖的假象。其他检查有皮褶厚度、上臂围、生物电阻抗分析和双能X线吸收扫描。
Shaw JH等分别给18例良性疾病患者、26例体重无丢失的肿瘤患者、21例肿瘤恶液质患者静脉输注14C标记的亮氨酸,观察整体蛋白合成(whole-body protein synthesis,WBPS)、整体蛋白分解(whole-body protein catabolism,WBPC)、净蛋白分解(net protein catabolism,NPC)、白蛋白分数合成率(fractional synthetic rates,FSR),以了解不同患者整体水平及组织水平的蛋白质代谢情况,发现良性疾病患者及体重无丢失的肿瘤患者,上述所有参数均无明显变化。与良性疾病患者及体重无丢失的肿瘤患者相比,肿瘤恶液质患者WBPC显著升高(P<0.005),WBPS轻度升高,NPC率显著升高(P<0.05),肌肉、肝脏及白蛋白FSR显著升高(P<0.05,P<0.05,P<0.01)。此外,与早期肿瘤相比,有淋巴结及全身转移的肿瘤患者其蛋白质FSR进行性升高。营养支持使宿主肌肉蛋白质合成增加(P<0.04),而肿瘤组织的蛋白质FSR无升高。说明恶液质患者由于WBPC升高,使骨骼肌(蛋白质)进行性丢失,WBPS升高只能部分补偿蛋白质丢失。肿瘤恶液质患者尽管肌肉及肝脏的蛋白质合成代偿性增加,但是这些组织的蛋白质合成增加赶不上肿瘤组织本身蛋白质合成增加的步伐,呈现显著的不同步,致使整体水平的净蛋白分解率加速,患者因而消瘦。营养支持显著改善了肌肉组织的蛋白质合成,但是没有增加肿瘤组织本身的蛋白质合成,提示营养支持安全(没有促进肿瘤生长)而有效(促进肌肉组织蛋白质合成)。
蛋白质应用
概述
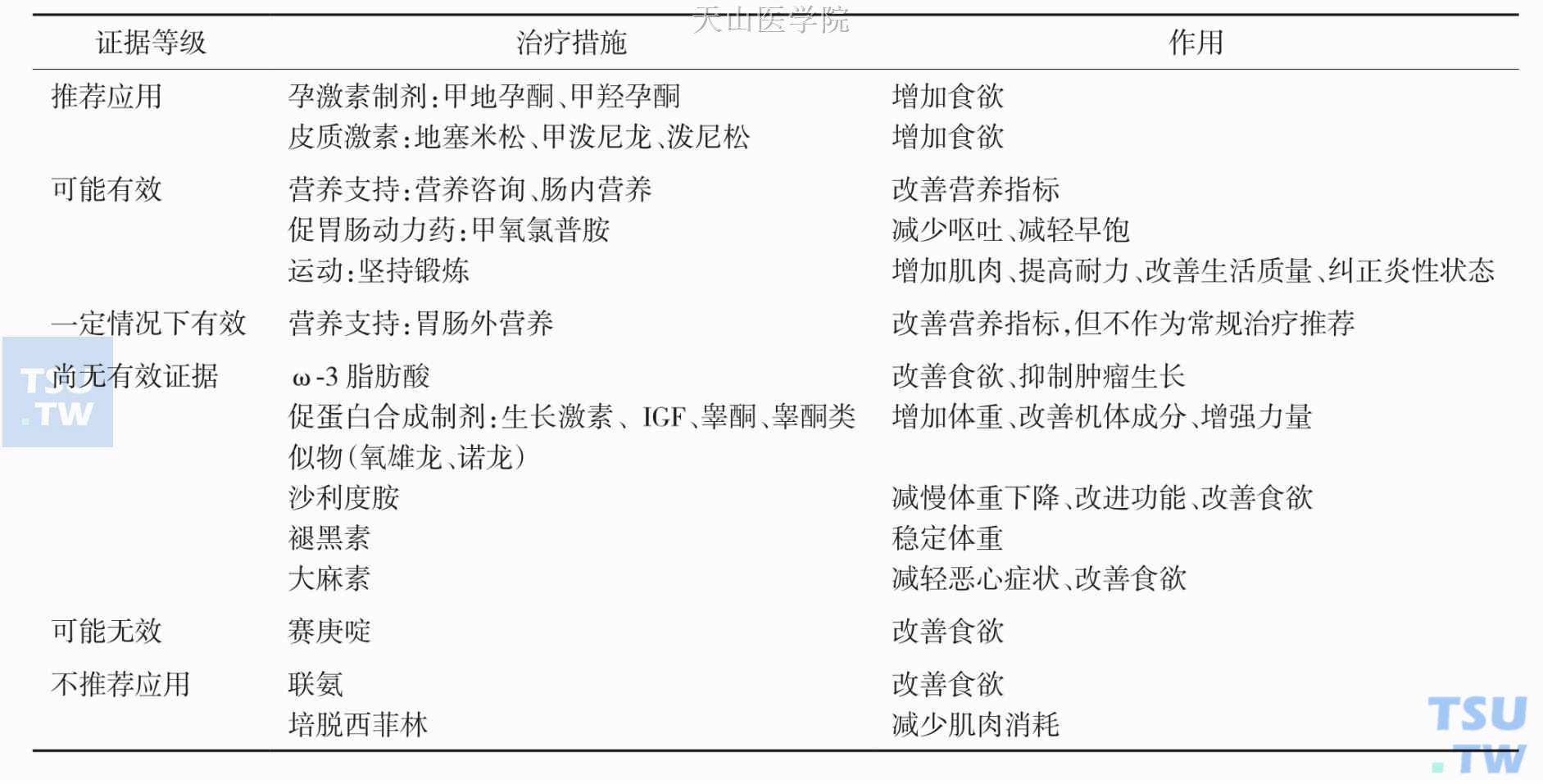
基于循证医学证据的治疗是一切干预措施的出发点。美国肿瘤护理学会(Oncology Nursing Society)把恶液质的所有治疗措施分为六个等级(表10-5-1),分别是:推荐应用于临床(基于最可靠的循证医学证据)、可能有效(有一定的循证医学证据)、根据具体情况选择(医师和患者需要根据实际情况权衡利弊)、尚无有效证据(目前证据不足)、可能无效(缺乏有效性证据)、不推荐应用(充分证据表明其无效)。
从表10-5-1可以看出,对恶液质患者的瘦肉体减少、蛋白质代谢异常、血浆蛋白质水平降低的治疗手段有多种,如促进食欲、抑制炎症反应、体育锻炼、促进蛋白质合成、直接补充蛋白质等,其中营养支持补充蛋白质(氨基酸)是一个最为直接的主要手段。
表10-5-1 美国肿瘤护理学会推荐的治疗手段及循证等级
补充蛋白质是否有效
Weijs PJ等2012年发表了一个前瞻性观察报道:886例连续入院的内外科混合ICU机械通气患者,平均年龄(63±16)岁,BMI(26±6),非直接测热法指导能量供给,蛋白质供给量最少1.2g/(kg•d),计算机械通气期间的累积摄入量,Cox回归分析蛋白质+能量达到目标需要量、能量达到目标需要量、蛋白质及能量均未达到目标需要量三种情况下28天死亡率。发现:蛋白质+能量双达标、能量单达标、蛋白质及能量均未达标三组的能量摄入分别为99%±5%、96%±5%、75%±15%,蛋白质摄入量分别为112%±12%、89%±10%、72%±20%。蛋白质+能量双达标、能量单达标的28天死亡风险比(hazard ratios,95%CI)分别为0.47 (0.31~0.73)、0.83 (0.67~1.01),两者相差非常显著。结果提示,蛋白质及能量双达标可以减少50%的死亡率,而单纯能量达标不能减少死亡率。这个研究虽然是危重病患者,但是其结果对恶液质患者有借鉴作用,充分说明了蛋白质达标的重要性。所以,对恶液质患者营养支持时,应该强调蛋白质、能量双达标。
1. 改善蛋白质代谢
2013年Bozzetti F等人就静脉补充蛋白质(氨基酸)是否有益于肿瘤患者的问题进行了报道,他们从Pubmed上收集1970—2011年静脉应用氨基酸于肿瘤患者(主题 词intravenous infusion of amino acid in cancer patients,parenteral infusion of amino acid in cancer patients,intravenousadministration of amino acid in cancer patients,parenteraladministration of amino acid in cancer patients)的研究报道,短期代谢研究发现,补充2g/(kg•d)氨基酸[含必需氨基酸,essential AA,EAA 0.5g/(kg•d)],显著改善了严重营养不良患者的蛋白质代谢,整体蛋白质合成(whole body proteinsynthesis,WBPS)显著升高;对轻、中度营养不良的肿瘤患者补充1.5g/(kg•d)氨基酸[总氨基酸1.25~1.7g /(kg•d),其中EAA0.5~1.2g/ (kg•d)],可以弥补口服摄入不足,可以使得抗肿瘤治疗继续进行,整体蛋白质分解(whole body protein catabolism,WBPC)保持不变或下降。补充1.4~2g AA/(kg•d) [EAA0.8~1.2g/(kg•d)]氨基酸,肌肉蛋白质合成(muscle proteinsynthesis,MPS)保持不变甚至增加;补充1.4~1.7g AA/(kg•d) [EAA 0.7~0.8g/(kg•d)]氨基酸,肌肉蛋白质分解(muscle proteincatabolism,MPC)保持不变(没有继续下降),见表10-5-2。
2. 提高血浆蛋白质水平
De Cicco M等报道了完全胃肠外营养(total parenteral nutrition,TPN)对肿瘤化疗患者毒副作用的前瞻性交叉研究,43例肿瘤患者,其中19例营养正常(A组),24例营养不良(B组),两组患者在化疗时分别先后进行13天的TPN[35kcal/(kg•d),1.4g AA/(kg•d)]或标准口服饮食,A组第一疗程化疗的同时接受TPN,21~28天后进行第二疗程化疗,口服饮食,无PN;B组相反,第一疗程化疗时无PN,21~28天后进行第二疗程化疗的同时进行PN,作者发现,营养正常的患者即使接受TPN,患者的营养参数也没有变化;营养不良的患者,化疗时实施TPN显著提高了前白蛋白、视黄素结合蛋白及氮平衡水平,P<0.02;没有接受TPN的患者,其前白蛋白及氮平衡水平显著下降。实验结果说明,营养支持及蛋白质补充只应该局限于营养不良及恶液质的肿瘤患者。
表10-5-2 氨基酸短期冲击治疗的疗效
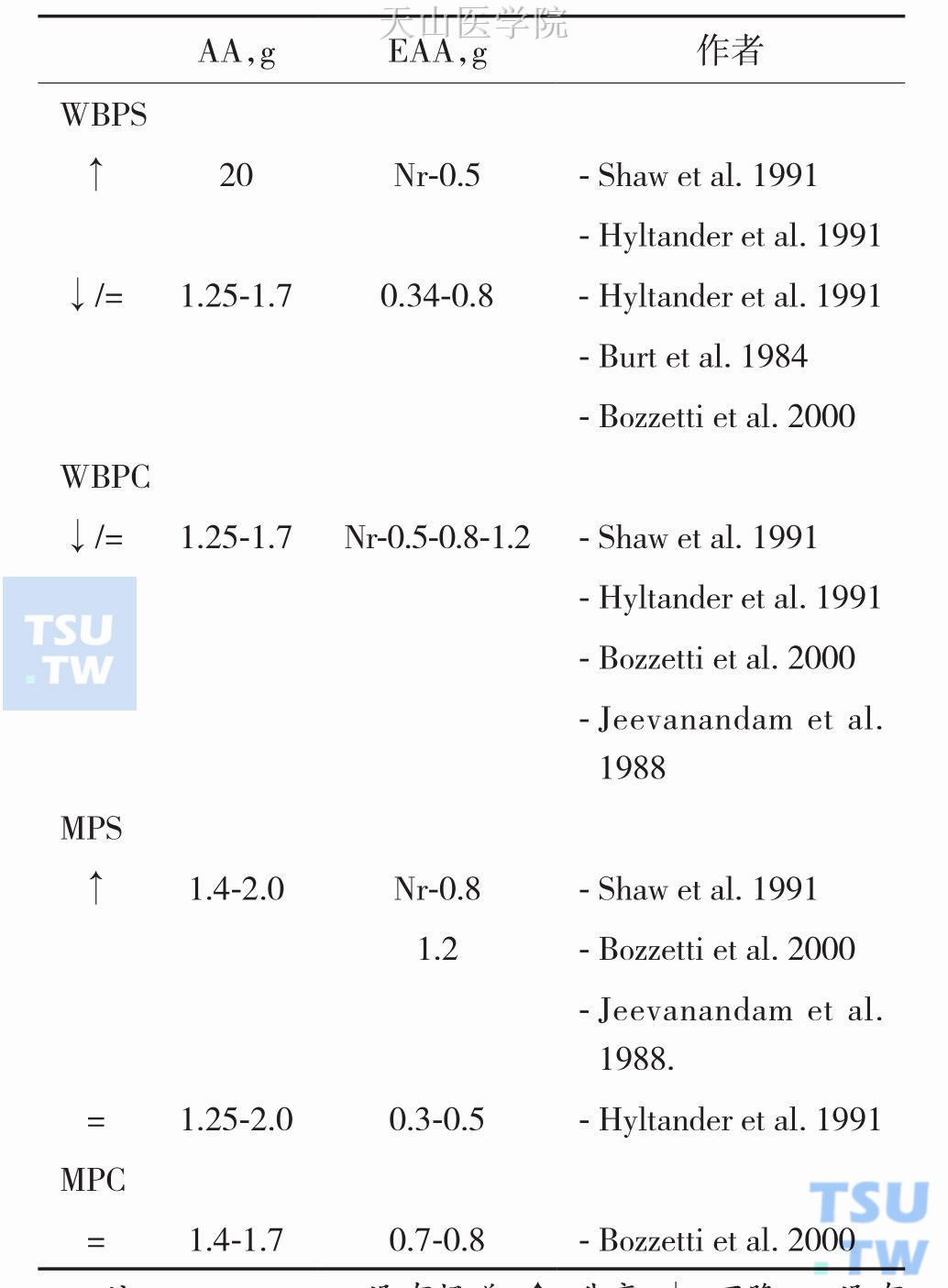
注:Nr,not report,没有报道;↑,升高;↓,下降;=,没有变化
3. 提高抗肿瘤治疗耐受性
Sikora SS等观察了营养支持对食管癌患者化疗毒副作用的影响,45例连续入院食管癌患者,手术前接受放化疗,随机分为PN组[n=30,1.5g AA/(kg•d)]及无PN组(n=15),发现:与无PN患者相比,PN组患者实际接受化疗剂量更大,更加接近目标化疗剂量,化疗完成率更高(5-FU 86.4% vs. 68.8%,P=0.02;顺铂90.8% vs. 78.2%,P=0.05;干扰素α 95.4% vs. 79.8%,P=0.05)。尽管PN组患者化疗剂量更大,但是其化疗毒副作用、手术后并发症及死亡率却没有明显增加。PN组与无PN组比较:血液系统严重毒副(Ⅲ/Ⅳ级)反应为93.3% vs. 86.6%,P=0.59;胃肠道Ⅲ/Ⅳ级毒副作用为56.67% vs. 33.3%,P=0.2;手术后并发症51.8% vs. 61.5%,P=0.73;手术后死亡率7.4% vs. 7.6%,P=1.00。
4. 延长生存时间
Lundholm K等报道了营养支持及蛋白质补充对肿瘤恶液质患者生存率的影响,309例恶液质患者,体重平均下降9%~10%,随机分为口服饮食+家庭肠外营养(home parenteral nutrition,HPN,总蛋白质1.4~1.7g/(kg•d),0.8g口服,0.6~0.9g静脉)及单纯口服饮食两组,HPN平均治疗46天,意向治疗分析(Intention-to-treat analysis)发现,HPN组营养平衡明显改善(P<0.03);实际治疗分析(As-treated analysis)发现,HPN组患者生存时间延长(P<0.01),能量平衡改善(P<0.001),体脂增加(P<0.05),身体活动能力增强(P<0.04)(图10-5-4)。
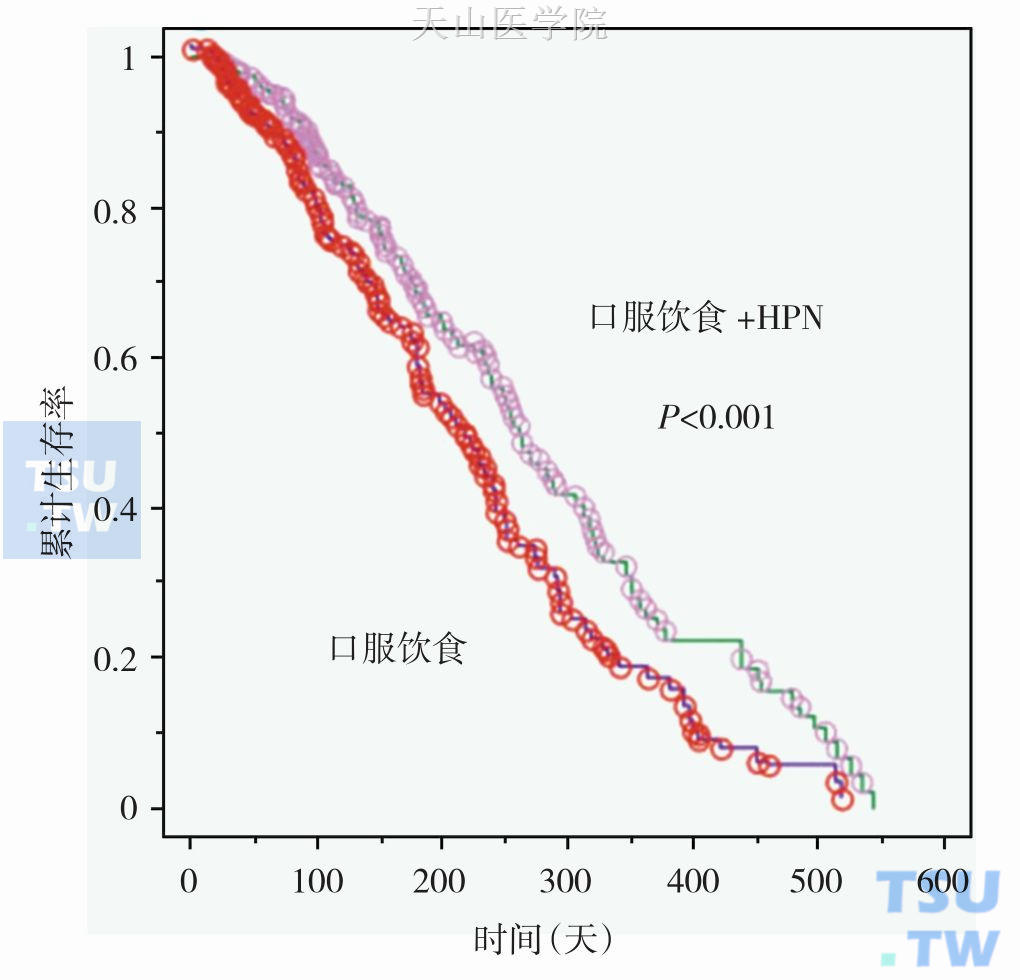
图10-5-4 HPN对肿瘤患者生存时间的影响(实际治疗分析)
如何补充蛋白质
1. 提高蛋白质(供给量)比例
由于肿瘤恶液质的特征是蛋白质减少,所以直接提高饮食的蛋白质比例是自然而然的想法。Ho VW等报道了高蛋白喂养对荷瘤小鼠的影响,5~8周龄C3H/ HeN小鼠、Rag2M小鼠分别接种鼠鳞状细胞癌细胞(SCCVⅡ)、人结肠癌细胞株细胞(HCT-116),分别用三种配方高蛋白(Ⅰ:碳水化合物15.6%,蛋白质58.2%,脂肪26.2%;Ⅱ:碳水化合物8.0%,蛋白质69.4%,脂肪22.6%;Ⅲ:碳水化合物10.6%,蛋白质63.5%,脂肪25.9%)及普通饮食(碳水化合物55.2%,蛋白质23.2%,脂肪21.6%)喂养,他们发现:与普通饮食喂养小鼠相比,高蛋白饮食喂养小鼠肿瘤(鼠肿瘤及人肿瘤)生长缓慢,血糖、胰岛素及乳酸水平均降低,mTOR抑制剂CCI-779及COX-2抑制剂Celebrex(塞来昔布,西乐葆)试验提示低糖高蛋白喂养具有协同抗肿瘤效应。遗传基因改造的HER-2/neu诱导乳腺癌小鼠喂养试验有惊人的发现,普通饮食喂养组50%小鼠发生乳腺癌,而高蛋白喂养组无一只小鼠发生乳腺癌;普通饮食喂养小鼠只有一只小鼠活到正常的寿命年龄,而高蛋白喂养组50%小鼠超过正常寿命年龄。
2. 补充性肠外营养(supplemental parenteral nutrition,SPN)
1968年Dudrick SJ等报道用肠外营养喂养成功喂养犬,并获得正常生长发育后不久,1974年他们的小组又第一次将肠外营养应用于肿瘤患者。早期的肠外营养多数为高能量的TPN,目前多数为补充性肠外营养,以静脉输注的方式补充口服不足。2009年的ESPEN指南指出,补充性肠外营养在肿瘤患者中的治疗目标为以下几点:①预防和治疗营养不良/恶液质状态;②增强患者的抗肿瘤治疗耐受性;③改善抗肿瘤治疗的副作用;④改善生活质量(证据等级C)。该指南中指出在晚期的肿瘤患者中肠外营养的指征,主要包括下述几点:①当因各种原因肠内营养无法满足患者的正常需要时;②患者的预期生存期长于2~3个月;③肠外营养补充预期可稳定或促进患者的机体状况,改善生活质量;④患者本人同意肠外营养的供给方式(证据等级C)。Hasenberg T等2010年报道82名无法根治的晚期结直肠癌患者,随机分为口服饮食+SPN及单纯口服饮食两组,两组患者总能量及蛋白质摄入量相同,作者发现6周后SPN组体细胞块(body cell mass,BCM)显著高于对照组,18周后SPN组患者生活质量显著改善,36周后SPN组患者BMI、白蛋白水平显著高于对照组。SPN组患者化疗相关毒副作用显著少与对照组,而生存时间显著延长。
3. 口服营养补充(oral nutritional supplements,ONS)
恶液质的一个重要特征是肌肉减少,ONS是最为简便的能量及蛋白质补充方法。研究发现,直接口服复方氨基酸,可以明显提高患者的瘦肉组织重量,提高胰岛素敏感性。Solerte SB等将41例年龄66~84岁的老年人随机分为安慰剂及复方氨基酸治疗组,复方氨基酸治疗组补充8g EAA (70.6kcal)/d,每天分两次于10am及5pm口服,持续6~18个月,发现:复方氨基酸治疗组大腿、上臂及躯干组织的瘦肉组织重量明显增加,空腹血糖、血浆胰岛素水平及胰岛素抵抗指数、血浆TNF-α水平明显下降,血浆胰岛素样生长因子(insulin-like growth factor-1,IGF-1)及IGF-1/TNF-α比值显著升高。作者认为口服补充蛋白质可以显著提高患者的瘦肉组织重量,其机制与提高胰岛素敏感性及IGF-1促进合成代谢有关(图10-5-5)。
补充什么蛋白质
1. 支链氨基酸(branched chain amino acid,BCAA)
肿瘤恶液质患者由于骨骼肌分解,其血浆BCAA水平往往升高,补充外源性BCAA可以达到抑制蛋白质分解、促进蛋白质合成的作用。Hunter DC等报道,9例腹腔腺癌患者分别随机先后接受普通TPN(BCAA19%)或富含BCAA的TPN (BCAA50%),两种TPN配方中的总能量及总氮量相等,采用13C亮氨酸及14C酪氨酸作为示踪剂,发现富含BCAA的TPN治疗患者,亮氨酸及酪氨酸内流(flux)显著升高,亮氨酸氧化显著增强,酪氨酸氧化显著下降。白蛋白分数合成率显著升高。酪氨酸示踪发现,整体蛋白质合成及降解均显著增强;亮氨酸示踪发现,整体蛋白质合成及降解也增强,但是无显著差异。作者认为:酪氨酸氧化下降(提示蛋白质利用改善)、蛋白质及白蛋白合成增加,说明BCAA对肿瘤恶液质患者有明显的正效应。
2. 水解蛋白
众多研究已经显示,与整蛋白相比,蛋白水解物(水解蛋白)更快吸收,更快改善氮平衡。Koopman R等比较了整蛋白及水解蛋白的消化与吸收情况,10位老年男性志愿者,分别随机先后一次性口服35g酪蛋白(casein,CAS)或酪蛋白水解物(hydrolyzed casein,CASH),6小时后检测血液及肌肉标本,作者发现与口服CAS相比,口服CASH后外源性苯丙氨酸出现率(exogenous phenylalanine appearance rate)显著升高(P<0.001),内脏提取(splanchnic extraction)显著降低(P<0.01),血浆氨基酸浓度升高25%~50%(P<0.01),肌肉蛋白质合成增加。实验结果提示,口服水解蛋白比口服整蛋白消化、吸收更快,餐后氨基酸可利用度更高,食物蛋白质更多参与肌肉蛋白质合成。
除了吸收更快之外,水解蛋白对肿瘤还有直接的抑制作用。Attaallah W在动物实验中比较观察了乳清蛋白及乳清蛋白水解物对肿瘤的影响,Wistar白化成年雄性大鼠,以氧化偶氮甲烷(azoxymethane,AOM)和硫酸葡聚糖钠(dextran sodium sulfate,DSS)诱导结肠癌,在正常饮食、饮水情况下,分别以等氮乳清蛋白或乳清蛋白水解物灌胃,每周2次,连续15周,动物分组情况见表10-5-3。
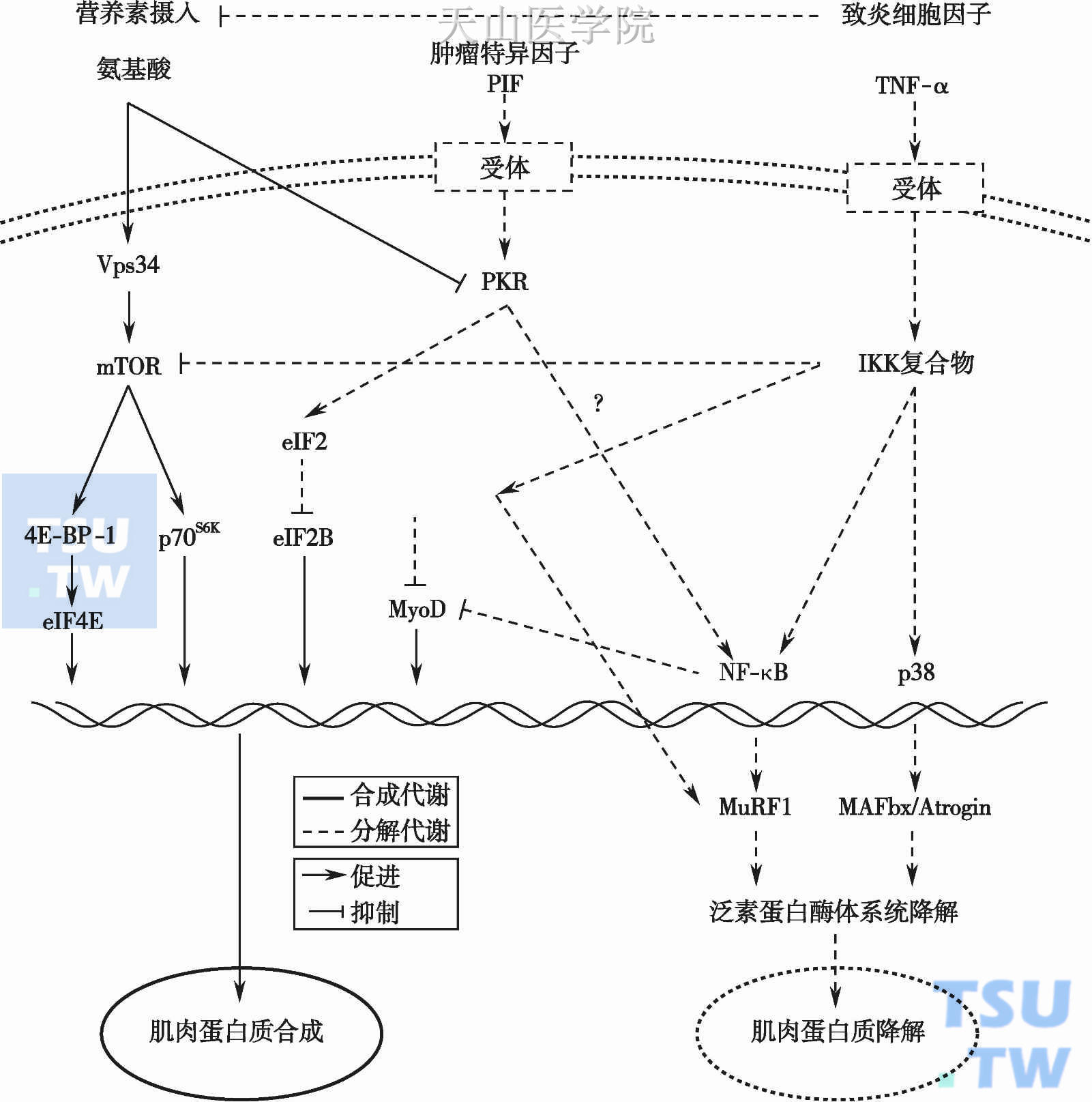
图10-5-5 氨基酸促进骨骼肌合成的机制
PIF,proteolysis-inducing factor,蛋白分解诱导因子;PKR,protein kinase R,蛋白激酶RIKK,IκB kinase,IkB激酶;VPS 34,vacuolar protein sorting 34,液泡蛋白分选34
表10-5-3 Attaallah W研究的动物分组
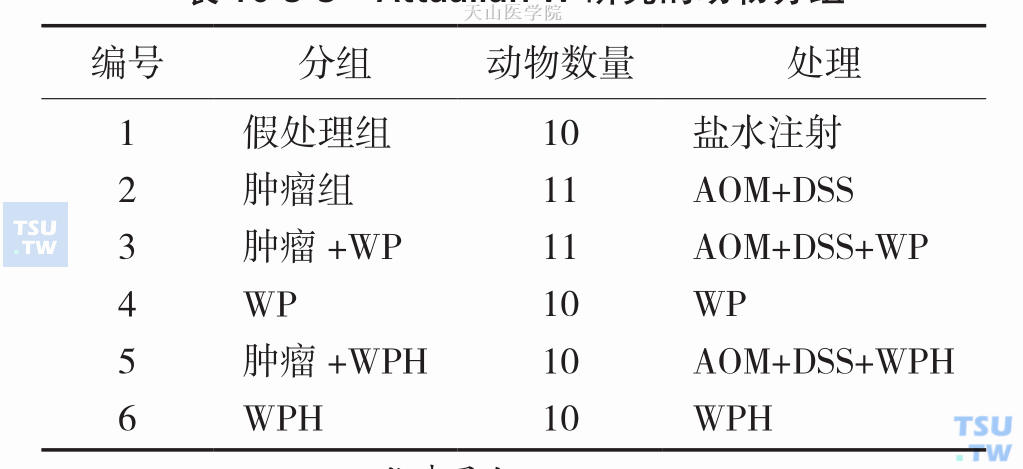
WP,whey protein,乳清蛋白;WPH,whey protein hydrolyzate,乳清蛋白水解物;AOM,azoxymethane,氧化偶氮甲烷;DSS,dextran sodium sulfate,硫酸葡聚糖钠
作者发现,WPH组大鼠体重显著增加,与假处理、肿瘤及肿瘤+WP相比,差异显著,P=0.0013。其余各组大鼠体重无显著差异。所有接种AOM 及DSS的处理组(肿瘤组,肿瘤+WP,肿瘤+WPH)均有肿瘤生长,所有未接种AOM及DSS的大鼠(假处理、WP、WPH)无一发生肿瘤。肿瘤组、肿瘤+WP组91.9%的大鼠生长肿瘤,肿瘤+WPH组只有33.3%的大鼠生长肿瘤,相差非常显著,P=0.004。病理学观察发现:肿瘤组、肿瘤+WP组、肿瘤+WPH组结肠腺瘤的发生率分别为90.9%、63.6%、44%,弥漫性结肠发育异常(diffuse colonic dysplasia)发生率分别为82%、91%、0。结论认为,与乳清蛋白相比,乳清蛋白水解物具有更强的肿瘤预防与抑制作用。
3. 谷氨酰胺
谷氨酰胺在肿瘤恶液质患者的作用已经有较多研究。Yoshida S等观察了①荷瘤动物是否存在谷氨酰胺缺乏,②化疗期间补充谷氨酰胺是否可以促进蛋白质代谢,③口服谷氨酰胺是否可以改善放化疗患者的免疫功能及肠道屏障功能。他们用AH109A 肝细胞瘤细胞(hepatoma cells)或吉田肉瘤(Yoshida sarcoma)细胞接种雄性Donryu大鼠诱导肿瘤,用U-14C-谷氨酰胺输注检测谷氨酰胺产量,用 U-14C-精氨酸输注检测精氨酸向谷氨酰胺的转化,用 1-14C-亮氨酸输注观察谷氨酰胺对蛋白质代谢的影响。临床研究中,他们将13例放化疗食管癌患者随机分为对照组及谷氨酰胺补充组(30g/d,连续4周),发现荷瘤大鼠尽管谷氨酰胺产量升高,精氨酸向谷氨酰胺转化增加,但是血浆及肌肉谷氨酰胺水平降低;化疗期间经肠外营养补充谷氨酰胺可以降低整体蛋白质降解;食管癌患者放化疗期间口服补充谷氨酰胺可以增强淋巴细胞有丝分裂功能、降低肠道黏膜通透性。结论认为:荷瘤宿主组织谷氨酰胺缺乏,谷氨酰胺补充可以减少肌肉蛋白质丢失,增强免疫功能,保护肠道黏膜屏障。
指南、共识与建议
尽管蛋白质在人体代谢与功能中有无可比拟的作用,但是,氮平衡在肿瘤患者的作用远远没有得到应有的重视。最新版(2009年)的ASPEN指南根本没有提到肿瘤患者的氨基酸(amino acid,AA)需要量。最新版(2009年)ESPEN指南对氨基酸的描述也只有寥寥数字:肿瘤患者的氨基酸需要量推荐范围最少为1g/(kg•d)到目标需要量的1.2~2g/(kg•d)之间(recommendations range betweena minimum protein supply of 1g/kg BW/day and a target supply of 1.2-2g/kg BW/day)。
综合多项研究,Bozzetti F,Bozzetti V认为,肿瘤恶液质患者蛋白质的总摄入量(静脉+口服)应该达到1.8~2g/(kg•d),BCAA应该达到≥0.6g/(kg•d),EAA应该增加到≥1.2g/(kg•d)。严重营养不良肿瘤患者的短期冲击营养治疗阶段,蛋白质给予量应该达到2g/(kg•d);轻、中度营养不良肿瘤患者的长期营养补充治疗阶段,蛋白质给予量应该达到1.5g/ (kg•d)[1.25~1.7g/(kg•d)]。日常饮食不足时,应该口服营养补充,口服营养补充仍然不足时,应该有静脉补充。
根据恶液质状态下的病理生理变化特征、蛋白质代谢的特点,结合现有的研究结果,笔者建议优先使用蛋白质水解物(水解蛋白)及短肽类制剂,提高BCAA比例。
思考题答案
1. 根据2011国际恶液质专家共识提出的具体诊断标准为:(1)无节食条件下,6月内体重下降>5%,或(2)BMI<20(中国人<18.5)和任何程度的体重下降>2%,或(3)四肢骨骼肌量指数(Appendicular skeletal muscle index)符合肌肉减少症标准(男性<7.26kg/m2,女性<5.45kg/m2)及任何程度的体重下降>2%。
患者只知道1年前的体重,不知道6月前的体重,所以不能采用第一条诊断标准。根据第二条诊断标准,患者目前的BMI为15.8(40/1.592),体重下降29%(56~40/56),符合第二条诊断标准,所以该患者为恶液质状态。
2. 患者目前有幽门梗阻,需要进行胃肠减压,不能进食,需要实施TPN。其营养处方如下:
四个需要量
液体=30ml/kg×40kg+500ml(胃液丢失)≈1700ml
非蛋白质能量=(25-30)kcal/kg×40kg≈1000~1200kcal
蛋白质=(1.5-2.0)g/kg×40kg=60~80g蛋白质≈9.6~12.8g氮
电解质=4.5g Na+,3g K+
三个比例
脂肪/糖 30%~70%/70%~30%
非蛋白质能量/氮 100~150/1
糖/胰岛素 4~6/1
两个选择
中、长链脂肪乳与长链脂肪乳,优先选择中/长链脂肪乳
普通氨基酸与富含BCAA的氨基酸,优先选择富含BCAA的氨基酸制剂
其3升袋主要组成如下
50%葡萄糖溶液200ml(能量400kcal)
谷氨酰胺注射液100ml(蛋白质20g,含氮量3.2g)
10%复方氨基酸注射液(20AA)500ml(总蛋白质50g、总氮量8g,BCAA33%)
20%中/长链脂肪乳剂250ml(能量约490kcal)
5%葡萄糖氯化钠溶液500ml(能量100kcal)
本处方小结
液体 1550ml(38.75ml/kg)
最终糖浓度8%
非蛋白质能量 990kcal(24.75kcal/kg)
蛋白质70g(1.75g/kg,氮 9.2g)
Na+ 4.5g
脂肪∶糖 49%∶51%
非蛋白质能量∶氮 108∶1
胰岛素25U 糖∶胰岛素 5∶1
(石汉平)
