葡萄糖是机体主要能量来源,同时糖分解代谢的中间物也是细胞合成生物大分子的前体构件分子,因此对于细胞生长和增殖非常重要。肿瘤患者,特别是恶液质状态下表现出更为明显的糖代谢紊乱,主要表现为:①部分患者胰岛素分泌不足、胰岛素抵抗和高血糖;②葡萄糖利用降低;③肝糖异生增强,葡萄糖转化更新加快,具有表现为乳酸-葡萄糖循环(Cori循环)和丙氨酸-葡萄糖循环增强,这些无效循环导致更多ATP消耗;④肝糖原合成。
1997年,Tayek等测定了一组10例头颈部鳞状细胞癌患者,其中4例正常体重和6例低体重,以及相应对照组的胰岛素敏感性、胰岛素分泌和葡萄糖处理率等指标,结果显示(图3-2-2,表3-2-1):不管是正常体重,还是低体重肿瘤患者静脉注葡萄糖后的胰岛素分泌都明显下降,分别降低约40% 和50%(P<0.05),同时胰岛素敏感性分别下降32% 和44%,两组肿瘤患者的葡萄糖处理率也明显降低(P<0.05),而低体重肿瘤患者的葡萄糖异生能力明显增强(P<0.05)。这表明肿瘤患者,尤其体重下降发展为恶液质状态下糖代谢紊乱更明显,同时肝脏糖异生能力进一步增强,也即乳酸-葡萄糖循环和丙氨酸-葡萄糖循环等无效耗能增加,这势必会进一步促进恶液质发展。
2010年Ya-Shi Zhan等人报道了对一组2408例恶性肿瘤患者和2016名正常对照组作了糖代谢相关指标检测和分析。结果显示(表3-2-2):2408例恶性肿瘤患者中,糖尿病发生和空腹血糖异常(impaired fasting glucose,IFG)占28.0%,其中胰腺癌、淋巴瘤、肝癌、白血病和结直肠癌等患者高血糖发生率明显升高,大于30%;同时发现糖尿病可增加患结直肠癌、肝癌、食管癌、甲状腺癌、宫颈癌和胰腺癌的风险。
目前对于肿瘤患者,特别是恶液质患者的糖代谢紊乱的发生确切机制仍没完全阐明,但主要原因可能包括两个方面:肿瘤因素和治疗因素。肿瘤是造成宿主糖代谢紊乱的根本原因,而由肿瘤导致宿主糖代谢紊乱的可能机制包括三个方面:
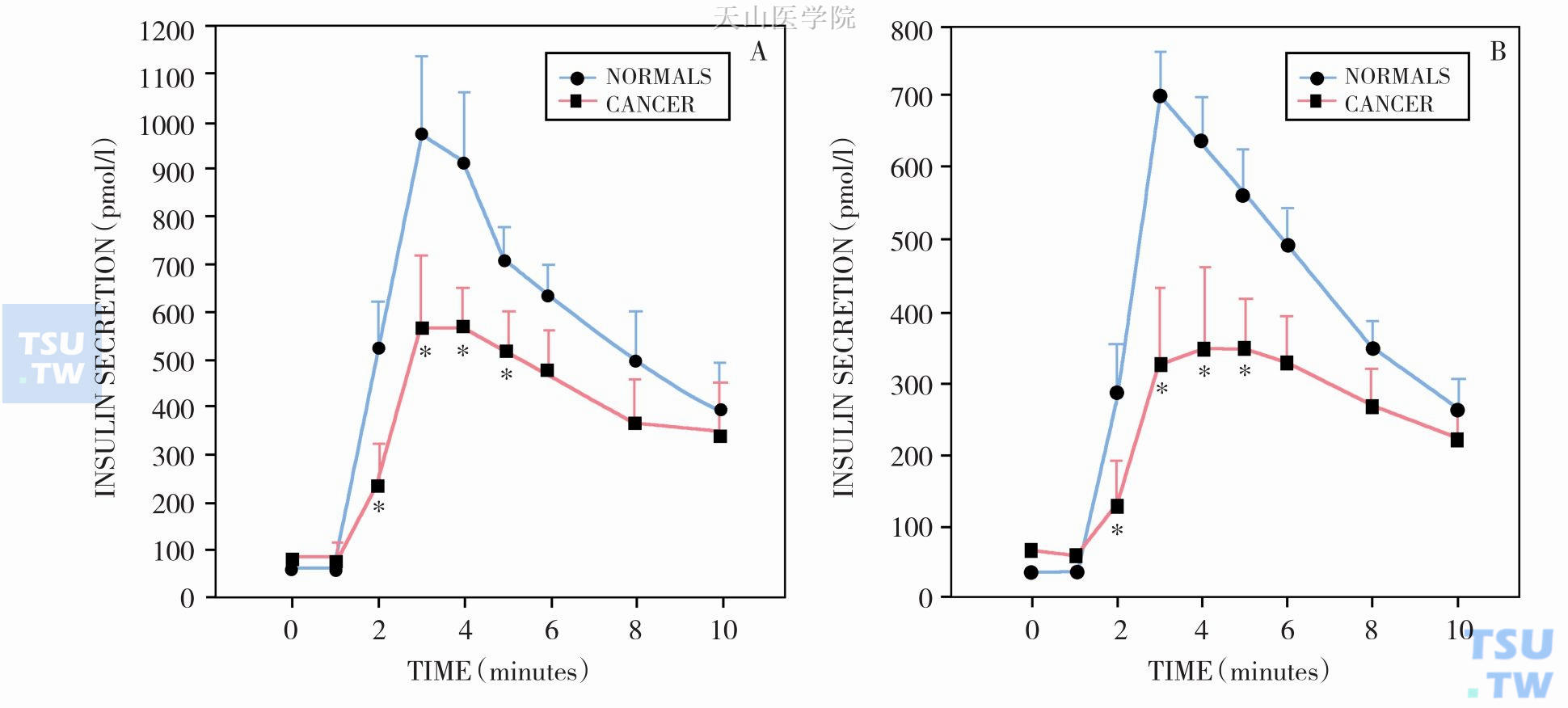
图3-2-2 静脉注入葡萄糖后胰岛素分泌反应:A.正常体重;B.低体重
表3-2-1 头颈部鳞状细胞癌患者与相应对照组的胰岛素分泌、胰岛素敏感性、葡萄糖处理和糖异生等变化(X±SD)
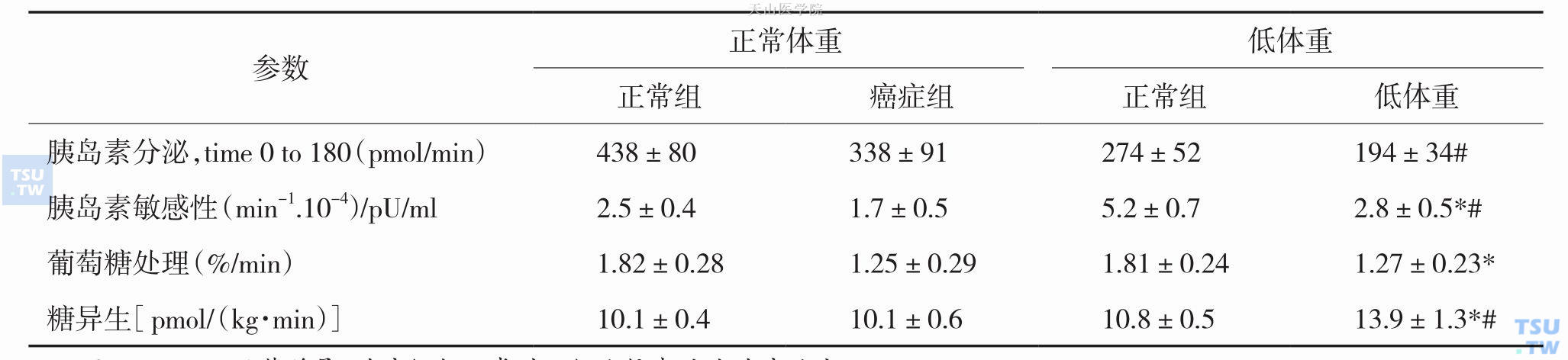
注:*P<0.05:显著差异,肿瘤组与正常对照组比较来反映肿瘤效应。
#P<0.05示显著差异,正常体重组(正常对照正常体重和肿瘤正常体重)与低体重组(正常对照低体重和肿瘤低体重)比较来反映体重效应
表3-2-2 不同肿瘤患者空腹血糖的变化
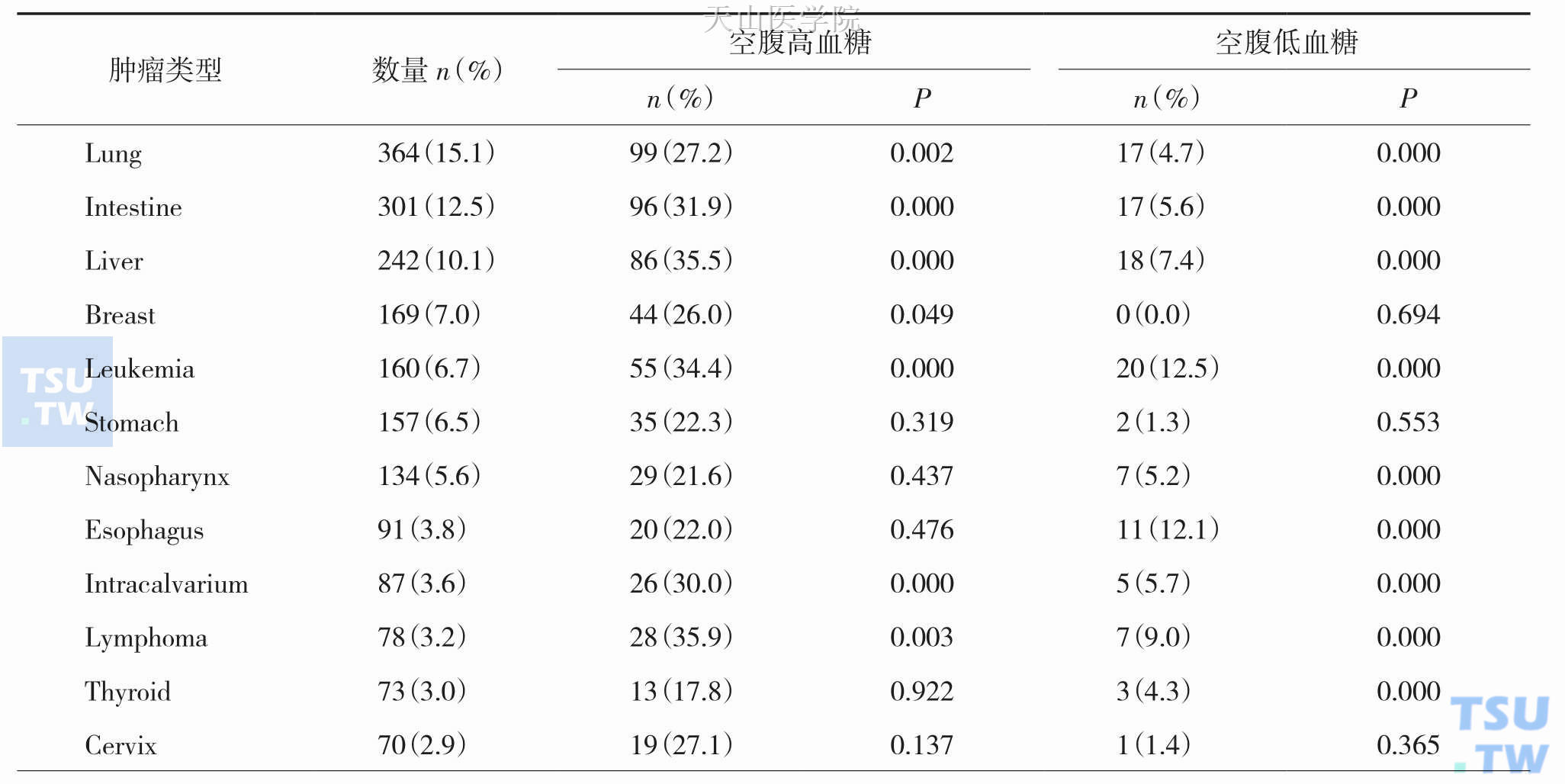
续表
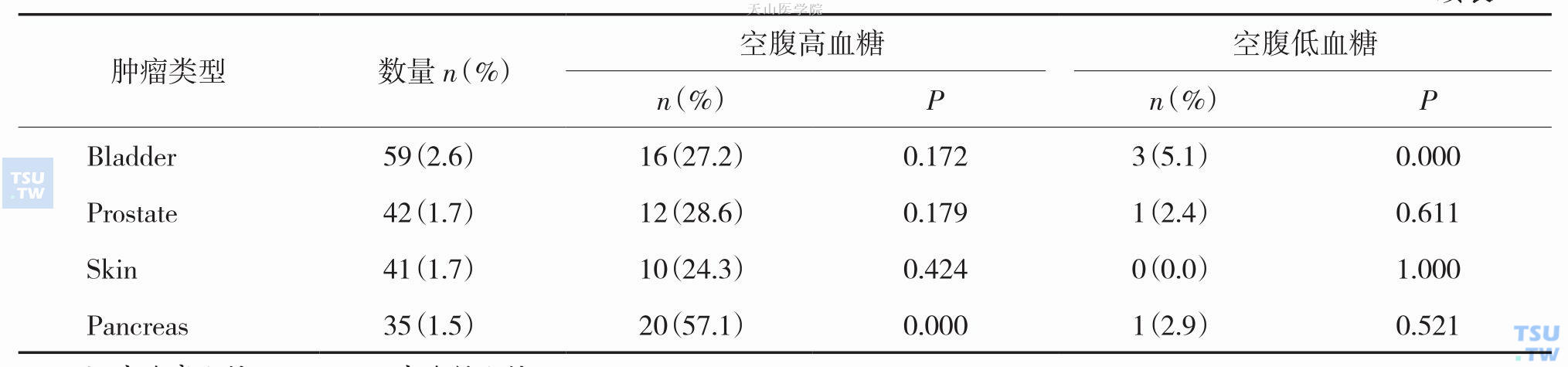
注:空腹高血糖:6.1mmol/l;空腹低血糖:FPG B 3.9mmol/l
(1) 肿瘤异位内分泌作用肿瘤相关内分泌紊乱:某些非内分泌器官的肿瘤可能分泌激素或激素样物质,或虽属内分泌肿瘤,却产生某些正常情况下不产生的激素,从而引起内分泌功能紊乱及相应临床表现和生物化学改变,习称副肿瘤内分泌综合征(paraneoplastic endocrine syndromes,PES)或异位内分泌综合征(ectopic endocrine syndrome,EES)。其来源于胚胎时期的神经嵴,能摄取胺原前体、将其脱羧、合成多肽类激素,包括肺燕麦细胞癌、肺及胃肠胰类癌、某些胸腺瘤及甲状腺滤泡旁细胞瘤髓样癌等。
(2) 肿瘤引起宿主炎症反应:肿瘤引起的慢性炎症而释放许多炎症细胞因子,如TNF-α可使静息能量消耗(REE)增加17%,增加肝糖异生和葡萄糖输出;IL-1也可增加REE20%;IL-6促进糖异生;胰岛素抵抗往往伴随着炎性因子水平的升高。许多炎症因子,包括TNF-α、IL-1、IL-6等,通过血液和(或)旁分泌干扰胰岛素信号转导而导致胰岛素抵抗。主要是通过(NF-κB和JNK等通路)诱导IRS的丝氨酸磷酸化,阻碍IRS正常的酪氨酸磷酸化,导致IRS与胰岛素受体的结合能力下降,并减弱IRS激活其下游的PI3K的磷酸化过程,干扰胰岛素信号经胰岛素受体下传,从而影响了肌细胞和脂肪细胞对于葡萄糖的摄取。
(3) 肿瘤代谢重编程:除了上述因素外,肿瘤本身代谢重编程为满足其恶性增殖而不断消耗能量和碳源,主要通过摄取和分解大量的葡萄糖(具体见下)。这也是宿主糖代谢紊乱的重要因素。
