HPV感染非常常见。当以DNA检测技术测定细胞内HPV的感染时,发现HPV在女性的普通人群中感染率很高。据WHO 2008年公布的统计数据,非洲大陆普通人群的感染率高达23%,美洲约15.6%,亚洲为8.3%(中国为13.6%),欧洲为6.6%6在男性,HPV的感染率也很高,当自18~23岁的男性生殖器不同部位多点(如阴茎、龟头和阴囊等)取材时,感染率可达25.8%。HPV的感染率与人群的年龄,HIV的流行情况和性行为的特性等有密切关系。90%的HPV感染是短暂的,往往在1~2年内会被机体清除,只有5%左右会发展为生殖道湿疣,5%左右发展为宫颈肿瘤。HPV引起的宫颈癌是女性第二位(在中国为第七位)最常见的恶性肿瘤,全球约每年新增50万例(中国有45689例),其中约半数死亡(中国有25561例),约80%发生在发展中国家。HPV还是阴茎癌、肛门癌、外阴癌、阴道癌的病因。
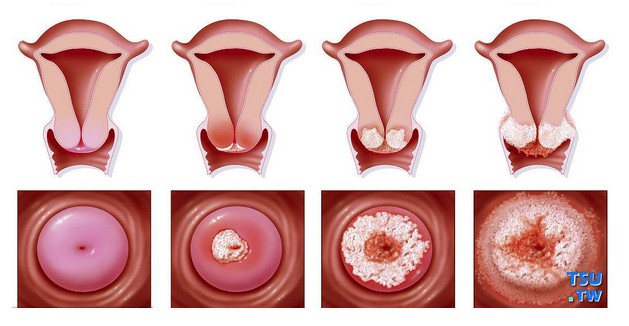
最新的中国研究资料表明,在2008年,HPV引起的官颈癌是中国女性第七位易发肿瘤疾病,发病率为12.24/10万。官颈癌是农村妇女因肿瘤死亡的第八位病因,死亡率达到3.9/10万。
人乳头瘤病毒属于乳头瘤病毒科(Papillomaviridae),是无囊膜的双链环状DNA病毒。病毒颗粒除含有核酸外,还有两个结构基因表达的蛋白(L1和L2,又称之为晚期蛋白,Iate protein)和八个非结构基因表达的蛋白(El~E8),后者又称之为早期蛋白(early protein)。L1蛋白是病毒包膜的主要成分,包膜由72个L1的五聚体构成。主要的中和抗体表位也位于L1蛋白,因而它也是研发HPV疫苗的关键靶分子。L2蛋白与部分L1蛋白五聚体相互作用,为病毒基因组的衣壳化所必需。早期蛋白当中,E5~E7与HPV的致癌特性关系密切,E5致癌蛋白能诱导被感染细胞发生转化,E6蛋白抑制P53蛋白(一种抗癌基因的产物)的产生,E7蛋白与pRb蛋白(一种抗癌基因,成视网膜细胞瘤基因的产物)结合,并抑制它的活性。
根据乳头瘤病毒L1基因的开放阅读框架(ORF)的系统发生树,把它划分为不同阶元的属、种、型、亚型和变种。乳头瘤病毒有12个属(以希腊字母为序)。其中5个属是人和非人灵长类动物的乳头瘤病毒,它们是:a(alpha)、b(beta)、g(gamma)、m(mu)、n(nu),其余的属为动物乳头瘤病毒。如果同一属内L1基因有60%~70%的同源性,就以阿拉伯数字命名为同一个种,例如HPV16划归为物种9,HPV18为物种7。如果同一种内,L1基因的同源性达到70%~90%,就划为同一个基因型,基因亚型的同源性为90%~98%。到2004年为止,已经有96个基因型测定了全基因组序列,至少还有100个基因型是部分地测定了序列。
不同基因型的HPV在致病性方面有很大的不同。有些基因型主要感染生殖道(如HPV-16,18,31,45,58等),有些还会感染呼吸道和眼结膜(如HPV-6,11),有些会引起口腔疾病(如HPV-2,13,32等)。在女性宫颈部位,不同基因型的HPV的致癌性差别大,例如,HPV-16和18是致癌性最强的病毒,可引起多种癌症(下表)。在中国,有69.4%的侵袭性宫颈癌是由HPV16 (58.7%)或HPV18(10.7%)引起的,其余依次为HPV-58,33,52,31,59,45,6,35。
| 生殖道和其他黏膜感染的各种基因型HPV的主要致病特性 | ||
|---|---|---|
| 部位 | 所感染的病毒基因型 | 致病性 |
| 生殖道 | 全部感染生殖道的HPV | 亚临床感染 |
| HPV-6,11 | 外生性湿疣(任何部位) | |
| HPV-6,11,16,18,31及其他 | 扁平湿疣(尤其是宫颈) | |
| HPV-16 | 退行性丘疹 | |
| HPV-6,11 | 巨大湿疣(布-劳氏瘤) | |
| HPV-16,18,31,45 | 与官颈癌高度相关联,属高危致癌HPV(HR-HPV) | |
| HPV-33,35,39,51,52,56.58,59,68 | 与宫颈癌中度相关联,属高危致癌HPV(HR-HPV) | |
| HPV-6,11,26,42,43,44,53,54,55,62,66 | 与官颈癌低度相关联,属低危致癌HPV | |
| HPV-16 | 外阴癌 | |
| HPV-16 | 阴茎癌 | |
| 呼吸道 | HPV-16,11 | 呼吸道乳头癌 |
| 眼结膜 | HPV-16,11 | 眼结膜乳头瘤 |
| 口腔 | HPV-13,32 | 口腔灶性上皮增生 |
| FIPV-6,11,16 | 与生殖道HPV并发感染,口腔癌 | |
| HPV-2 | 唇部损伤 | |
当以PCR技术检测男性生殖道HPV感染时,样品来源很重要,取样品时要包括阴茎体、龟头、冠状沟。肛门和肛门外周以及阴噬部位最好也要包括在内。不需要检测精液、尿道和尿液。当Giuliano等(2007)以该方法检测463名平均年龄在27岁的正常男性时,发现这些男子生殖道的HPV总感染率为65.4%。此后,Hernandez等(2008)也获得类似的结果,这些研究表明,检测时取材部位要靠近包皮,包皮可能是HPV感染最易感的位点。
致癌性人乳头瘤病毒(如HPV16,18等)可引起男性的阴茎癌。Daling等(2005)以抗HPV-16抗体测定技术和HPV核酸测定技术,研究了美国华盛顿州西部137名诊断为原位75名)和侵袭性(62名)阴茎癌的患者和671名对照者HPV感染的情况。他们发现,儿童时期有包茎病史但未进行包皮环切者,患侵袭性阴茎癌的危险性,明显高于儿童时期进行过包皮环切者,但是患原位阴茎癌的危险性无明显变化;35%的阴茎癌患者在儿童时期有包茎病史,而对照组只有7.6%的人在儿童时期有包茎病史,表明包茎与侵袭性阴茎癌的发生高度相关;在79.8%的阴茎癌标本中可测定出HPV的DNA,其中69.1%为HPV-16。
普通的男性HPV感染者多数不表现临床症状,但传染给女性后,会引起女性最常见的官颈癌。Harald zur Hausen因为在20世纪70年代发现HPV感染与宫颈癌的关系而获得2008年度的诺贝尔医学与生理学奖。2002年由西班牙、法国、荷兰、美国、巴西、菲律宾和泰国等国学者在欧美和亚洲的1913对夫妻所完成的研究报告表明,未包皮环切男人的HPV感染率为19.6%,而环切者的感染率为5.5%,感染率降低了72%,男性包皮环切者配偶的官颈癌发生率也降低了。据Drain等2006年发表的研究报告,在118个发展中国家当中,男性包皮环切率低(<20%)的国家,女性富颈癌的年发病率为35.0/10万妇女,而高包皮环切率的国家(>80%)的发病率仅为20.5/10万妇女。两者有非常显著的统计学差别( P<0.001)。近期,Wawer等发现在乌干达参与随机临床试验的未感染HIV的包皮环切男性当中,他们的HIV阴性的女性伙伴感染HPV的风险,在24个月内降低了28%。
2008年美国研究人员以夏威夷大学学生为研究对象,发现在299名未包皮环切的男性龟头和冠状沟HPV检出率为46%,包皮的检出率为44%,而80名包皮环切者龟头和冠状沟HPV检出率只为29%。尤其需要特别指出的是,未包皮环切者当中,致癌HPV(如HPV16和18等)的检出率31%,而包皮环切者中只有16%。
2009年,在国际上著名的医学刊物新英格兰医学杂志和传染病杂志上,两个研究小组分别发表了随机对照临床试验的研究报告,进一步证明男性包皮环切能够十分有效地预防HPV的性传播。Quinn领导的研究小组在乌干达以及Auvert领导的小组在南非,以大规模随机对照临床试验,证明男性包皮环切可显著减少高危致癌的HPV感染率,有效率分别达到35%和34%。在乌于达的研究结果表明,在临床试验的第24个月,男性包皮环切组的高危HPV的感染率为18.0%(42/233),低危HPV为26.2%(61/233),对照组的高危和低危HPV感染率分别为27.9%(80/287)和39.4%(113/287)。无论是高危HPV还是低危HPV的感染率,包皮环切组和对照组的差异都是非常显著的,P值均为0.01。在南非的研究结果与此相似,在临床试验的第21个月,包皮环切组高危HPV的感染率为14.0%( 90/643),而未包皮环切组为23.2%(144/621),两者的差异也很显著(P<0.01)。同时感染多个基因型的高危HPV的患者的比例在包皮环切组(4.2%)显著低于对照组(9.9%)(P<0.01)。
2011年,中山大学孙逸仙纪念医院泌尿外科董文等报告了128例已婚成年男性包皮环切术前及术后2年尿道分泌物内高危型HPV的感染率,并与同期128例包皮过长而未行包皮环切术的已婚成年男性对比,结果表明,2组患者术前的HPV感染率相当,其中包皮环切术组术前高危型HIPV的感染率为27.3%,术后2年复测高危型HPV的感染率,降为12.5%,差异有统计学意义(P=0.005),而对照组第1次检测高危型HPV的感染率为28.1%,2年后再次检测时感染率为25.0%,二者差异无统计学意义(P=0.671)。同样证明包皮环切术能够明显降低成年男性高危型HPV的感染率,在我国积极推广包皮环切术对预防高危型HPV感染相关疾病的发生具有重要意义。
由于男性包皮环切可预防HPV感染,所以环切者中HPV所诱发的肿瘤也就随之减少。流行病学研究表明,广泛进行男性包皮环切的信奉伊斯兰教的国家和犹太教崮家以色列,龟头炎和阴茎癌的发生率比未进行包皮环切的人群低几十倍,而包茎和包皮过长患者的发生率会远远高于正常人。Moriis等认为,能引起前列腺慢性炎症的性传播病原体与前列腺癌的发生有关,包皮环切能减少这些病原体的感染,从而降低前列腺癌的发生率。然而,包皮环功与前列腺癌有没有关系,仍然需要更多的直接症状。
除了上述刷男性包皮环切术来预防两性HPV感染之外,针对高危致癌HPV的疫苗也已经在不少发达国家的适龄妇女中使用。也有专家建议将来能在男性广泛使用。目前上市的有Merck公司生产的,针对HPV-6,11,16和18的四价重组疫苗Cardasi,以及GlaxoSmithKline公司生产的针对HPV-16和18的二价疫苗Cervarix。四价疫苗用于预防相应HPV引起的宫颈癌、外阴和阴道癌前病变、生殖道湿疣以及低度宫颈损伤。9~26岁妇女或女孩,可在0、2、6月免疫,每次肌注0.5毫升。价疫苗可在0、1、6月肌注免疫。疫苗的有效率达96%~100%。但是,这些疫苗对其他HPV基因型的交叉保护力十分有限,在发达国家,仅疫苗本身的费用为300~500美元,在我国香港,约3000多港币,价格相当昂贵。
