TOR基因是1991年在酵母菌中研究雷帕霉素时被发现的,而后人们在哺乳动物中发现了与其结构相应的哺乳动物雷帕霉素靶向蛋白,称为mTOR (mammalian target of rapamycin;目前多翻译为mechanistic target of rapamycin)。两者在氨基酸序列上有95%的同源性。mTOR基因定位于1p36.2,合成的蛋白质分子量为289kD,由2549个氨基酸组成。已经证实,在哺乳动物体内存在两种mTOR的复合体:mTORC1(mTOR complex 1)和mTORC2 (mTOR complex 2),两者的组成以及生物学功能各不相同。
mTORC1组成成分包括支架蛋白Raptor (regulatoryassociated protein of mTOR)、蛋白激酶mTOR、调节蛋白mLST8(mammalian lethal with SEC13 protein 8)、Deptor(DEP domain-containing mTOR-interacting protein)和PRAS40(proline-rich Akt substrate of 40kD);mTORC2则由支架蛋白Rictor (rapamycin insensitivecompanion of mTOR)、蛋白激酶mTOR、调节蛋白mLST8、mSin1(mammalian stress-activated protein kinase interacting protein 1)、Deptor和PRAS40组成。mTORC1对雷帕霉素敏感,研究也更为深入,发现其参与了蛋白质合成、能量调节、细胞凋亡及自噬、免疫等过程;而mTORC2对雷帕霉素耐药,与细胞骨架以及极性调节有关,新近研究发现该复合体参与了细胞生存、细胞周期以及合成代谢等的调节(图2-9-1)。
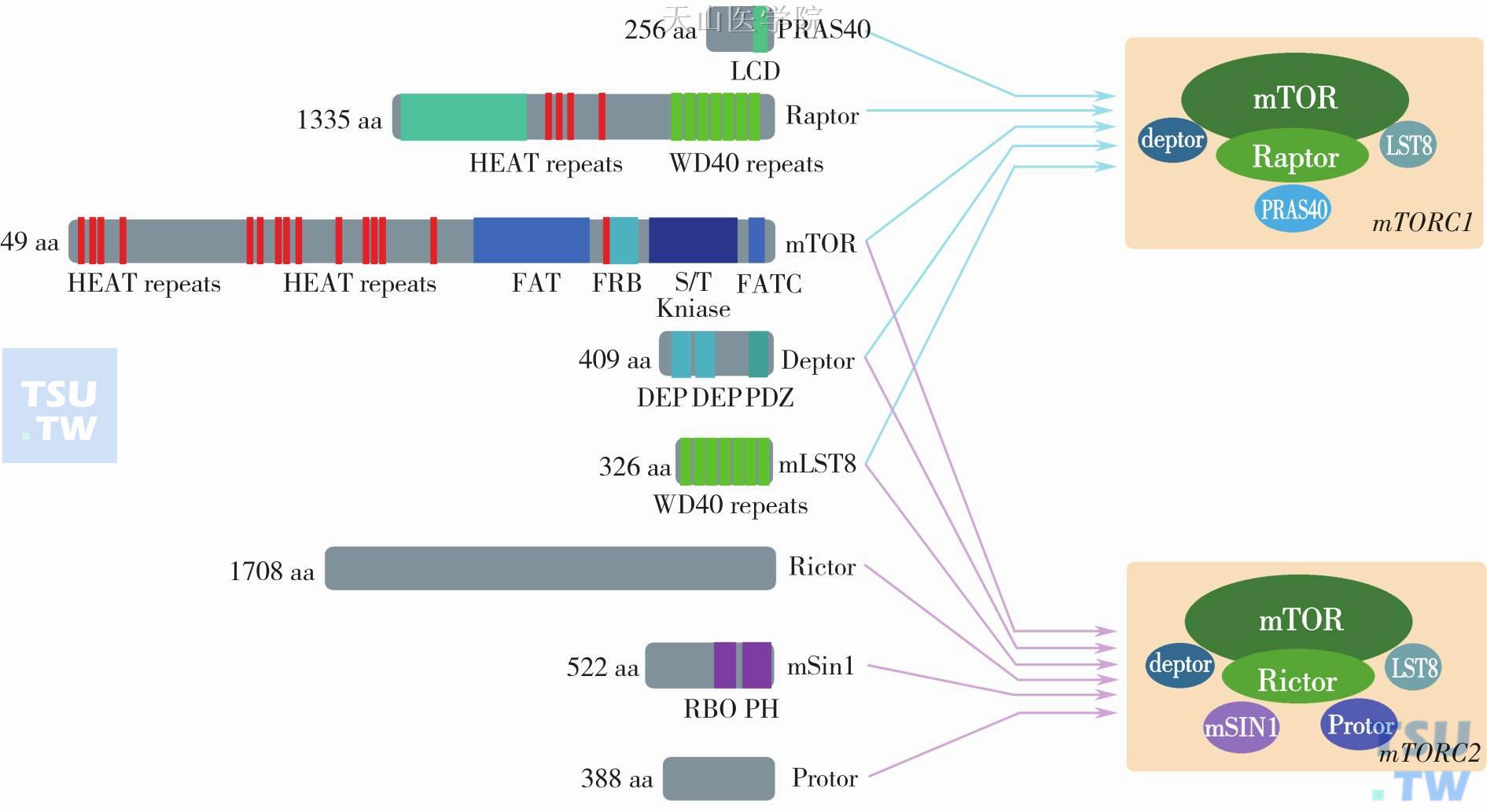
图2-9-1 两种mTOR复合体的组成
mTOR通路中有三个重要的上游调节蛋白:Rheb(ras homologue enriched in brain)、Rag、TSC1/2 (tuberous sclerosis complex 1/2)。其中前两者均为小G蛋白。TSC1/2复合体能促进与Rheb结合的三磷酸鸟苷(guanosine triphosphate,GTP)水解为二磷酸鸟苷(guanosine diphosphate,GDP ),使得Rheb失活,不能发挥激活mTORC1的功能。胰岛素或者IGFs(insulin-like growth factors)与相应受体结合后,激活PI3K/Akt,从而磷酸化TSC2;其他的生长信号如血小板源性生长因子(platelet derived growth
2549 aa factor,PDGF)、脑源性神经营养因子(brain derived neurotrophic factor,BDNF)、表皮生长因子(epidermal growth factor,EGF)、成纤维细胞生长因子(fibroblast growth factor,FGF)、神经生长因子(nerve growth factor,NGF) 等则通过Ras-Raf-MAPK/ERK通路磷酸化TSC2。TSC1与磷酸化TSC2分离,解除其对Rheb的抑制作用,进而激活mTOR及其下游通路发挥相应功能。当细胞应激(如ATP∶AMP下降、缺氧等)时,腺苷蛋白激酶(AMP-activated protein kinase,AMPK)可以作用于TSC2蛋白的另外一个与Akt不同的磷酸化位点来激活mTOR通路。与此相反的是REDD1/2(regulated in development and DNA damage response 1/2)可非AMPK依赖性地促进TSC复合体形成,对mTOR通路发挥抑制作用。Rag是由RagA或RagB与RagC或RagD形成的二聚体,在氨基酸等营养素信号通路中发挥作用。当前者与GTP结合,后者与GDP结合时,Rag复合体可以募集到Raptor上,引导mTORC1定位到溶酶体内膜上,成为其与RhebGTP的作用平台。由此也可以看出,细胞缺乏氨基酸等营养因子时,即使有足够的生长信号,mTOR信号通路也不能发挥作用。
mTORC1主要受到营养、能量、生长因子以及应激的调节。当细胞营养和能量充足,或者接收到生长信号(如胰岛素、IGF-1等),无压力应激时,mTORC1通路通过上述途径被激活,磷酸化其特异性底物S6K1(substrates 6 kinase 1,亦可简写为p70S6K1)和真核细胞起始因子4E结合蛋白(eukaryotic initiation factor 4E-binding protein,4EBP) -1。S6K1下游底物包括PDCD4(programmed cell death 4)和eIF-4B(eukaryote initiation factor 4B)。一方面两者活化后可以促进eIF-4A组装形成eIF-4F起始复合体;另一方面p70S6K1上调rRNA聚合酶(RNA polⅠ)的转录活性以及核糖体的组装,均与蛋白质合成加速相关。当然,活化的S6K1还能通过磷酸化胰岛素受体底物(insulin receptor substrate-1,IRS-1)负反馈抑制胰岛素/Akt/mTOR通路,避免其过度激活。4E-BP1被磷酸化后,则与eIF-4E分离,后者募集起始因子eIF-4G、eIF-4A形成eIF-4F复合体,与mRNA的5′端结合,启动蛋白质的翻译。mTORC1还可以通过负向调节Ca2+/ Cam(calmodulin)与eEF-2K(eukaryote elongation factor 2 kinase)的结合,使得后者失活,eEF2被激活从而促进蛋白质翻译的延长。除了蛋白质合成之外,mTORC1还参与细胞自噬的调节。
mTORC2的研究不多,目前仅有证据表明其受到生长信号的调节,在酵母以及哺乳动物的细胞骨架和极性调节中发挥重要作用。但是新近研究发现mTORC2可以磷酸化AGC(cAMP-dependent,cGMP-dependent and protein kinase C)家族成员,包括Akt(也被称为PKB)、SGK(serum and glucocorticoid induced kinase)、PKC(protein kinase C)等,从而参与调控细胞周期进展、细胞生存及合成代谢。以Akt为例,当Serine473被mTORC2磷酸化后,就会继续引起PDK-1(3-phosphoinositidedependent protein kinase-1)对其Threonine308的磷酸化,从而彻底激活Akt。因而当Rictor缺失后,Serine473不能被激活,Akt下游底物Foxo1/3(forkhead transcription factor 1/3)磷酸化过程受到抑制,导致细胞凋亡的发生。但是Akt的另外一个靶蛋白TSC2却不受影响,提示可能有其他尚不清楚的机制参与了其中的调节(图2-9-2)。
