一、LMF/ZAG诱导脂肪分解的过程
LMF/ZAG诱导脂肪分解的过程与正常人体激素诱导脂肪自然分解的途径类似,与炎性细胞因子,脂肪组织自分泌、旁分泌激素及其他肿瘤源性因子的作用途径明显不同。细胞因子诱导脂肪动员和降解的第一步是:抑制血浆清除脂蛋白酶系功能,阻止脂肪细胞从血浆中摄取脂蛋白以用于储存,导致循环净脂酸含量的增加。如TGF-α可导致一个显著的高甘油三酯血症,然而与之相反LMF/ZAG并不会引起血浆甘油三酯水平的变化。
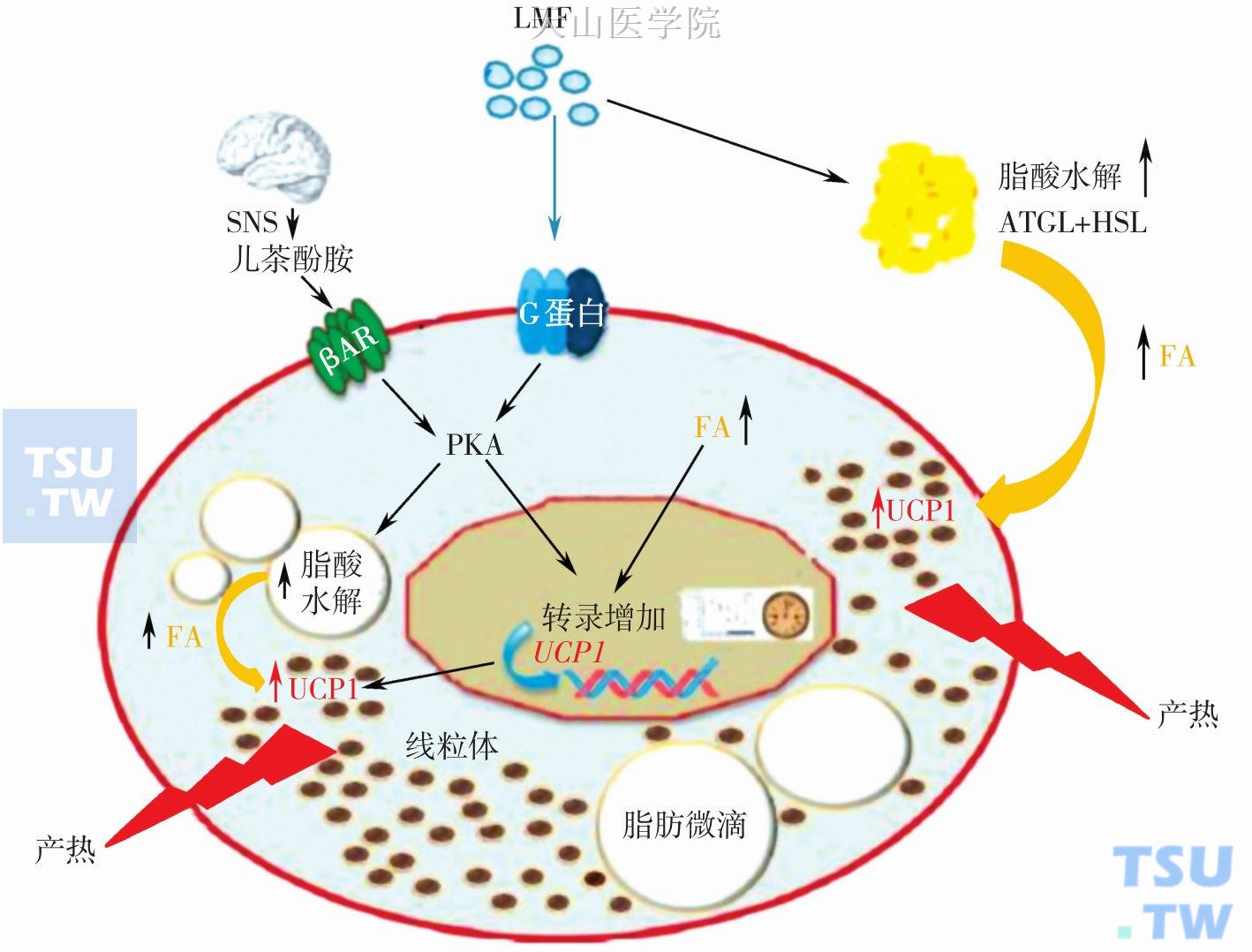
图2-14-3 肿瘤恶液质状态下,LMF、脂肪水解与BAT产热之间的关系
LMF和儿茶酚胺通过β3肾上腺受体(β adrenergic receptor,βAR) 激活蛋白激酶A (proteinkinase A,PKA) 刺激脂水解,升高游离脂酸(free fatty acids,FA)水平激活解偶联蛋白1(uncoupling protein 1,UCP1)并诱导其表达增加,使线粒体产热增加
二、LMF对WAT脂肪分解刺激作用
LMF/ZAG诱导脂肪分解的过程呈明显的剂量依赖性和时间依赖性,且有最大反应程度限制(图2-14-4)。并且对GTP浓度也有剂量依赖性,超过基础剂量后,脂肪水解迅速增加,在GTP 0.1µmol/L时,达到最大活化,到达平台期,GTP>5µmol/L时达到饱和,高浓度时也表现出抑制作用。ZAG和LMF的剂量反应曲线是相似的,在相同剂量下,其诱导的cAMP产物水平也是相似的。
三、体重丢失不超过20%的肿瘤患者血清和尿液中的LMF与其体重下降呈线性关系
表2-14-1 尿液LMF表达与体重下降之间关系
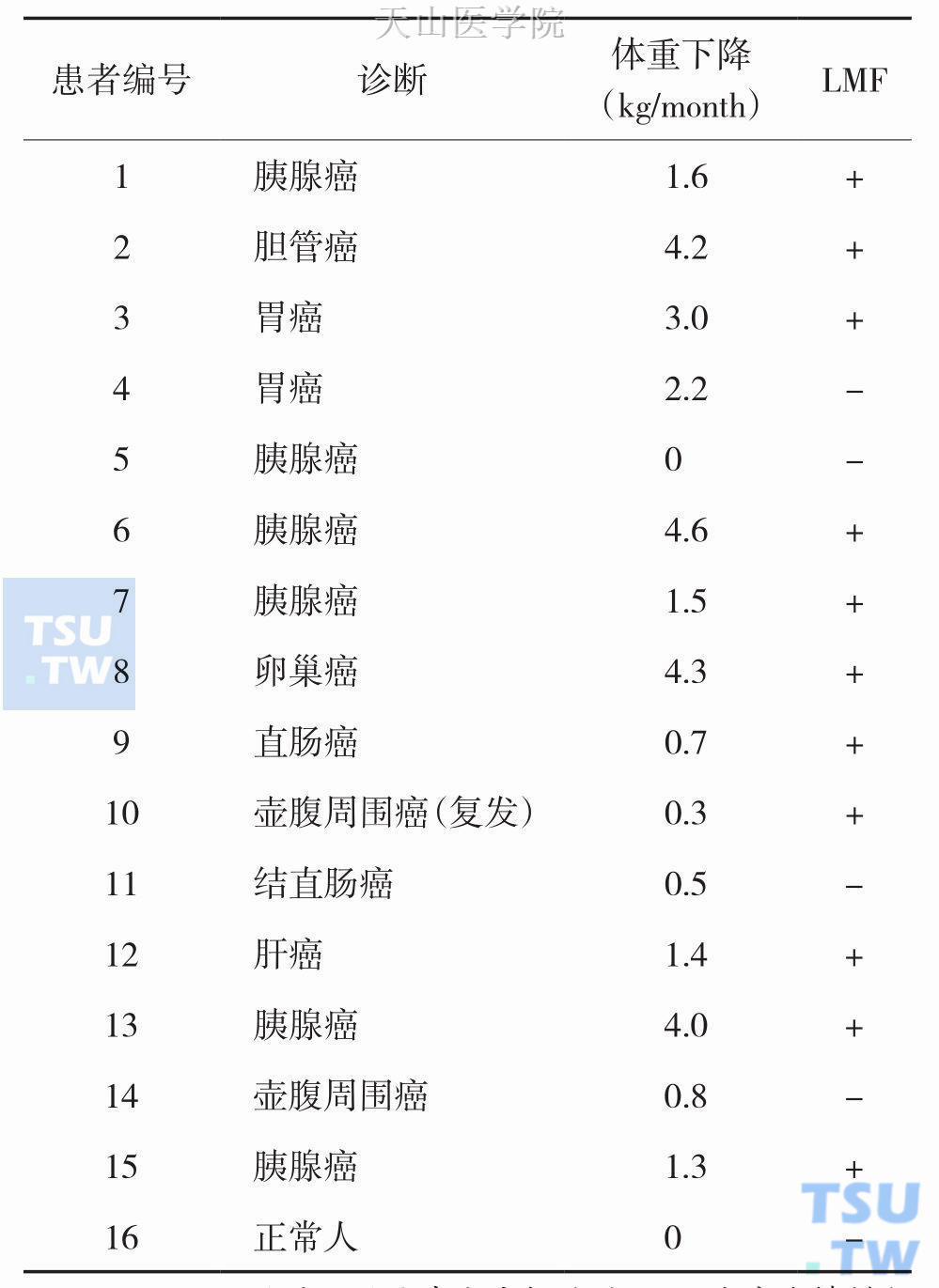
注:LMF阳性是以尿液中分离提纯的LMF浓度能够刺激分离培养的小鼠附睾脂肪细胞脂肪分解为标准
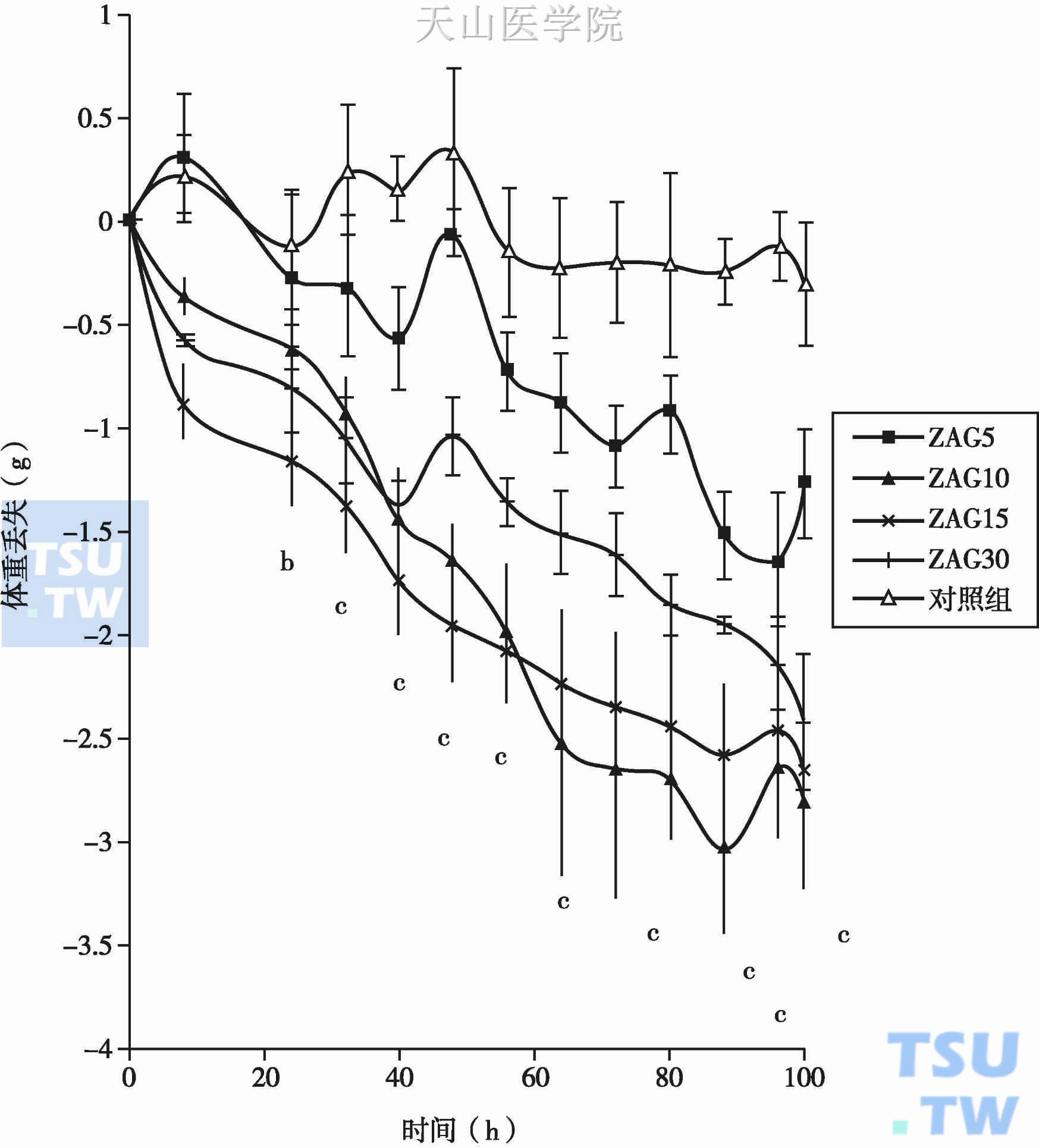
图2-14-4 ZAG应用对NMRI小鼠体重丢失的剂量、时间依赖性作用
ZAG 5(■)、10(▲)、15(×)、30(|) µg,对照组(△),结果以均数±标准差表示
Penio等研究显示有体重下降的肿瘤患者尿液中,多数可检出LMF阳性,而在无体重下降的患者和正常人则表现为LMF阴性(表2-14-1)。由于肌肉降解的加强、神经性厌食引起的进食减少等因素的参与,不难理解LMF与体重丢失超过20%的患者,失去线性关系的原因。但有趣的是多数研究证实LMF的浓度、脂肪动员作用均在体重下降10%~15%时达到最大作用,随着体重继续丢失其浓度和作用均下降,其所诱导代谢调节产物,也有类似改变,甚至Islam-Ali等研究也显示在荷瘤鼠重丢失10%时,WAT细胞膜上的Gαs/Gαi比率达到高峰,而在体重丢失20%时,Gαs/Gαi比率显著下降,已接近正常小鼠。目前产生这一分离现象的原因尚不清楚,但有研究者认为这一现象提示LMF在恶液质早期改变中的作用更加重要,因为恶液质早期脂肪的丢失早于肌肉组织。而在恶液质晚期,体内多种致恶液质因子参与下,三大物质代谢过程严重紊乱,LMF此时的具体作用及是否存在与其他因子的交互作用,目前尚不完全明晰。
四、LMF/ZAG增加脂肪动员,促进脂肪分解,导致脂肪组织减少,体重下降的作用,并不影响食物和水的摄入量
Penio等研究显示LMF/ZAG处理小鼠WAT较对照组减少42%,在肥胖小鼠(ob/ob小鼠)中减少了19%,但不影响机体总液体量和去脂体重。这一点与瘦素引起的体重下降,伴随着饮食减少明显不同。
