LMF/ZAG的脂肪动员作用,与生理状态下中枢交感神经(肾上腺素能神经)、激素(儿茶酚胺类激素、甲状腺素、睾酮等)刺激脂肪动员、诱导脂肪水解的自然过程基本一致,分子生物学通路也相似,均是通过G蛋白(guanine nucleotidebindingprotein,G-protein)耦联受体——环腺苷酸细胞信号通路实现的。
G蛋白耦联受体——环腺苷酸细胞信号通路是一种常见的细胞代谢调节跨膜信号通路。主要通过两种途径改变细胞代谢:一种是快速而精确的物质代谢调节途径,当外界环境迅速变化,机体应激时,细胞外信号(配体)迅速改变并与细胞膜上相应的G蛋白受体结合,通过GTP交换G蛋白上原本结合着的二磷酸鸟苷(guanosine diphosphate,GDP)使G蛋白的α亚基与β、γ亚基分离并激活,诱导腺苷酸环化酶(adenylyl cyclase,AC)催化三磷酸腺苷(adenosine triphosphate,ATP)环化,产生第二信使cAMP,cAMP浓度升高激活其下游的蛋白激酶A(protein kinase A,PKA),通过变构作用,磷酸化修饰其下游靶蛋白,迅速改变靶蛋白状态——激活或抑制——从而快速影响细胞代谢,以适应细胞外环境变化,并不影响靶蛋白表达;一种是慢而作用持久的基因表达调控途径,当细胞外环境稳定变化时,细胞信号传递至细胞核内,影响靶蛋白基因表达量,促进靶蛋白转录,提高细胞内靶蛋白含量,从而对细胞代谢产生慢而持久的影响。
LMF的脂肪动员作用可同时通过这两种途径进行。LMF孵育数分钟内即可诱导脂肪细胞内cAMP浓度显著升高,激活下游靶蛋白——脂肪酸甘油三酯酯酶(adipose triglyceridelipase,ATGL)和激素敏感性脂肪酶(hormone-sensitive lipase,HSL),并使它们由细胞质移位至细胞内脂肪微滴(乳糜微粒)膜上,启动脂肪酸快速水解过程:首先在ATGL介导下三酰甘油(triacylglycerol,TAG)水解为二酰甘油(diacylglycerol,DAG)并释放一个FA,随后DAG 在HSL催化下水解为单酰甘油(monoacylglycerol,MAG)再释放一个FA,最后MAG在单酰甘油脂解酶(monoacylglycerol lipase,MGL)介导下水解为甘油并释放最后一个FA(图2-14-1、图2-14-2),这一过程呈现出明显的LMF、cAMP剂量相关性。同时LMF的持续高浓度也可通过基因调节过程上调HSL的表达量,有研究显示肿瘤患者中HSL基因的表达量增加了2倍。
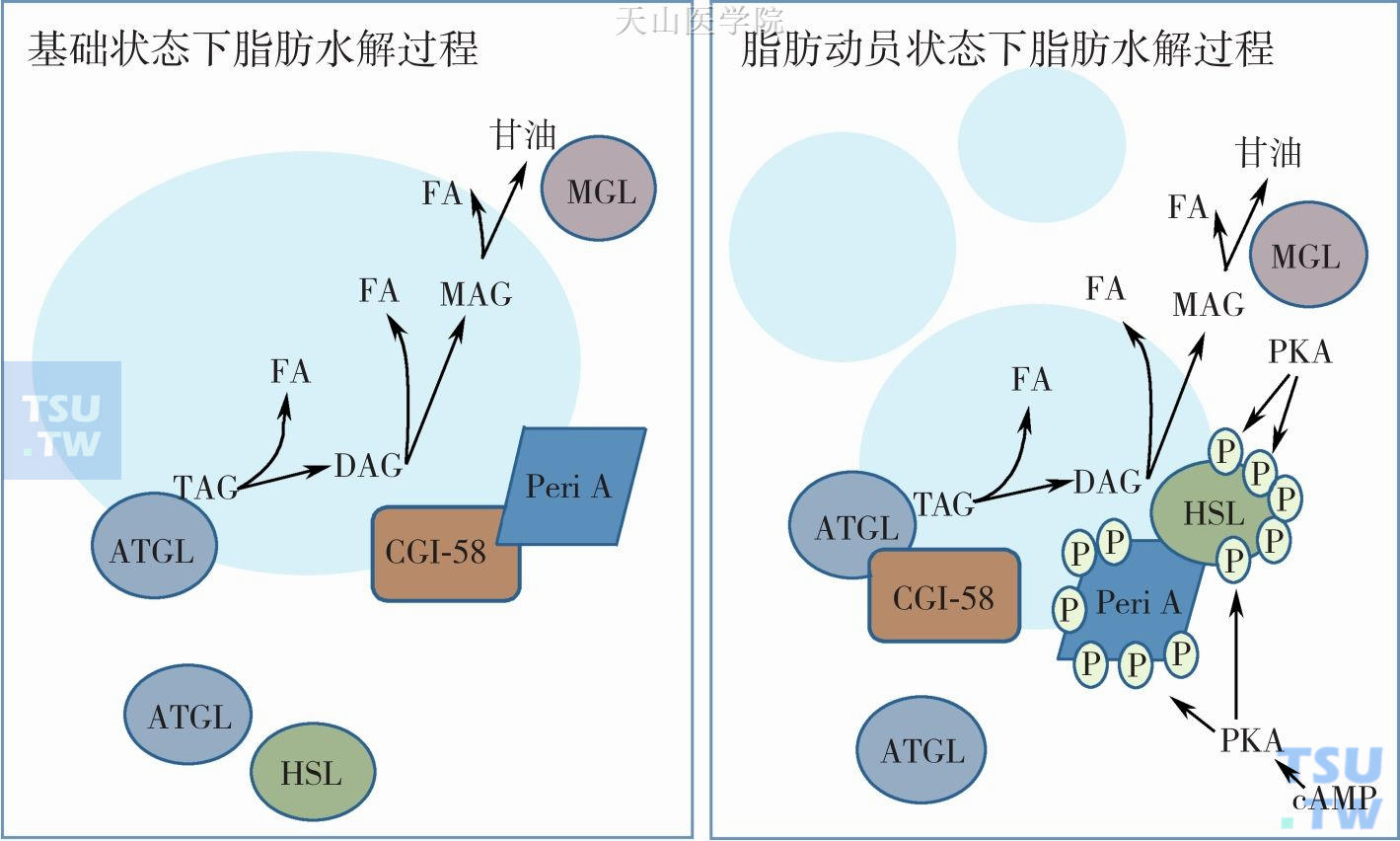
图2-14-1 脂肪水解基础状态与脂肪动员状态
在基础条件下,未被激活的围脂滴蛋白Perilipin嵌套于脂肪微滴表面 并与比较基因鉴定蛋白-58 (Comparative Gene Identification-58 CGI-58)结合。CGI-58对脂肪水解具有双重作用,未激活状态时阻止脂肪酶接近脂肪微滴,此时仅有少量的AGTL定位于脂肪微滴表面,而HSL大部分位于细胞质内,因而基础脂肪水解速度很慢。但当CGI-58处于激活状态CGI-58又是ATGL的关键助激活剂。脂肪动员调节因子如儿茶酚胺等刺激腺苷酸环化酶产生cAMP激活PKA,导致围脂滴蛋白和脂解酶磷酸化。磷酸化的围脂滴蛋白使脂肪微滴表面结构变化,促使CGI-58 释放,激活并诱导HSL移位于脂肪微滴膜表面,开启脂酸的快速水解。首先在ATGL介导下TAG水解为DAG并释放一个FA.紧接着HSL和MGL将其彻底水解为FA和甘油。
AGTL,Adipose triglyceride lipase,脂肪酸甘油三酯酯酶;CGI-58,Comparative Gene Identification-58,比较基因鉴定蛋白-58;FABP4,Fatty acid binding protein 4,脂肪酸结合蛋4;HSL,Hormone-sensitive lipase,激素敏感性脂肪酶;MGL,Monoacylglycerol Lipase,单酰甘油脂解酶;FA,Free fatty acids,游离脂酸;PKA,Proteinkinase A,蛋白激酶A;P,Phosphorylation,磷酸化;TAG,Triacylglycerol,三酰甘油;DAG,Diacylglycerol,二酰甘油;MAG,Monoacylglycerol,单酰甘油
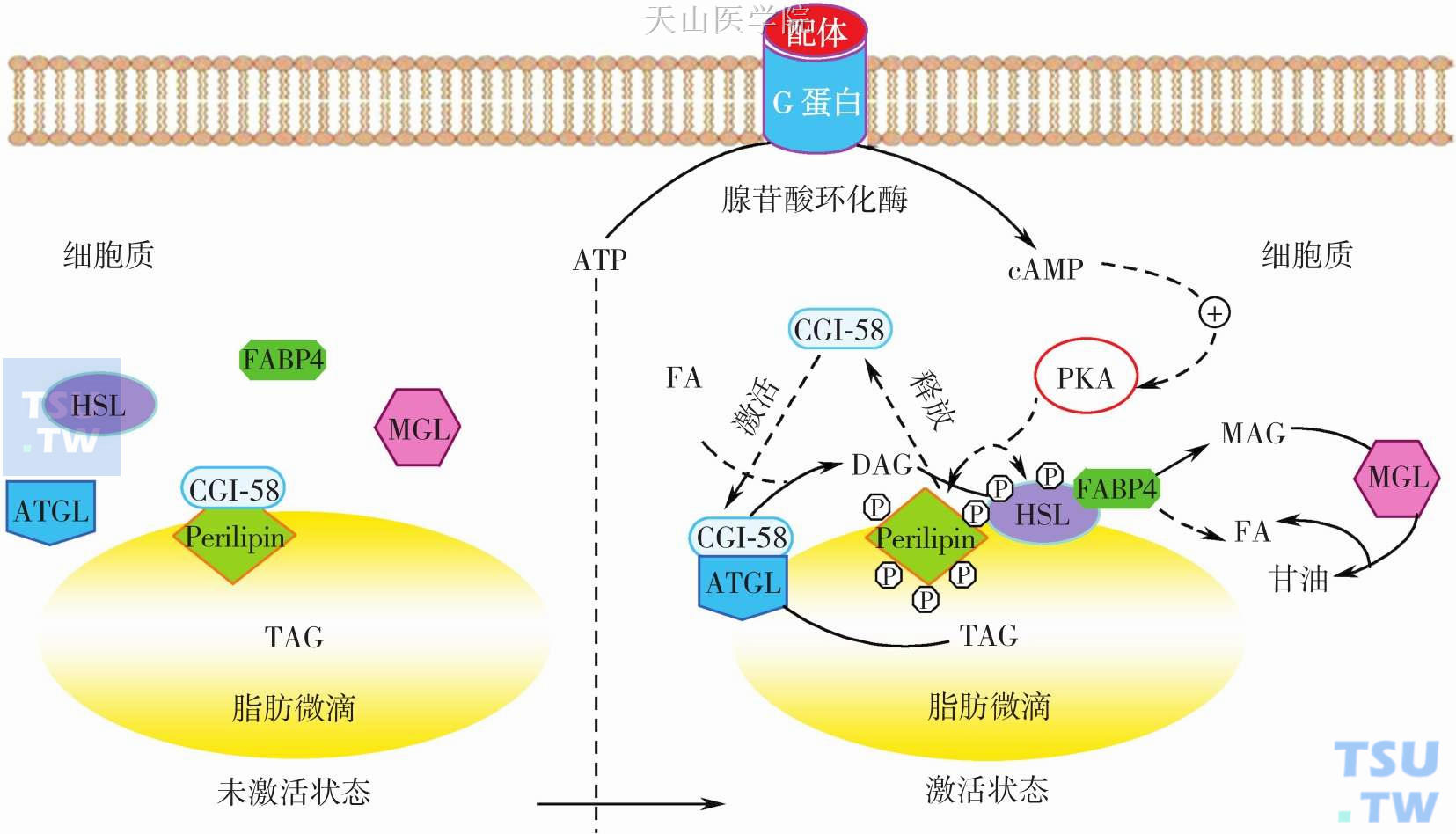
图2-14-2 G蛋白耦联受体-环腺苷酸途径介导的脂肪动员分子信号通路
图注同图2-14-1
但LMF具体是通过何种方式或何种G蛋白受体,诱导上述反应的,目前尚不完全明了。多数研究证实其作用受β3肾上腺素能受体(G蛋白耦联受体的一种)调节,可能LMF作为配体与β3肾上腺受体结合是其主要作用途径。LMF对WAT的影响程度与异丙肾上腺素相似,尽管LMF最大作用低于异丙肾上腺素。而且β3肾上腺受体拮抗剂SR59230A也可显著减弱其作用。但是β3肾上腺受体并不能完全解释其对G蛋白的作用。也有研究发现LMF和异丙肾上腺素均可通过增加脂肪细胞膜上的G蛋白表达量,即增加受体表达量,上调该通路的作用。Islam-Ali等研究显示LMF可直接增加WAT细胞膜上的G蛋白αs亚基(激活亚基)的表达,减少αi亚基(抑制亚基)的表达,从而升高细胞膜Gαs/Gαi比率,增强脂肪细胞对脂肪动员因子的反应性,显著增强脂肪分解动员。也就是说肿瘤恶液质时,LMF不仅可以直接动员脂肪分解,还可以通过上调Gαs/Gαi比率和HSL表达量,使机体对促脂肪分解刺激物的敏感性增强,从而最大限度的刺激机体脂肪细胞分解代谢。
目前研究已经发现LMF脂肪动员分子通路中,多个关键节点的调控酶,可能成为其代谢调节的靶点,如:磷酸二酯酶抑制剂Ro20-1724可显著减少cAMP降解,明显强化LMF脂肪动员作用;而腺苷酸环化酶抑制剂MDL12330A则可显著抑制其作用;cAMP依赖性蛋白激酶抑制因子H8(cAMP-dependent protein kinase inhibitor,H8)几乎可以完全阻断LMF的作用,与其对异丙肾上腺素的作用一样;β3肾上腺受体拮抗剂SR59230A,以及非选择性肾上腺素能受体阻断剂,如普萘洛尔等药物也可使LMF的脂肪动员作用显著降低。这些调节靶点的明确,有可能会成为今后肿瘤患者营养代谢治疗的新靶点。
事实上,LMF诱导脂酸分解增加,是与增强其氧化利用相伴随的。有研究显示短期应用LMF,即可使WAT耗氧量增加三倍,并伴随着产热反应。这一作用主要是LMF直接作用,或其诱导代谢产物——FA浓度升高所诱导的解耦联蛋白酶类(uncoupling proteins,UCPs)在棕色脂肪组织(brown adipose tissue,BAT)、WAT和肌肉组织中的表达增加所致。
UCP是一种线粒体内膜蛋白,能消除线粒体内膜两侧的跨膜质子浓度差,令利用质子浓度差驱动的氧化磷酸化过程减慢,阻碍ATP的正常产生。其作用的本质是通过解除了部分正常呼吸链中应有的电子传递与磷酸化两者之间耦联关系,使氧化磷酸化过程进入空转状态,将部分本用于制造ATP的能量转化为热量直接消耗,在调节机体能量平衡,过剩脂肪处理和体温维持中发挥着重要的作用。目前人体内共发现三种UCP同型蛋白:UCP1、UCP 2、UCP3。其中UCP1仅发现于BAT中,具有强大的解耦连活性,在小型动物和新生儿体温维持过程中发挥着至关重要的作用,UCP2、UCP3 在WAT、BAT和肌肉组织中均有表达。肿瘤恶液质时因循环FA浓度升高,能量摄入减少,UCPs表达明显增加,并在肿瘤恶液质脂肪利用和代谢中发挥重要作用。
ZAG可直接增强UCPs表达,并呈剂量反应性。有研究显示0.58µmol/L的ZAG可使BAT中UCP1表达增加6.5倍,肌肉组织中UCP2表达增加3.5倍,UCP3表达增加2.5倍,另外肝脏中UCP2的表达也有升高。这一作用也是由环腺苷酸途径所调节,cAMP和β3肾上腺受体交互作用实现的,甲基黄嘌呤可显著增强这一作用,而SR59230A则可抑制该反应,但UCP3表达增加却不受β3肾上腺受体调节。LMF和FA诱导的UCPs的上调,可能在肿瘤恶液质脂肪代谢过程中,有助于已动员脂酸的利用。
上述脂代谢分子生物学途径的变化,构成了肿瘤恶液质状态下,LMF/ZAG刺激脂肪动员、分解、氧化利用的整条通路。也就是说脂肪组织大量分解所产生的FA,实际上很大比例被用于直接氧化产热,而不是产生ATP供能(图2-14-3)。这是肿瘤恶液质患者静息能量消耗(resting energy expenditure,REE)显著增加的主要原因,同时也解释了为什么肿瘤患者长期发热及脂肪动员的增强,却并不能改善患者能量平衡,减少肌肉消耗的原因。
