膳食蛋白质被多种消化道蛋白酶水解为氨基酸和小肽后被机体吸收利用。吸收入体内的氨基酸和组织细胞内蛋白质降解氨基酸混合分布于细胞内液和细胞外液等各种体液中,这些氨基酸统称为氨基酸的代谢库 (metabolic pool)。代谢库中还包括一部分体内合成的非必需氨基酸。氨基酸在生命活动中具有广泛的生物学功能:氨基酸不仅是蛋白质的构建分子和能量代谢物质,而且可以转变成许多重要活性含氮化合物,如血红素、激素、神经递质、谷胱甘肽、核苷酸、辅酶和一氧化氮等。氨基酸种类多,根据是否参与蛋白质合成可分非编码氨基酸和编码氨基酸。非编码氨基酸不参与蛋白质合成,但参与许多代谢并具有许多重要活性,如同型半胱氨酸、磺酸丙氨酸、同型丝氨酸、鸟氨酸、瓜氨酸、精氨酸代琥珀酸、牛磺酸、γ-氨基丁酸、碘化酪氨酸(T4和T3)等。编码氨基酸为20种L-α-氨基酸,从营养角度又可分为必需氨基酸和非必需氨基酸:必需氨基酸有8种:缬氨酸、异亮氨酸、亮氨酸、苏氨酸、蛋氨酸、赖氨酸、苯丙氨酸和色氨酸,这些氨基酸不能在体内合成,必须由食物蛋白质供给。其余12种氨基酸为非必需氨基酸,但这些氨基酸在营养和代谢上与必需氨基酸是同等重要的。氨基酸在体内代谢概貌见图3-4-3。
脱氨基代谢
氨基酸可以通过氧化脱氨基、转氨基、联合脱氨基及其他脱氨基方式脱去氨基而生成α-酮酸。其中以联合脱氨基作用最重要。联合脱氨基作用是可逆的,这一过程又是体内合成氨基酸的主要途径。但因必需氨基酸相应的α-酮酸在体内不能合成,故必需氨基酸只能由食物供给。在骨骼肌和心肌中L-谷氨酸脱氢酶的活性很低,这些组织主要通过嘌呤核苷酸循环脱氨基。氨基酸经脱氨基后生成的α-酮酸在体内的代谢途径主要有以下三条:经联合脱氨基反应逆过程生成非必需氨基酸;部分氨基酸脱氨后转变为糖酵解途径或TCA循环的中间物可生成葡萄糖或糖原,部分氨基酸脱氨后可转变为乙酰CoA或乙酰乙酰CoA而生成脂肪酸和酮体;氨基酸脱氨后α-酮酸彻底氧化分解供能(图3-4-3,图3-4-4)。
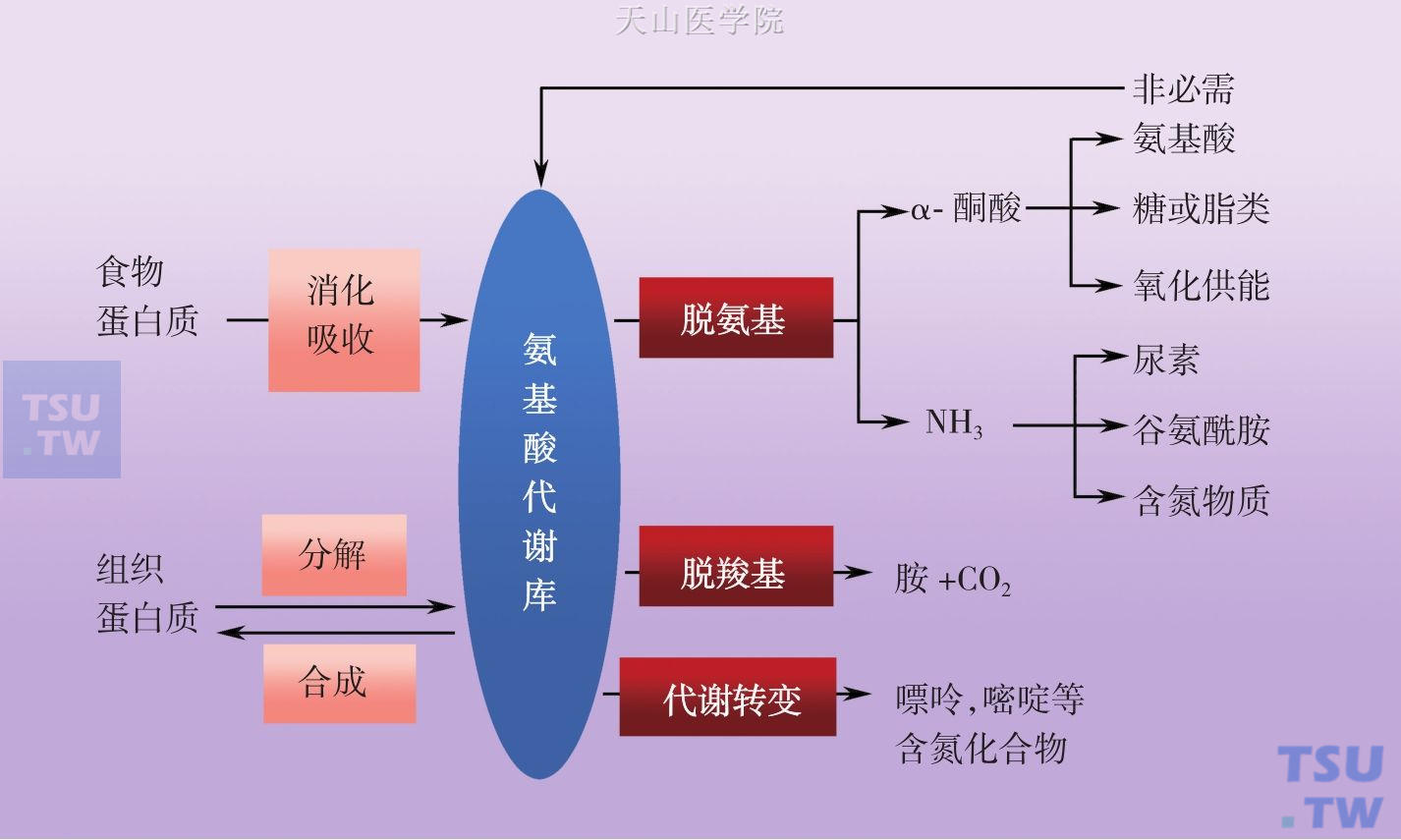
图3-4-3 氨基酸代谢概貌
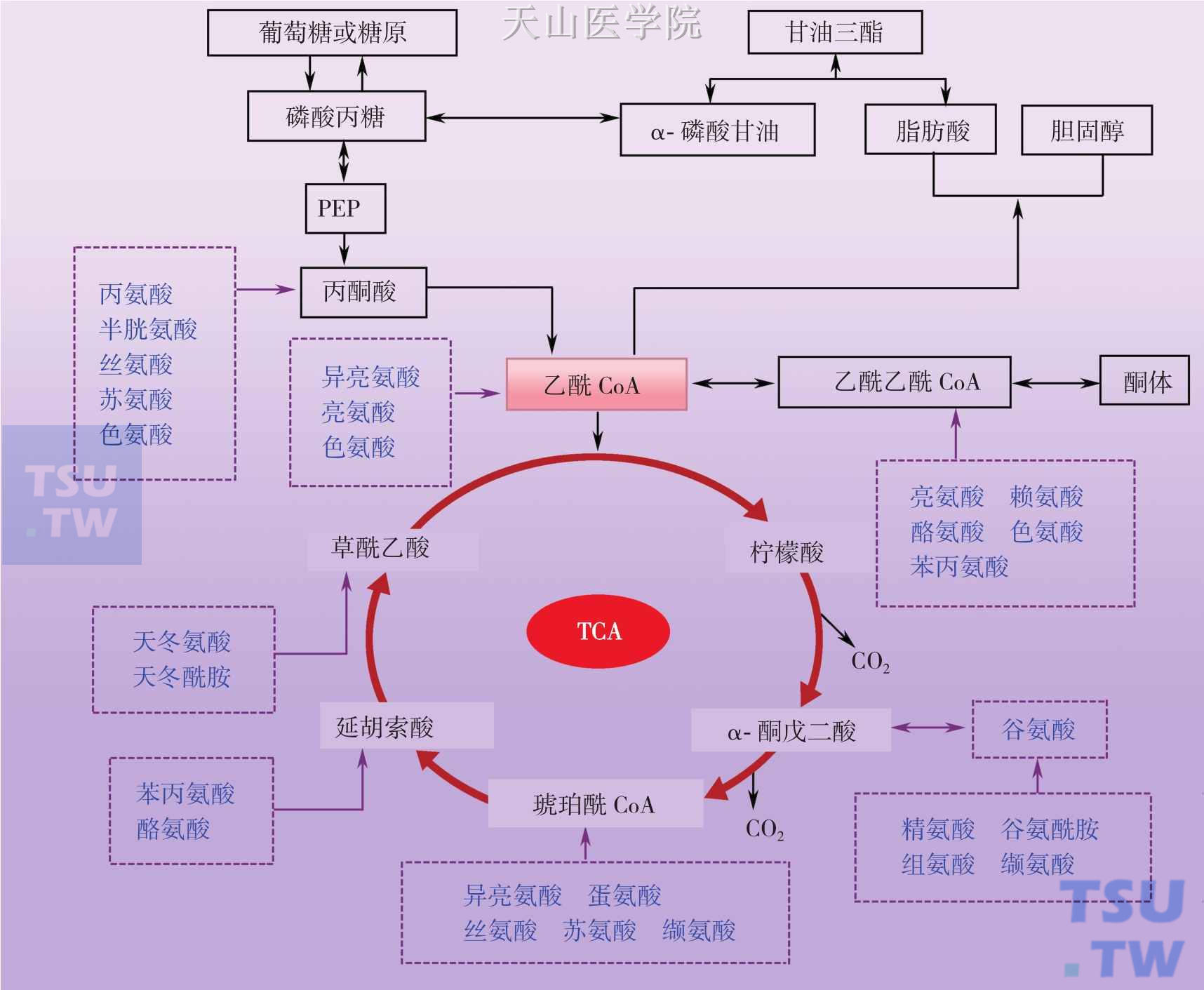
图3-4-4 氨基酸与糖、脂代谢的关系
脱羧基作用
有些氨基酸还可以通过脱羧基作用生成相应的胺类:如γ-氨基丁酸、组胺、5-羟色胺、儿茶酚胺、多胺和牛磺酸等,这些胺类具有重要生理作用。
氨代谢
哺乳动物机体内虽不断产生氨,但正常人血氨含量很低,一般低于60µmol/L,血氨维持在低量是通过氨来源和去路平衡调节相关。各组织产生的氨,以谷氨酰胺和丙氨酸两种形式运至肝脏,与肠道吸收入肝的氨一起通过鸟氨酸循环合成尿素或运至肾脏以铵盐的形式排出。在肌肉组织还以丙氨酸-葡萄糖循环方式运送肌肉产生的氨:肌肉蛋白质在分解代谢过程中,特别在饥饿等蛋白质分解代谢加强时,氨基酸经脱氨基而产氨增加。氨可通过与α-酮戊二酸结合生成谷氨酸,再经转氨作用将氨基转给丙酮酸而生成丙氨酸。丙酮酸主要来自葡萄糖氧化分解。丙氨酸在肌肉组织生成后经过血液运送至肝脏,在肝内丙氨酸经联合脱氨基作用脱去氨基生成丙酮酸。丙酮酸经糖异生途径而生成葡萄糖。葡萄糖再经血液输入肌肉。因而形成丙氨酸-葡萄糖循环。通过这一过程,肌肉将氨基酸脱氨基产生的氨运到肝生成尿素,同时也为肝脏提供糖异生的原料。这一循环对防止血氨升高有一定意义。
个别氨酸代谢
支链氨基酸代谢
支链氨基酸(branched chain amino acid,BCAA)包括亮氨酸、异亮氨酸和缬氨酸,因为它们分子侧链都有分支,故称这三种氨基酸为支链氨基酸。它们都属于体内不能合成而必须从食物中获得的必需氮基酸。
BCAA氧化分解代谢通路起始的两个酶是其分解的关键酶,包括支链氨酸氨基转移酶(BCAAT)和支链α-酮酸脱氢酶(BCKDH)。首先BCAA在BCAAT催化下进行可逆的转氨基作用,生成相应的酮酸,再经BCKDH催化进行不可逆的氧化脱羧,形成少一个碳原子的脂酰CoA,再在脂酰CoA 的α、β碳原子间脱氢形成双键,在双键间加水,形成β-羟酰基CoA,亮氨酸降解为乙酰乙酸和乙酰CoA,异亮氨酸降解为丙酰CoA 和乙酰CoA,缬氨酸降解为琥珀酰CoA,分别参加生糖和生酮反应,最后可进入三羧酸循环彻底氧化分解(图3-4-5)。亮氨酸是生酮氨基酸,异亮氨基酸是生糖兼生酮氨基酸,而缬氨酸是生糖氨基酸。
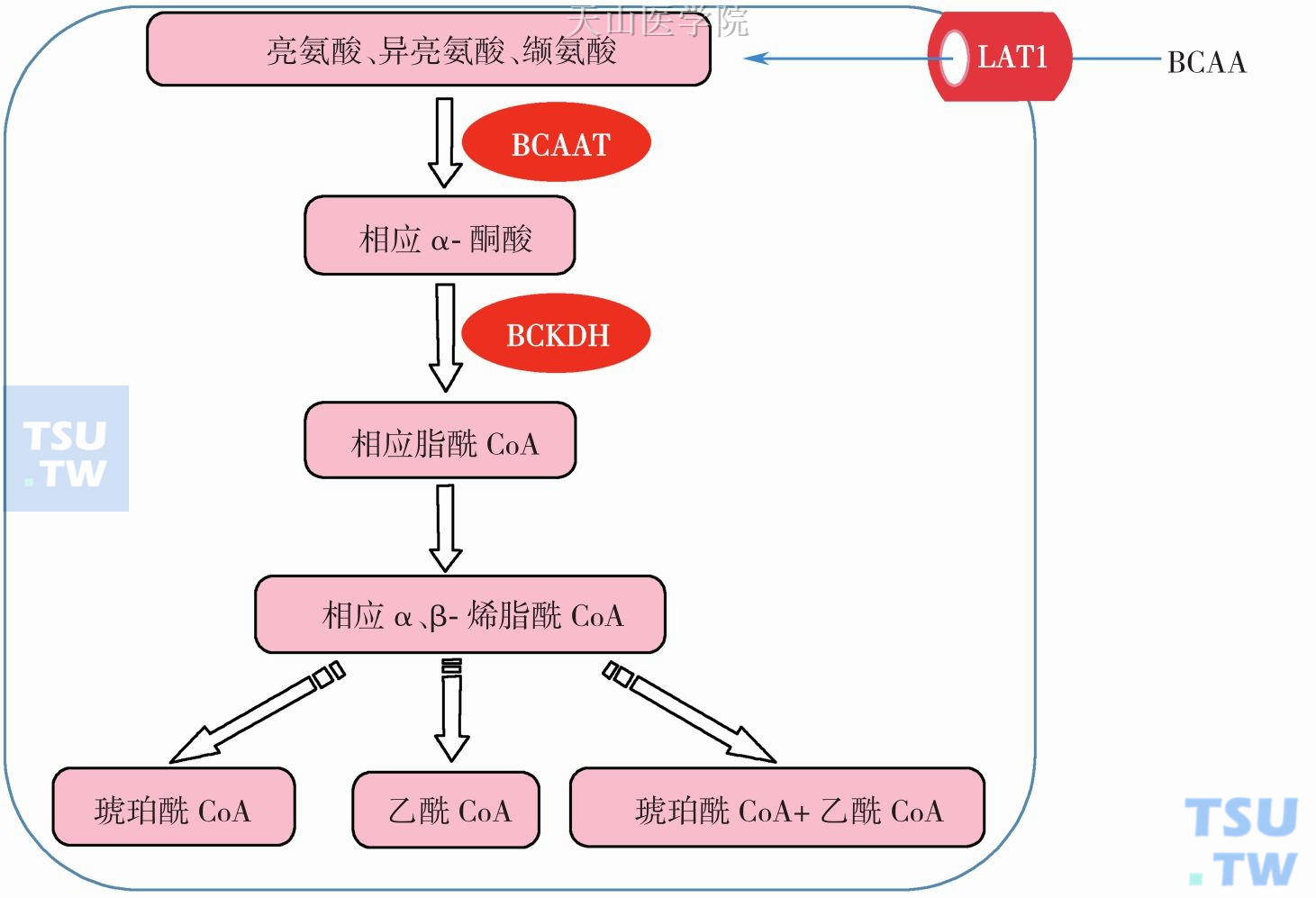
图3-4-5 支链氨基酸代谢:BCAA,支链氨基酸;LAT1,L-型氨基酸转运载体;BCAAT,BCAA 氨基转移酶;BCKDH,支链酮酸脱氢酶
BCAA是一类活跃的供能氨基酸,特别是肌肉中BCAA分解非常活跃,与其他氨基酸相比,BCAA能以相当快的速率转氨基和完全氧化,其氧化产生ATP 的效率高于其他氨基酸。同时在临床疾病(肝病和肿瘤等)过程中和治疗上发挥重要作用。
谷氨酰胺代谢
谷氨酰胺是体内最丰富的游离氨基酸,它是哺乳动物不同组织器官间转运氨的主要载体,在慢性疾病、创伤和长期锻炼等生理病理状况下,血浆谷氨酰胺浓度会持续下降,这时需要通过食物补充才能满足机体需求。因此有人提出谷氨酰胺是一个条件必需氨基酸,谷氨酰胺是合成嘌呤和嘧啶核苷酸、氨基酸、氨基甲酰磷酸、胺糖和其他代谢物的氮供体。谷氨酰胺作为谷氨酸和氨转运和储存形式在脑、肝、肾等组织中发挥重要生理作用。
谷氨酰胺分解途径主要通过TCA循环完成(图3-4-6)。谷氨酰胺可通过磷酸依赖的谷氨酰胺酶水解为谷氨酸和氨,谷氨酸可以相继转变为α-酮戊二酸、天冬氨酸、丙酮酸、乳酸、丙氨酸和柠檬酸等。这些代谢物可以彻底氧化分解产能,也可出线粒体参与其他的合成代谢。胞外谷氨酰胺进入线粒体分解需要通过质膜和线粒体内膜上的两个转运载体,质膜谷氨酰胺转运载体认识较清楚,而线粒体内膜转运载体由于特殊微环境和高速率转运等对其特性认识还不清楚。哺乳动物谷氨酰胺酶(glutaminases,GLS),有两种类型有两个独立基因编码:肾型(K型)由2号染色体上Gls1基因编码,肝型(L型)12号染色体Gls2基因编码。每一种基因又产生两种同工酶:K型同工酶分别称KGA和GAC,L型同工酶分别称LKG和GAB。这些同工酶在分子量、酶动力学、免疫特性和活性调节等方面都有差异。这些不同的同工酶亚型表达丰度在不同类型的细胞、不同代谢状态和不同发育阶段是不同的。
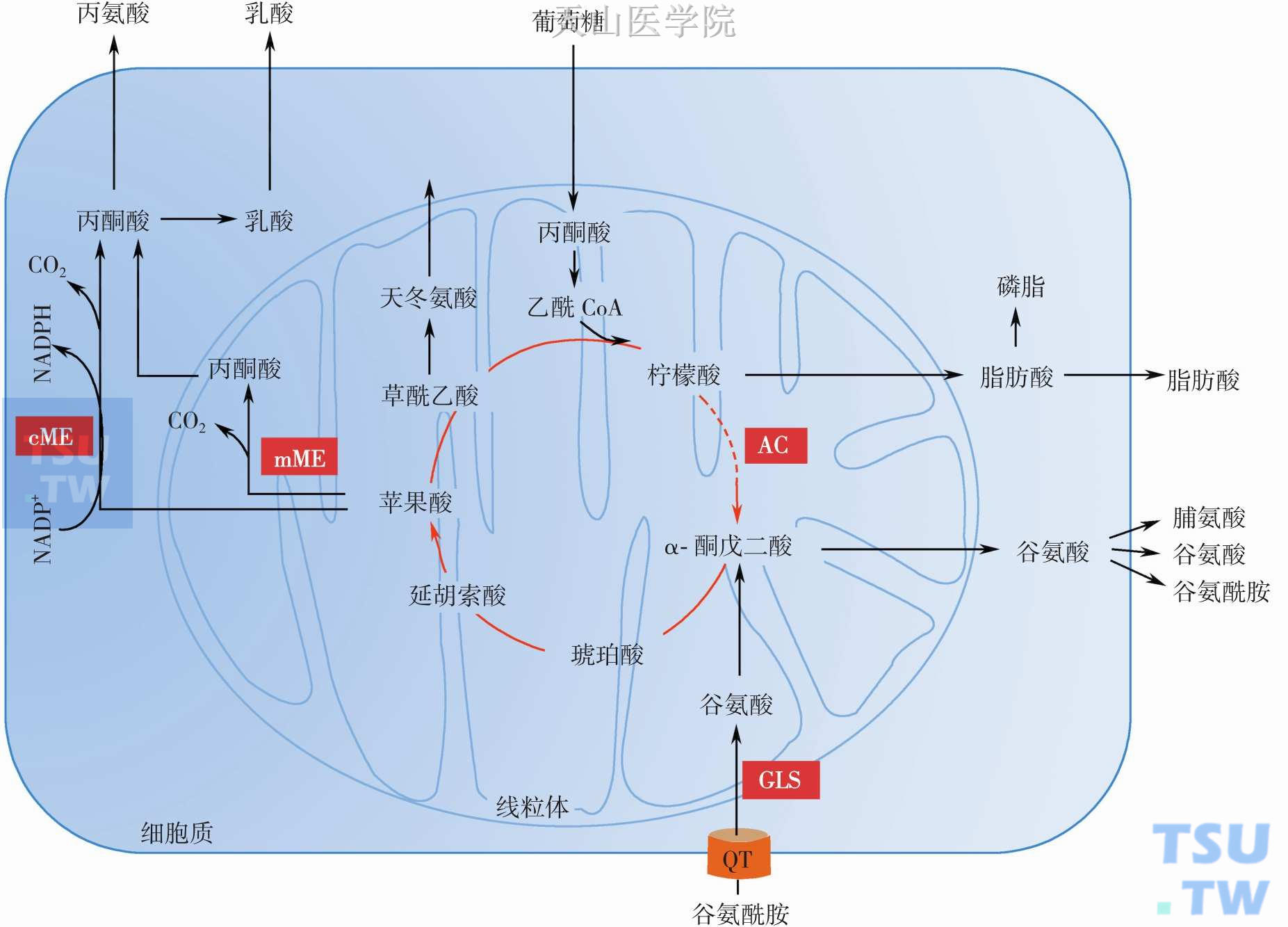
图3-4-6 谷氨酰胺代谢:AC,顺乌头酸酶;cME,胞质苹果酸酶;mME,线粒体苹果酸酶;GLS,谷氨酰胺酶;QT,谷氨酰胺转运体
含硫氨基酸代谢
含硫氨基酸包括蛋氨酸、半胱氨酸和胱氨酸三种。蛋氨酸是一种重要的必需氨基酸,主要通过食物摄入,也可通过同型半胱氨酸(Hcy)再循环合成,蛋氨酸重要代谢是合成S-腺苷蛋氨酸(AdoMet),AdoMet是活泼的甲基供体,通过蛋氨酸循环的转甲基作用,参与生物活性分子合成、表观遗传修饰(包括组蛋白和基因DNA的甲基化修饰等),蛋氨酸循环还与半胱氨酸代谢和叶酸再利用的一碳单位代谢相关(图3-4-7)。半胱氨酸可参与GSH合成和转硫反应,还可生成牛磺酸,后者是结合胆汁酸的组成成分之一。脑组织中含有较多牛磺酸,生理作用尚不清楚。含硫氨基酸经氧化分解后可以产生硫酸根。一部分可以无机盐类形式随尿排出体外,一部分经活化变成活性硫酸根,即3′-磷酸腺苷5′-磷酸硫酸(PAPS)参与硫酸修饰代谢。
一碳单位代谢
甘氨酸、丝氨酸、蛋氨酸、色氨酸和组氨酸等在分解代谢中可产生的含一个碳原子的活性基团。一碳单位的主要功能是参与嘌呤和嘧啶合成,还参与基因表观遗传的甲基化修饰,以及参与许多种含甲基的生理活性物质,如胆碱、肌酸、肉碱以及肾上腺素等合成。一碳单位代谢涉及相关氨基酸(蛋氨酸、半胱氨酸、同型半胱氨酸等)和维生素(维生素B12、维生素B6、维生素B2、维生素C和叶酸等),DNA甲基化修饰等表观遗传学改变与基因表达调控密切相关,因此,相关一碳单位代谢改变也与肿瘤发生和发展密切相关。
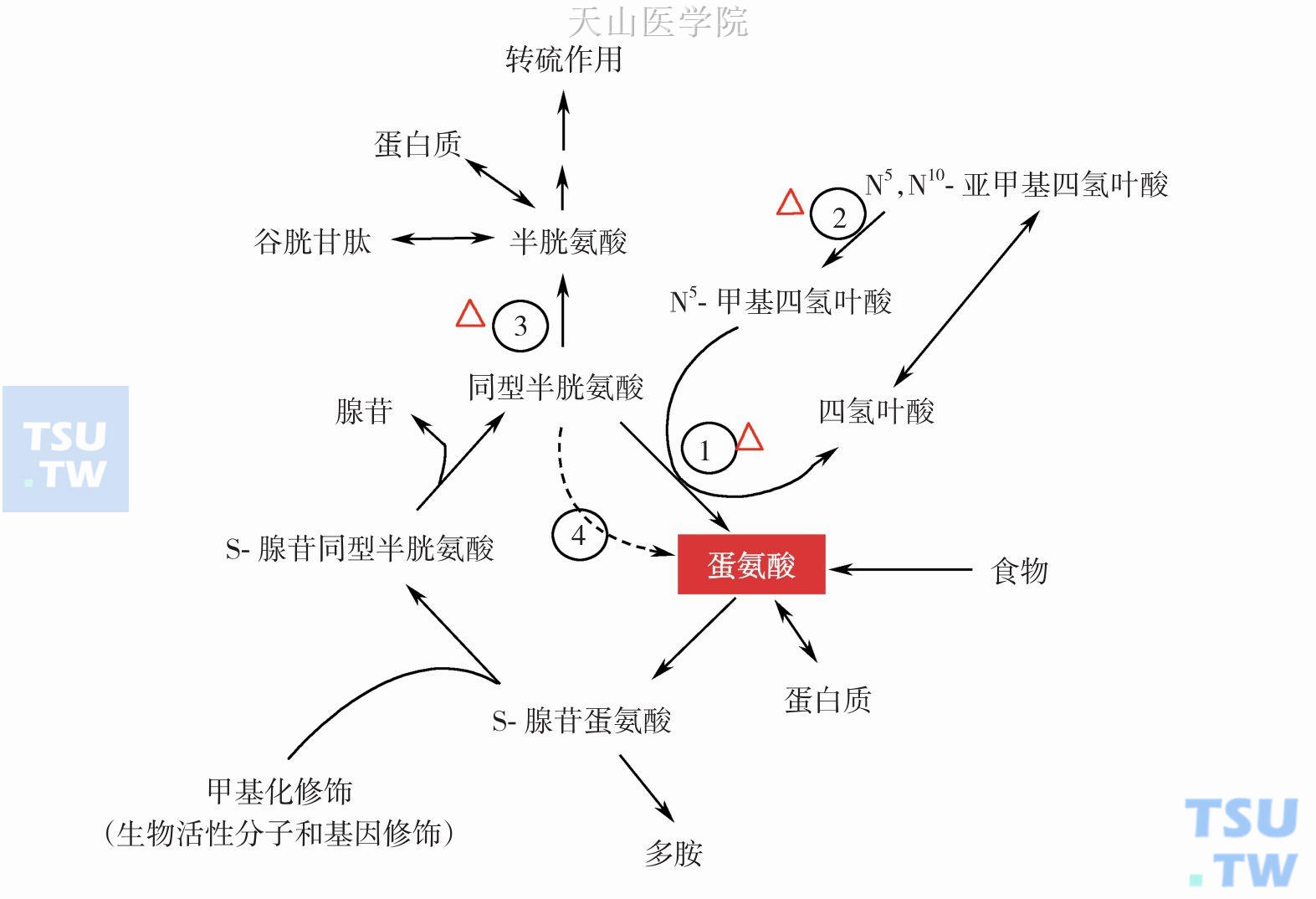
图3-4-7 蛋氨酸代谢:①蛋氨酸合酶;② N5,N10-亚甲基四氢叶酸还原酶;③ 胱硫醚β合酶;④ 甜菜碱合酶
芳香族氨基酸代谢
芳香族氨基酸(aromatic amino acid,AAA)包括苯丙氨酸、酪氨酸和色氨酸。苯丙氨酸羟化转变为酪氨酸,少量可经转氨基作用生成苯丙酮酸。酪氨酸可参与儿茶酚胺和黑色素代谢。还有甲状腺激素是酪氨酸的碘化衍生物。
