恶液质不是一种原发病,而是一种继发性综合征。肿瘤性恶液质是恶性肿瘤导致的,恶性肿瘤是因,恶液质是果。恶性肿瘤通过直接消耗能量,干扰代谢,机械作用及治疗毒副作用等四个机制导致恶液质。
能量消耗
肿瘤患者静息能量消耗(resting energy expenditure,REE)增加。尽管不同肿瘤患者的REE差异非常大,但是肿瘤患者的平均REE水平与基础能量消耗(basal energy expenditure,BEE)比值>110%,提示肿瘤患者整体上处于高代谢状态,图4-1-1。生理条件下,REE升高会自主增加摄食量,以满足机体的能量需求。但是,肿瘤患者REE与摄食量之间的反馈调节机制丧失,摄食量没有随着REE升高而相应增加,或者说没有增加到应有水平,从而造成巨大的能量负债(赤字)(energy deficit),进而导致营养不良及恶液质。
并非所有肿瘤患者的REE都是一致性升高,肿瘤类型似乎是REE的主要决定因素。恶性程度高、分化程度差、分解代谢显著的肿瘤如肺癌其REE增加明显,而恶性程度低、细胞分化好、分解代谢不显著的肿瘤如甲状腺乳头状癌、乳腺癌等REE无显著升高。此外,REE还与体重有关,体重显著下降者、低体重者REE显著升高,超重者REE显著降低。PET-CT可以很好地探测肿瘤细胞的代谢情况,借此区别良、恶性肿瘤。
干扰代谢
肿瘤本身产生的各种代谢因子如脂肪动员因子(lipid mobilizing factor,LMF)、蛋白水解诱导因子(proteolysis-inducing factor,PIF)直接导致机体脂肪降解及蛋白质分解,进而导致恶液质综合征。PIF 及LMF的作用是通过上调泛素-蛋白酶体通路(ubiquitin-proteasome pathway,UPP)及脂肪细胞的脂解作用,进而诱导骨骼肌蛋白质的降解及脂肪组织消耗。
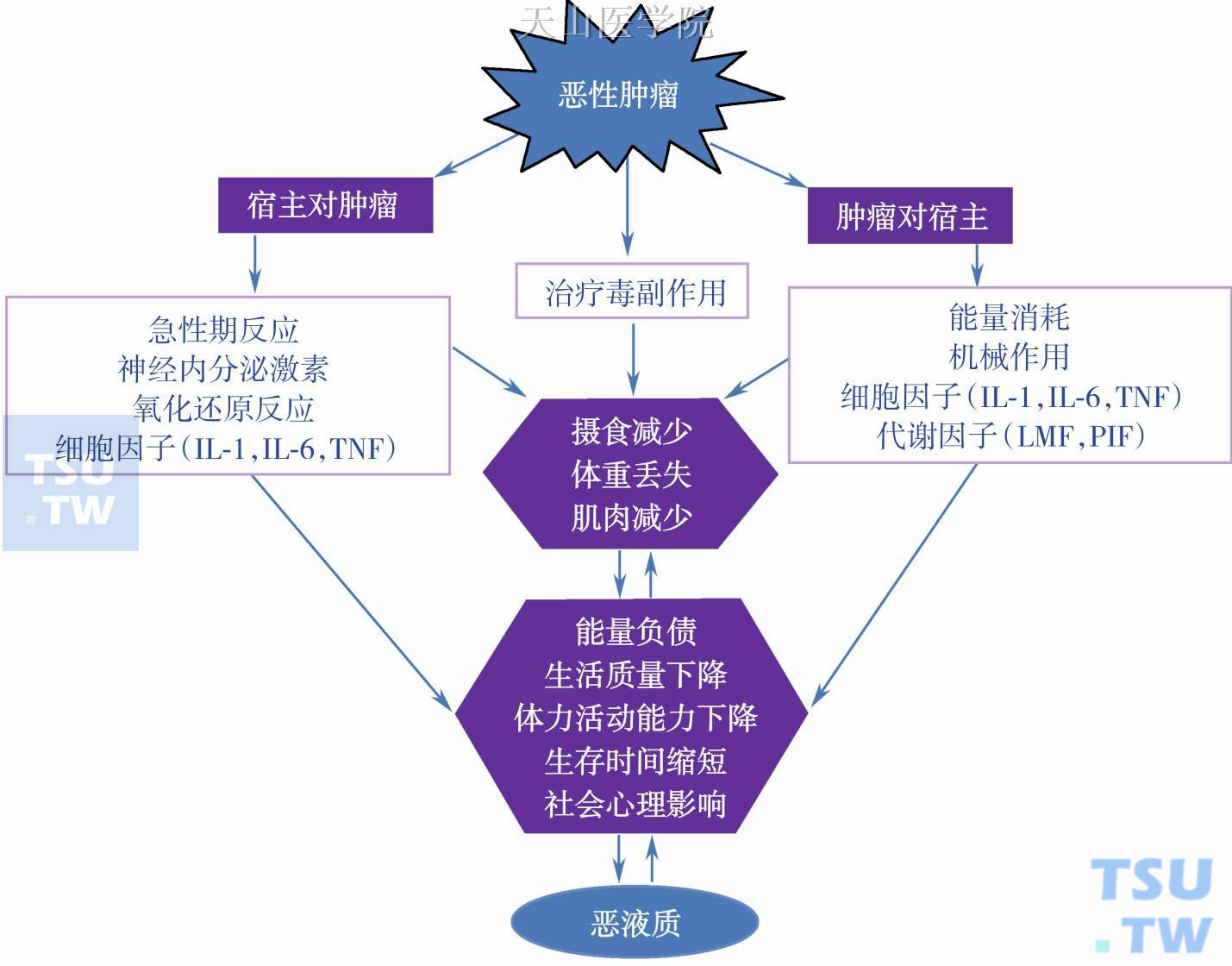
图4-0-1 肿瘤恶液质的病理生理模式图
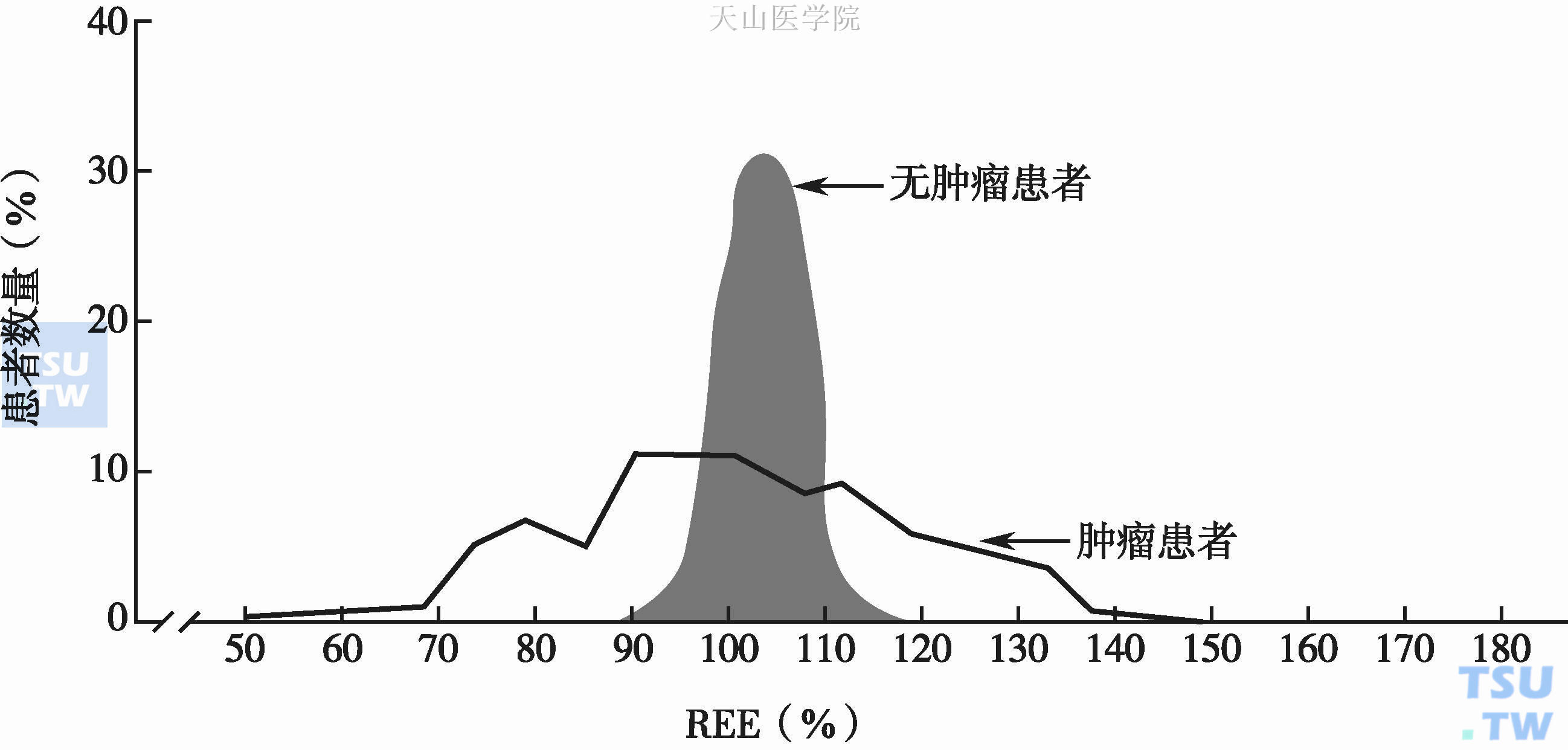
图4-1-1 恶性肿瘤患者与无恶性肿瘤患者的代谢情况比较
说明:代谢率=1.12±0.14(>110%),n=295
恶性肿瘤是一种慢性、低度、不可逆性炎症,参与恶液质的炎症介质包括IL-6、TNF-α、IL-1β、IFN-γ。尽管多种组织细胞可以分泌炎症介质,但是肿瘤本身也是一个重要来源。炎症因子本身可以诱导体重下降,TNF-α通过泛素-蛋白酶蛋白水解通路(the ubiquitin-proteasome proteolytic pathway,UPPP)对骨骼肌、脂肪组织发挥直接分解作用,导致肌肉萎缩(图4-1-2)。
肿瘤的代谢干扰作用会引起一系列生理及心理症状,包括早饱、厌食、恶心、呕吐、疼痛、发热、腹泻、便秘、抑郁、焦虑、恐惧、失眠等,其中以食欲下降最为常见,从而直接或间接导致营养物质摄入减少,最终产生营养不良。上述症状在肿瘤的整个病程中均可出现,早期肿瘤患者即已存在这些症状,一个肿瘤患者常常同时合并多种症状,一个症状可见于多种不同的肿瘤患者。体重明显下降的患者,出现的症状更多。这些症状与营养不良的关系非常明确:症状越多,营养不良越重。
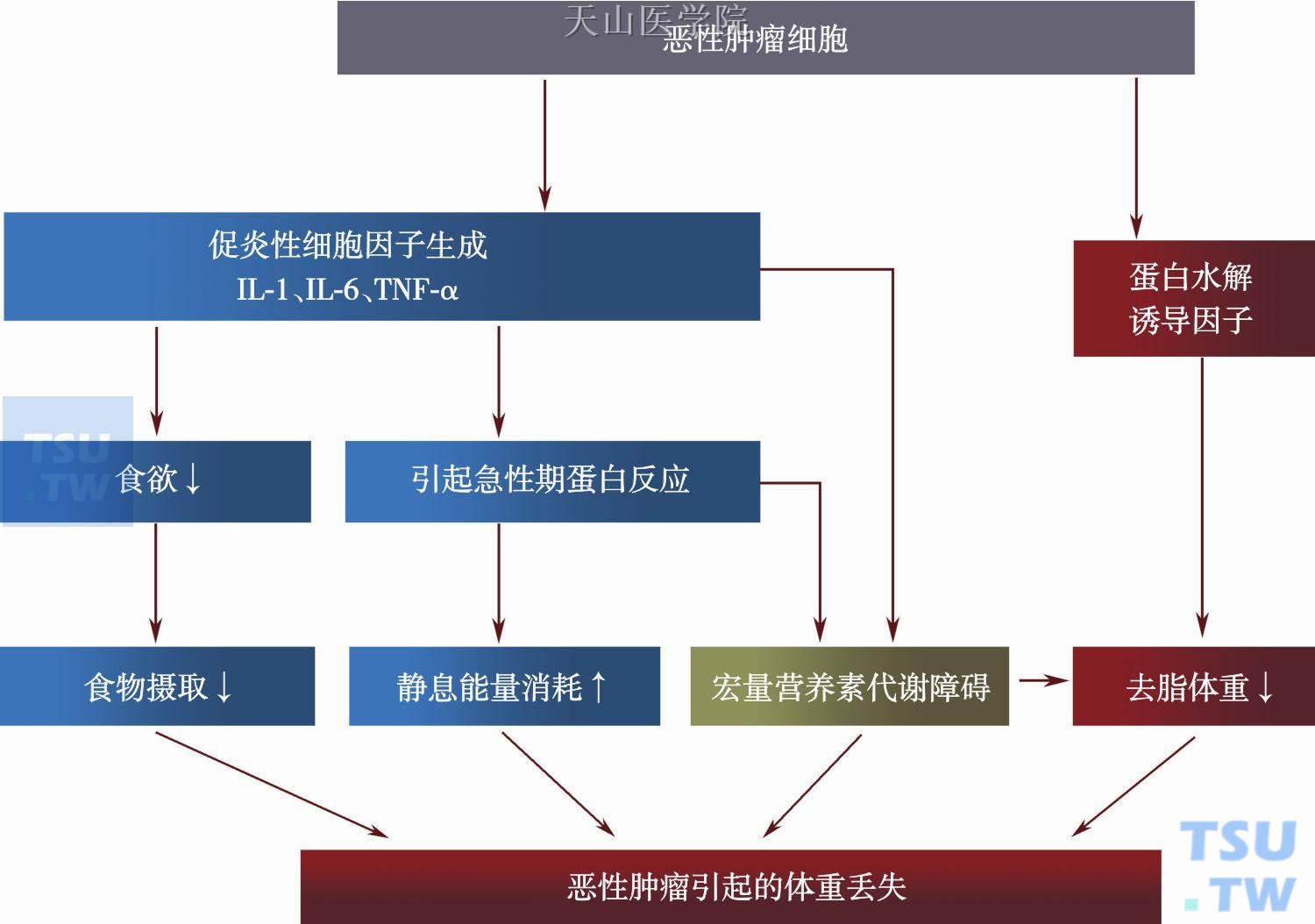
图4-1-2 恶性肿瘤引起的代谢变化
机械作用
恶性肿瘤瘤体本身的占位、压迫及梗阻也是导致恶液质的重要原因,尤其是肿瘤造成的消化道梗阻。消化道肿瘤本身的占位引起消化道功能障碍,从而出现一系列症状如早饱、厌食、恶心、呕吐、疼痛、腹泻、便秘等,其中以食欲下降最为常见。胃癌的瘤体占位作用较多引起上消化道症状如早饱、厌食、恶心、呕吐,使摄食量明显减少。结直肠癌瘤体的占位作用较多引起下消化道症状如腹泻、便秘。与下消化道肿瘤相比,上消化道肿瘤对营养与摄食影响更大,更加容易发生恶液质。
恶性肠梗阻(malignant Bowel Obstruction,MBO)是指原发性或转移性恶性肿瘤造成的肠道梗阻,文献报告的发生率差异很大,为3%~43%。原发于腹腔及盆腔的恶性肿瘤是MBO的最常见原因,也可以由其他部位的实体肿瘤向腹腔及腹膜转移而成。尽管MBO是晚期肿瘤患者的常见并发症,但是它可以发生于肿瘤进程中的任何阶段。Ripamonti C等报告最常见并发肠梗阻的原发肿瘤为卵巢癌(5.5%~51%)、结直肠癌(10%~28%)和胃癌(30%~40%)。小肠梗阻最为常见(占61%),大肠梗阻次之(占33%),大肠和小肠同时受累较少(20%)。卵巢癌并发MBO占癌性小肠梗阻的50%,占癌性大肠梗阻的37%。
MBO发生后,肠道局部和全身出现一系列病理生理变化,见图4-1-3。肠道内液体分泌-吸收平衡破坏是肠梗阻最重要的病理生理环节。
正常情况下,人体消化腺每天分泌入肠腔的液体总量约8200ml,其中的消化酶、胃肠液、电解质等促进营养物质吸收。肠梗阻发生后,肠腔内液体积聚在梗阻以上部位,导致梗阻近段肠腔扩张。积聚的胃液、胰液、胆道分泌物进一步刺激肠液分泌,肠腔扩张、肠壁变薄,肠道对水、电解质及营养素的吸收能力下降;同时肠壁表面积增大,肠腔内液体分泌量进一步增加,形成分泌—扩张—分泌的恶性循环。尽管肠道运动不能使肠内容物通过,但肠道仍然持续不协调蠕动,这进一步加重肠梗阻近端肠道的扩张。梗阻肠道的“扩张—分泌—运动”活动引发了MBO一系列临床症状,包括肠绞痛(72%~76%患者),腹胀、腹痛、肝脏肿大或肝脏肿物(92%患者)、呕吐(68%~100%患者)。梗阻肠腔内压增高,导致肠壁静脉回流障碍,毛细血管及小静脉淤血,肠壁充血水肿。随着病情进展,肠壁动脉血运受阻,静脉回流障碍,血管内血栓形成,肠壁坏死、穿孔。肠壁充血水肿还可导致前列腺素、血管活性肠肽等因子分泌增多,细胞膜通透性进一步增加,肠腔内液体积聚进一步加剧。同时,肠梗阻部位的炎性反应还可引起肿瘤水肿,瘤体增大,进一步加重恶性循环。肠腔内大量液体积聚,细菌繁殖,引起全身病理生理病变。临床表现为水电解质平衡紊乱、酸碱失衡、循环血容量减少、细菌毒素入血、感染、中毒,病情严重时引起多器官功能衰竭,最终导致休克、死亡。对MBO,Goto T等报告手术治疗比保守治疗更加有效,手术治疗患者生存时间显著延长(图4-1-4)。
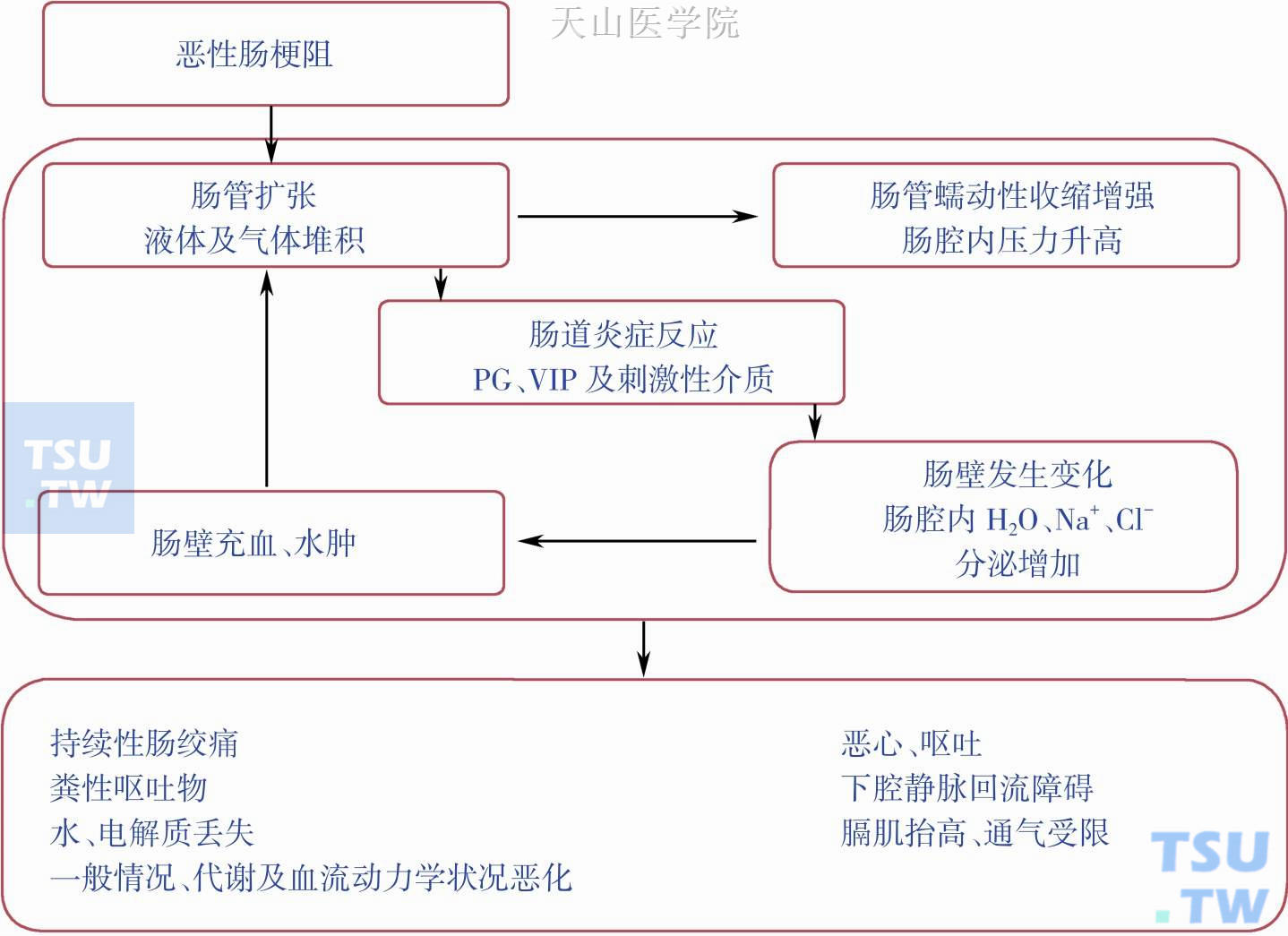
图4-1-3 恶性肠梗阻的病理生理:PG,prostaglandins,前列腺素;VIP,vasoactiveintestinal polypeptide,血管活性肠肽
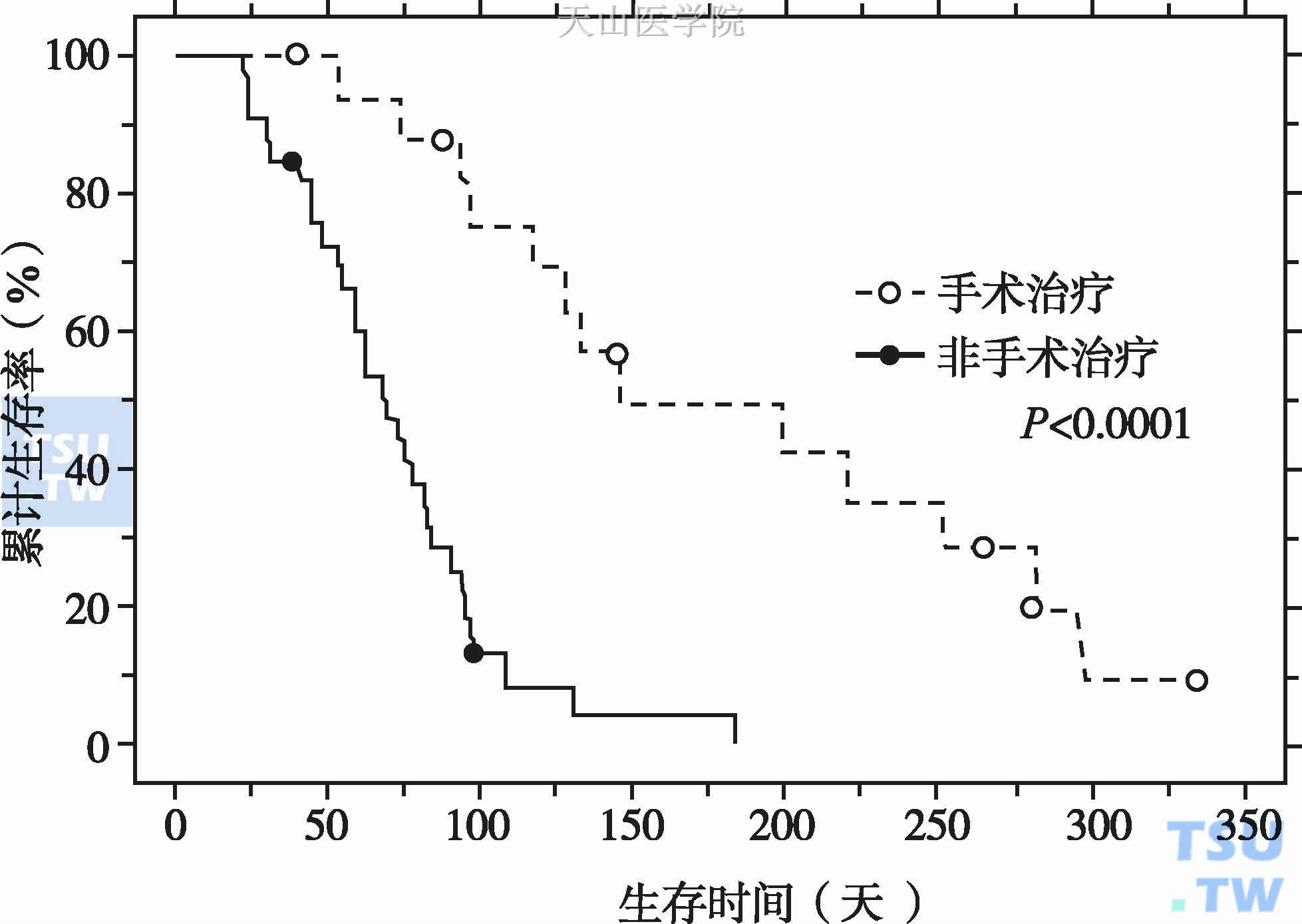
图4-1-4 恶性肠梗阻手术治疗与非手术治疗的效果比较
治疗毒副作用
抗肿瘤治疗对机体的影响是营养不良、恶液质的另外一个重要原因。几乎所有的化疗药物都可能导致营养相关副作用,化疗最常见的两种急性反应是恶心和呕吐。不同化疗药物口服或静脉注射的呕吐反应见表4-1-1、表4-1-2。化疗的毒副作用一般开始于化疗后数小时,化疗后1~2天最为突出,化疗后5~7天消退。化疗可以直接影响新陈代谢,或因为引起恶心、呕吐、腹泻、味觉改变、食欲减退以及厌食而间接影响营养物质的摄入。
表4-1-1 口服抗肿瘤药导致呕吐的可能性

表4-1-2 抗肿瘤药物静脉给药导致呕吐的可能性

放疗对营养的影响取决于患者状态、肿瘤位置、放射线类型、照射野大小、治疗剂量和持续时间,放射剂量和解剖部位是潜在副作用的决定因素。放疗对营养的影响可以概括为两个“远”,即:远隔效应与远期效应。远隔效应是指非腹部的放疗可以引起严重的小肠黏膜损伤,影响患者的消化与吸收,导致营养不良。远期效应是指放疗的毒副作用出现较晚,持续时间较长,可以数月、数年甚至终身。总体上说,放疗对营养的干扰可能较化疗更大。不同放疗的毒副作用见表4-1-3。
表4-1-3 放射治疗对营养的不良结果
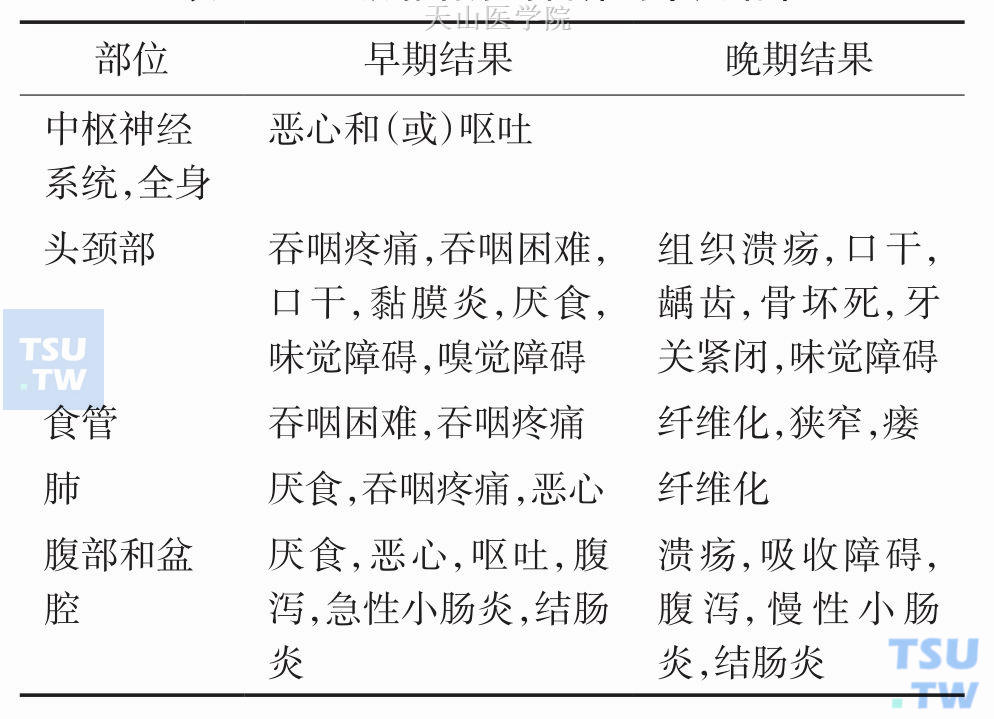
Givens DJ等人总结了放化疗的急性期及后期毒副作用,见表4-1-4,所有这些反应与营养不良、恶液质密切相关。
表4-1-4 放、化疗的急性及后期毒副作用

续表

注:ANC,absolute neutrophil count,中性粒细胞绝对值;G-CSF,granulocyte colony-stimulating factor,中性粒细胞集落刺激因子;RTOG,Radiation Therapy Oncology Group放射治疗肿瘤学组;国际单位制转换:肌酐单位转化成摩尔每升,需乘以88.4
手术作为一种创伤,多方面影响营养状况。一方面,术前的焦虑、烦躁、恐惧、禁食可能导致营养摄入不足;另一方面,术中机械性创伤、术后感染、炎症反应可能导致大量炎症介质的分泌,激发机体一系列代谢变化,进而造成营养素的消化、吸收障碍;第三方面,手术后创伤修复营养物质需求增加、手术后营养补充不足,都可能导致能量赤字,从而引起营养不良;第四方面,手术切除的器官或组织本身也会造成消化吸收功能的障碍,表4-1-5归纳了手术切除器官或组织对消化吸收功能的影响。
表4-1-5 喉部及消化器官切除术后常见的对营养的不利影响

