精子活力
活力分级
WHO手册第五版将精子活力分为3级:
- 前向运动(PR):精子主动地呈直线或沿一大圆周运动,不管其速度如何。
- 非前向运动(NP):所有其他非前向运动的形式,如以小圆周泳动,尾部动力几乎不能驱使头部移动,或者只能观察到尾部摆动。
- 不活动(IM):没有运动。
精子活力评估程序
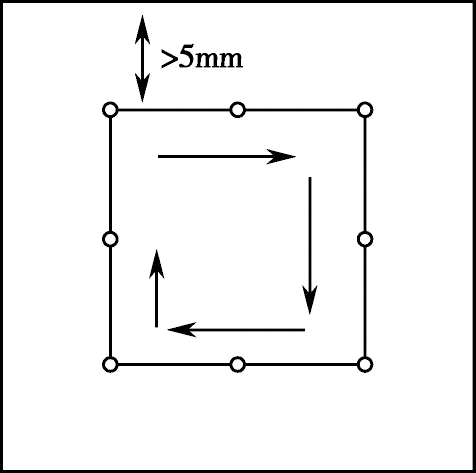
分析视野的选择
- 如果在37℃评估精子活力,应将显微镜载物台、载玻片等预热10min,使温度保持稳定。
- 制备湿片。
- 待湿片内精液样本停止漂移后,尽快在200倍或400倍的相差显微镜下观察分析。
- 应在距离盖玻片边缘至少5mm的区域内,按顺序观察玻片,如图28-4,要随机选择视野(不能根据看见一定数量的活动精子来选择或尽量选择精子活力好的视野)。
- 全视野下评估精子活力对于一些高浓度、高活力的标本有一定难度,使用带有网格的目镜有助于界定评估区域。在此区域中,应随机立即开始评估,不要等精子游入界定的区域才开始。
- 首先快速计数评估区域内的前向运动精子,再分别计数该区域的非前向运动精子和不活动的精子。根据经验,可以一次计数3类精子的运动,并且可以观察更大的评估区域。
- 借助实验室计数器,记录三种活力级别的精子数目。
- 为获得一个可接受的低取样误差,在总共至少5个视野中,每份重复样本至少评估200个精子(当达到200个精子时不能停止计数,需将本视野内所有级别的精子计数完全)。
- 在重复的湿片中,计算最常见的活力级别(PR、NP或IM)的两个百分率之间的平均百分率和差异。
- 根据表28-3确定差异的可接受性(每个值显示两次百分率之间的最大差异,此差异为预期在95%样本中仅由取样误差造成的)。
- 如果差异在可接受范围内,以最接近的整数(习惯是调整0.5%至最接近的偶数)报告每类活力级别的平均百分率。如果差异太大,则制备两个新的湿片并重新计数。
从重复计数200个精子(总共计数400个精子)确定所给出平均值的两个百分率之间的可接受差异

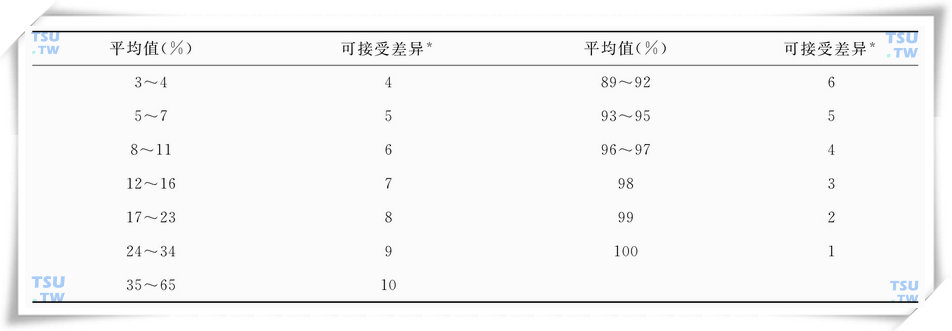
*基于四舍五入取整数的95%可信区间
与评估精子浓度一致,仅评估完整精子的活力。在整个评估过程中,始终要做到两次混匀、两次取样及两次计数。计数同一湿片两次,或者使用同一混匀样本同时制备两张湿片都不是真正的重复检测。有可能在第二次重新计数后,其差异仍超出可接受范围,这时需要进行第三次重新计数。罕见情况下,因为样本的不均一性,致使第3批重复样本也不能提供可接受的差异,在这种情况下,需要取所有重复值的平均值,并将其记录在报告中。
精子存活率
精子存活率的检查一般采用伊红、伊红-苯胺黑等染料对精子进行染色,根据精子是否着色判断精子的死活。一般精子死亡后,细胞膜的通透性改变,易于着色。在必须避免精子染色时,也可采用低渗膨胀试验(HOS)来评估精子存活率。这些检查间接反映了精子质膜结构的完整性。可以常规检测所有标本的存活率,但对于前向运动精子少于40%的精液标本特别重要。
单用伊红法
- 试剂配制:将0.5g伊红Y(C.I.45380)溶于100ml 0.9%NaCl中。
- 充分混匀标本后,取5μl精液和5μl伊红溶液置于载玻片上,用移液器吸头混合、搅拌玻片上的样本,覆盖22mm×22mm盖玻片后静置30s。
- 再次混匀精液标本,制备第二张玻片。
- 使用负相差显微镜在200倍或400倍下计数每张玻片上染色精子和非染色精子的数目。每份重复样本评估至少200个精子。
- 计算重复玻片的两次活精子百分率的平均值和差异,根据表28-3确定差异的可接受性(每个值显示两次百分率之间的最大差异,此差异为预期在95%样本中仅由取样误差造成的)。
- 如果差异在可接受范围内,以最接近的整数报告活精子的平均百分率。如果差异太大,则重新制备两张新鲜玻片并再次评估。
评定标准:活精子头部呈白色和淡粉红色,死精子头部呈红色和暗红色。如果染色只限于颈部区域,头部的其余区域未染色,这些精子应被评估为活精子。
伊红-苯胺黑法
- 试剂配制:将0.67g伊红Y(C.I.45380)和0.9g NaCl溶于100ml纯水中,稍微加热,再将10g苯胺黑(C.I.50420)加入到100ml伊红Y溶液中,煮沸后冷却至室温,滤纸(如90g/m2)过滤后储存在暗色密封玻璃瓶中。
- 取50μl精液,与等体积的伊红-苯胺黑悬液混匀后等待30s,取5~10μl制成涂片(详见精子形态涂片),同法制备第二张涂片。
- 干燥后可立即用亮视野显微镜在1000倍油镜下检查,也可封片后检查。
- 计数每张玻片上染色精子和非染色精子的数目。每份重复样本评估至少200个精子。
- 计算重复玻片的两次活精子百分率的平均值和差异,根据表28-3确定差异的可接受性(每个值显示两次百分率之间的最大差异,此差异为预期在95%样本中仅由取样误差造成的)。
- 如果差异在可接受范围内,以最接近的整数报告活精子的平均百分率。如果差异太大,则重新制备两张新鲜玻片并再次评估。
伊红-苯胺黑法评估死精子和活精子的标准与伊红法相同。由于苯胺黑形成的黑色背景,淡染的精子更容易分辨,另外封片后的涂片能保存较长时间,可作为质量控制片使用。
低渗膨胀试验
- 试剂配制:0.735g枸橼酸钠和1.351g D-果糖溶于100ml纯水配制成膨胀液,将溶液以1ml分装后冻存于-20℃。如果用于治疗用途,可将1份溶液加1份灭菌纯水,即1∶2的比例稀释。
- 使用前解冻膨胀液并充分混匀,取1ml置于一支加盖的微量离心管中,37℃温热5min。
- 充分混匀精液标本后取100μl精液加入膨胀液中,混匀。在37℃孵育30min后,取10μl加到载玻片上,覆盖22mm×22mm盖玻片。
- 按上述步骤制备另一张重复玻片。
- 使用相差显微镜在200倍或400倍视野下检查每张玻片,计数未膨胀(死的)和膨胀(活的)精子,如下图。每份重复样本评估至少200个精子。
- 计算重复玻片的两次活精子百分率的平均值和差异,根据上表确定差异的可接受性(每个值显示两次百分率之间的最大差异,此差异为预期在95%样本中仅由取样误差造成的)。
- 如果差异在可接受范围内,以最接近的整数报告活精子的平均百分率。如果差异太大,则重新制备两张新鲜玻片并再次评估。
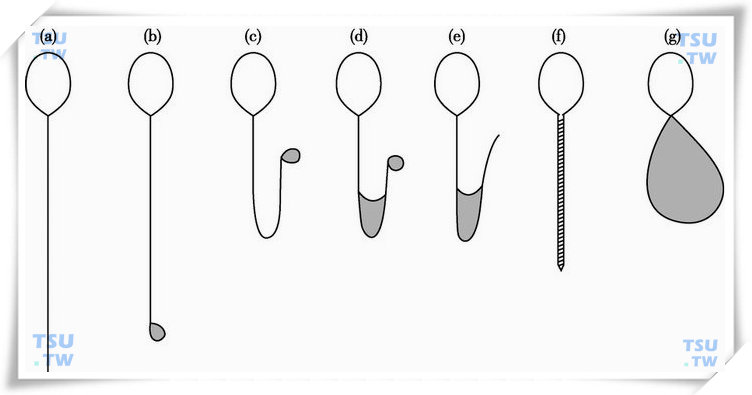
人精子在低渗透压作用下的特征性形态变化的示意图
(a)未发生改变;(b)~(g)尾部变化的不同类型。灰色区域表示尾部膨胀
