基本原理
放射免疫测定法检测内分泌激素是根据抗原与其相应抗体特异性结合形成抗原-抗体复合物的特性,用定量的放射性同位素标记的抗原和变量的非放射性抗原共同竞争限量的抗体。该反应可用公式表示为:Ag+Ab AgAb。该反应是可逆的,当反应达到平衡后,平衡常数
AgAb。该反应是可逆的,当反应达到平衡后,平衡常数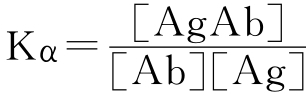 。因为抗体是定量的,所以结合抗原的总量也是固定的;又因Ag与Ag*具有相同的与Ab相结合的特性和结合力,所以结合标记抗原量(AgAb*)与非标记抗原量(AgAb)成反比。在试验中,作为试剂的抗原,当抗体及标记抗原的量一定时,加入一系列已知浓度的非标记抗原(标准品)后,可以得到一条剂量反应曲线(或标准曲线)。从质量作用定律可以看到,标准品浓度越高,结合标记抗原的计数就越低。这条曲线可用不同的数学处理方法画出:如B/B0对Log剂量做图、Logit对Log剂量作图等。一个样品,如果已知结合标记抗原的记数,则样品的浓度(非标记抗原的量)就可在标准曲线上用内查法查出或由直线方程计算出。
。因为抗体是定量的,所以结合抗原的总量也是固定的;又因Ag与Ag*具有相同的与Ab相结合的特性和结合力,所以结合标记抗原量(AgAb*)与非标记抗原量(AgAb)成反比。在试验中,作为试剂的抗原,当抗体及标记抗原的量一定时,加入一系列已知浓度的非标记抗原(标准品)后,可以得到一条剂量反应曲线(或标准曲线)。从质量作用定律可以看到,标准品浓度越高,结合标记抗原的计数就越低。这条曲线可用不同的数学处理方法画出:如B/B0对Log剂量做图、Logit对Log剂量作图等。一个样品,如果已知结合标记抗原的记数,则样品的浓度(非标记抗原的量)就可在标准曲线上用内查法查出或由直线方程计算出。
基本试剂
RIA的基本试剂有4种,即抗体、放射性同位素标记抗原、非标记抗原(一系列已知浓度的标准品)和分离剂。目前,大多数内分泌激素都有了相应的放免检测试剂盒,所以一般实验室无须进行抗体的制备、提纯、抗原浓度的控制以及抗原的标记。这里只简单地介绍一下其制备的基本原理。
抗体
多数蛋白激素是完全抗原,既有抗原性又有免疫原性,用它们免疫动物可以得到相应的高效价、高特异性的抗体。由于四种糖蛋白激素(FSH、LH、TSH、hCG)是由共同的α亚基和各自不同的β亚基组成的,只有用它们的β亚基作免疫原才能获得高特异性的抗体。甾体激素如睾酮、双氢睾酮(DHT)、雌酮、雌二醇等为半抗原,只有抗原性而无免疫原性,只能同大分子蛋白联结,如与人血清白蛋白、牛血清白蛋白和丙种球蛋白联结后才可引起抗体的产生。将制好的免疫原同其佐剂制成乳剂免疫豚鼠、兔、羊、驴等动物,8~10d动物体内出现抗体,3~6个月可得到高滴度的抗体。
放射性同位素标记抗原
常用同位素为125I和3 H,125I常用于标记蛋白激素。甾体激素测定多采用3 H标记,目前也有125I标记的。其原因是测定β-射线比测定γ-射线花费要大得多,一般实验室都有γ-计数器,但没有β-计数器。所以目前有125I标记取代3 H标记的趋势。但是碘标记除了使用期短(一般1个月左右)且γ射线比β射线强度大得多,易把大分子打成碎片,而且碘标记物中125I易脱落,需要经常纯化等缺点外,对于甾体激素来讲,一个125I原子体积相当于一个甾核的体积,125I原子易对甾体激素免疫部位起屏蔽效应,阻碍免疫反应正常进行,对测定有一定影响。对于多肽激素来讲,由于其分子体积比碘原子大得多,故不会有什么影响。国内所产放免试剂盒中对标记抗原所用的同位素及其放射比度都有说明。
标准品
每一试剂盒中都有6~8瓶已知浓度的所测激素,其浓度从零开始逐渐增大,其中浓度为零者称零标准品。标准品的作用是用于得出标准曲线。标准品必须高纯度,符合国际参考标准。
分离剂
RIA测定的是结合了放射性同位素标记抗原的抗原抗体复合物,所以必须将反应中游离的部分分离。常用的分离方法有吸附法和二抗法两种。一般RIA试剂盒用二抗体法进行分离,即在RIA系统中加入过量的第二抗体,形成抗原•一抗•二抗(Ag•Ag1•Ag2)沉淀复合物,经离心、弃上清液而除去游离部分。吸附法多采用葡聚糖包裹的活性炭,葡聚糖分子具有网络结构,网络的孔径只允许小分子如游离的甾体分子穿过被活性炭吸附,而与抗体结合的大分子不能穿过,也不能被活性炭吸附,由于 Ag+Ab  AgAb是可逆反应,当左边的Ag被活性炭吸附后,为了达到新的平衡,AgAb复合物会分解成Ag和Ab。因此采用活性炭吸附时,必须操作迅速,尽量缩小前后的差距,而且要严格控制时间,若时间过长,最后可能导致整批测定管都是NSB。
AgAb是可逆反应,当左边的Ag被活性炭吸附后,为了达到新的平衡,AgAb复合物会分解成Ag和Ab。因此采用活性炭吸附时,必须操作迅速,尽量缩小前后的差距,而且要严格控制时间,若时间过长,最后可能导致整批测定管都是NSB。
目前虽然有各种检测试剂盒,但质量有时有问题,如何判断是试剂盒质量问题,还是自己操作问题,可以根据实验资料判断。诸如标准抗原效价降低,抗体效价降低,示踪物不纯等,自己的操作问题可以根据质控标本数据、ABCV、RER等判断。
同样的试剂盒根据不同的目的可以灵活的应用。譬如,孕妇的孕酮、雌二醇、雌三醇是正常妇女的几十至几百倍,而且变化特别大,用测定正常人的试剂盒测定孕妇的激素水平,只要在标准Ag和Ab用量不变的情况下加大标记Ag*的用量即可。
