一般认为,成熟精子作为高度分化的、丧失转录活性的单倍体细胞,雄性生殖细胞核转录停止于精子形成的中期。在精子形成的早期,在减数分裂的前后,一些与精子形成及精子结构、功能相关基因的mRNA即被转录,这些蛋白有序而适当地表达主要通过转录后调控机制。与翻译不同步而早期转录的mRNA需要较好的稳定性,并保持其翻译活性。
精子的上述特点使人们易于接受精子中不存在mRNA的观点,但是,在经历了五十多年的激烈争论后,对精子中存在细胞核基因组的mRNA已基本被承认。证实mRNA存在于哺乳动物成熟精子中的意见始于20世纪80、90年代:1989年,Pessot等用原位杂交及凝胶电泳技术检测了人和大鼠精子中RNA的存在;1993年,Kumar等用RT-PCR及原位杂交等方法证实了人精子中存在c-MYC的mRNA,定位于精子中段和尾部;1994年,Miller等的研究表明,在人精子中含有多种mRNA,包括HSP70、HSP90、β-ACTIN等。继这些早期的报道之后,涌现很多关于人精子中存在一些基因的mRNA的报道。
伴随精子中RNA被发现过程的是对精子中是否存在RNA的质疑与争论,引起人们质疑的焦点主要集中于两个方面:首先,从理论上讲,精子是高度特化的单倍体细胞,其唯一的使命是通过授精将遗传物质传递给受精卵。为了在运送遗传物质的过程中保持遗传物质的完整性,精子细胞核被浓缩和致密化,一般认为细胞核的转录活动已经停止,所以,精子中不会有mRNA。精子也不再需要mRNA,因为精子的任务是传递基因组DNA,而非mRNA,mRNA如果不能被翻译,其存在对精子将毫无意义。在这一方面,支持精子中存在mRNA的研究者们认为,虽然目前还不能肯定精子中mRNA的来源,但很可能是精子发生过程中的残余物,精子中mRNA的存在并不一定依赖于精子细胞核基因组被转录,精子发生过程中,尤其是减数分裂后,mRNA的稳定性比一般体细胞强。而对于精子mRNA的意义或使命,目前虽然也不能肯定,但已经有多方面的研究提示,精子中的mRNA并不仅仅是“残留物”,可能有着目前尚不为人知的功能。
争论的另一方面是对于精子中mRNA的检测,有些实验得出阴性的结果,认为精子中不存在mRNA,而阳性结果可能是假阳性或是由于睾丸生精细胞/精子胞质残余体的污染。引起这方面争论的主要原因是由于精子中RNA含量很低(不到一般体细胞的十分之一)的缘故,一些实验方法,如普通琼脂糖凝胶电泳,可能会得出阴性结果;另一个原因是人射出的精液含有睾丸生精细胞、体细胞及胞质残余体,如果不加以纯化,一起被用于提取RNA,且用比较灵敏的检测方法,如RT-PCR,所得出的阳性结果就不具备说服力。所以,近期对于精子中mRNA的研究都注意到这些问题,一般采用的控制措施是:对人射出的精子进行纯化,并用含0.5%Triton X-100和0.1%SDS的水溶液处理精子,去除胞质残余体;扩增体细胞和睾丸生精细胞的标记基因mRNA,确保纯化后精子的RNA没有被体细胞和/或睾丸生精细胞污染。
精子中mRNA被发现并被确认后,研究者们开始考虑将其作为男性不育的筛查和检测靶点,主要基于以下原因:①虽然对于成熟精子中这些mRNA的来源及其意义还有争论,但一般认为成熟精子中mRNA是精子发生过程中的“残余物”,检测其水平能反映睾丸精子发生过程中的表达事件,是睾丸穿刺的理想替代物;②精子中mRNA与精子的质量有关。研究表明,一些与精子活力有关的蛋白mRNA在人成熟精子中的水平与精子活力相关。
精子中mRNA可能还有其他的应用前景,如法医学方面,Bauer等的研究认为,一些特异性表达于精子中的基因,如Protamine-1和Protamine-2,其mRNA存在于射出精子中,就被认为可以用来作为性犯罪中精斑的确认。
精子中RNA有其特殊性,如RNA主要存在于致密的细胞核中和核周围,RNA含量少,还要避免精液中其他细胞的污染等。提取RNA前,联用Percoll纯化和体细胞裂解液去除精浆和其他细胞,使用能完全裂解精子核的RNA提取试剂提取精子RNA,用于RT-PCR及其他分析。
试剂与器材
1.仪器:显微镜、离心机、恒温水浴箱、微量核酸测定仪、PCR仪。
2.主要试剂:
Percoll、生理盐水、RNeasy Kit、RNase-free水、乙醇、DNA酶I、RNA酶抑制剂、逆转录及PCR试剂。
体细胞裂解液的配制:0.1%SD,0.5%Triton X-100,用RNase-free的水配制,4℃保存。
实验内容与方法
一、精液标本的收集及处理
精液标本液化后,用Percoll(取80%和40%两个浓度)纯化精子。收集80%层底部精子,加入0.5ml体细胞裂解液,吹打分散沉淀并转移至10ml塑料试管中,加入5ml体细胞裂解液,吹打混匀,置冰浴中15min,间断吹打,显微镜下确认无圆形细胞,并计数精子浓度。
二、人精子RNA的提取
根据精子浓度取含1~5×107精子的悬液,室温12 000g离心2min,弃上清液,精子沉淀用RNeasy Kit提取RNA。RNA提取的主要步骤为:精子沉淀加600μl RLT缓冲液(可完全裂解5×107个精子),反复吹打30s;反复通过20G一次性注射器针头10次剪切DNA;加入等体积70%乙醇,吹打混匀后加至吸附柱上,室温8000g离心15s;加700μl Buffer RW1至吸附柱上,室温8000g离心15s;加500μl Buffer RPE至吸附柱上,室温8000g离心15s;加500μl Buffer RPE至吸附柱上,室温12 000g离心2min;加30μl水(RNase-free,用前预热至70℃)至吸附柱的膜上,室温12 000g离心1min,收集管中洗脱所得即为细胞总RNA。取20μl RNA,用微量核酸测定仪测定其含量和纯度。剩余RNA加入10IU RNA酶抑制剂,置-70℃保存。
三、DNA酶处理及逆转录
总RNA在用于逆转录前用DNA酶I处理,取8μl总RNA,加2IU DNA酶I,37℃处理30min,加入1μl EDTA(25mmol/L)终止反应,并于65℃保温10min灭活DNA酶I。置冰上,加1μg Olig(dT)18,5μl 5×逆转录Buffer(含Mg2+),2.5μl dNTPs(10mmol/L),20IU RNA酶抑制剂和100IU MMLV逆转录酶,加RNase-free水至25μl。42℃逆转录1h后,95℃5min灭活RNA酶。逆转录所得cDNA作为模板用于以下PCR扩增。
四、PCR
为确认所提取RNA的质量,采用PCR扩增以下指标:首先,扩增睾丸特异性表达基因,如CatSper2、Protamine-2等,和广泛表达基因β-Actin,证实所提取RNA能用于PCR检测精子基因mRNA的水平;其次,扩增c-Kit、CD4、E-Cadherin,分别排除生精细胞、白细胞和上皮细胞的污染;同时,为确认RNA经DNA酶I处理的效果,可以将Protamine-2的两条引物设计于其内含子的两端,通过检测其扩增产物判定是否有残存基因组DNA污染:本文提供的引物在扩增时,RNA经逆转录—PCR扩增产物为104bp,而以基因组DNA为模板扩增产物为266bp。表37-1的引物可供参考。
PCR体系为25μl,在冰上混合以下组分:10mmol/L Tris-HCl(pH 8.3),50mmol/L KCl,2mmol/L MgCl2,200μmol/L dNTPs,1.5IU Taq DNA聚合酶,0.4μmol/L引物,1μl cDNA。PCR程序为:94℃5min(预变性)后进入循环(35个):94℃变性30s;退火30s(退火温度见表37-1);72℃延伸30s。产物经1.5%琼脂糖凝胶电泳鉴定。
参考PCR引物
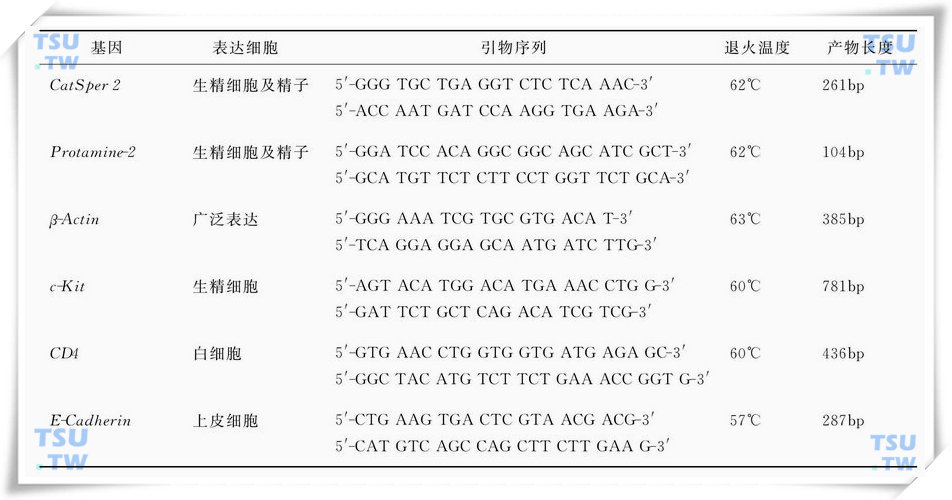
五、结果判定
如果扩增睾丸特异性表达基因(CatSper2、Protamine-2)和广泛表达基因β-Actin,均获得成功,证实所提取RNA能用于PCR检测精子基因mRNA的水平。而且,如果扩增c-Kit、CD4、E-Cadherin未见目的条带,则可以排除RNA有生精细胞、白细胞或上皮细胞的污染。如果所有精液标本RNA经DNA酶I处理后,Protamine-2扩增产物为104bp,未见266bp片段出现,则表明无残存基因组DNA污染。
