不管患者是否有糖尿病史,严格控制应激性高血糖能改善危重患者的预后,血糖水平控制在6. 1mmol/L以下能明显降低外科危重患者并发症如感染、多发性神经肌肉病、胆汁淤积、多脏器功能衰竭等的发生率,减少输血量,缩短重症监护时间,降低病死率。因此,应激性高血糖的防治已经成为目前临床上日益关注的课题。
控制原发病
应激性高血糖的处理首先要控制原发疾病如创伤、感染、心肺功能不全等。原发疾病的控制能减轻机体的应激程度,减少应激激素如儿茶酚胺、胰高糖素、皮质醇的释放,从而降低血糖水平。对于感染病灶的清除可减少前列腺素、白三烯、TNF-α、IL-6等的释放,也有助于降低血糖。疼痛也可引起一系列应激激素的释放,并可以引起胰岛素抵抗,良好的镇痛可减低应激程度和胰岛素抵抗,提高葡萄糖的利用率,有利于降低创伤后血糖水平。
正确的营养支持
高血糖是营养支持的主要障碍,因为高血糖本身可引起IR和β细胞功能损害。另一方面,肠外营养(PN)又是高血糖的一个危险因素。有研究发现,在一组按照125. 4kJ/(kg·d)[ 30kcal/(kg·d)]提供能量,葡萄糖输注速度>5mg/(kg·min)的PN患者中,有50%患者血糖值>11. 1mmol/L。基于近年来提出的“允许性低能量负荷”的概念,认为对于危重患者特别在其炎症反应期,相对减少补充的营养底物和热量有助于避免应激性高血糖和减少相关的并发症,改善患者预后。在一组非创伤危重患者的研究中,应用PN提供至少4184kJ/d(1000kcal/d)的能量和1g/(kg·d)的蛋白质,但不超过静息能量消耗和1. 5g/(kg·d)的蛋白质,结果未发生明显营养不良,且血糖升高亦不显著;若PN蛋白质供应量充分[>1. 2~1. 5g/(kg·d)],则低能量营养不会导致氮平衡的破坏。
实际上,对于严重应激状态下危重患者,其营养支持目标不是追求过高的能量和氮平衡,而是提供适当的能量和蛋白质以维持现有的机体细胞总体,尽量减少机体蛋白质的丢失。在创伤等应激后初期,有肠内营养禁忌时,推荐葡萄糖和脂肪乳剂同时输入的“全合一”TPN营养支持,这样更符合生理状态下的能量摄入方式,且可避免葡萄糖液的过快输注。以单纯补充液体、电解质及100~200g葡萄糖为佳,葡萄糖输注速度应<4mg/(kg·min),非蛋白能量摄入量83. 6kJ/(kg·d)[ 20kcal/(kg· d)],其中50%的能量由脂肪乳剂提供,然后逐渐增加至104. 5kJ/(kg·d)[ 25kcal/(kg·d)]。同时应用胰岛素并根据血糖监测相应调节胰岛素用量,使血糖维持在正常或接近正常水平,这样将有助于改善患者预后。
血糖监测
客观、准确地监测血糖,真实地反映高血糖的程度及持续时间非常重要。通常血糖监测指标有:入院时血糖、早晨空腹血糖、最高血糖、平均血糖或“七点”血糖等。研究发现,患者在ICU期间平均血糖水平是常用的监测指标,其与病死率明显相关。Vogelzang等研究发现高血糖指数(hyperglycaemic index,HGI)能更好地反映危重患者的血糖水平及其与预后的关系。其计算方法为:以时间为横轴,血糖浓度为纵轴,将所测各点血糖连线与正常血糖上限相交,计算上限以上相交面积,除以时间即得HGI。在ICU中,可通过精确调节胰岛素用量来控制血糖水平。
胰岛素强化治疗
Van den Berghe等对1548例、其中60%以上为心脏手术后患者的研究奠定了对应激性高血糖研究的基础。该研究患者始入ICU时75%患者的空腹血糖水平>6. 1mmol/L,12%的患者随机血糖>11. 1mmol/L;被随机分为胰岛素强化疗法组或常规疗法组,4小时检测1次血糖,当两组患者的血糖分别高于6. 1mmol/L、12mmol/L时,即依据预定方案输注胰岛素,血糖控制目标分别为4. 4~6. 1mmol/L、10~11. 1mmol/ L。结果显示,加强及常规疗法组中滞留ICU超过5天的患者的死亡率分别为10. 6%、20. 2%;强化疗法使与脓毒症相关的器官功能障碍患者的死亡率显著降低,也使败血症、急性肾衰分别降低46%、41%,表明严格血糖控制对降低感染相关并发症及死亡率的意义非常显著。Cheung等对240例有糖尿病或无糖尿病病史但入院时血糖>7. 8mmol/L的急性心肌梗死患者的研究表明,胰岛素加强疗法组于24小时内保持血糖在10mmol/L以下,与仅施以常规血糖控制的对照组相比,其心力衰竭及再梗死发生率降低。Patel等综合心肌梗死、卒中、心脏手术及其他ICU患者的前瞻性研究资料的分析表明,胰岛素疗法可使患者总体死亡率降低15%。这些研究结果表明,高血糖可显著影响患者预后,而患者多可从胰岛素治疗中获益。
然而,是血糖浓度降低还是胰岛素的治疗性显著影响患者预后仍未有定论。文献报道胰岛素具显著抗炎作用,可降低C-反应蛋白、血浆纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor type-1,PAI-1)水平,降低TNF-α、IL-6、NF-кB浓度,降低细胞间黏附分子数量及促进抗炎因子IL-4、IL-10合成等。胰岛素亦可降低血栓烷A2产生,快速调节血管舒缩、心肌收缩力,抑制心肌细胞凋亡。有报道胰岛素可降低高血糖诱导的氧化应激水平并可抗血栓形成,保护危重患者外周及中枢神经系统,降低危重患者多发性神经肌肉疾病发生、降低脑损伤患者颅内压及远期康复等。此外,胰岛素可促肌肉蛋白质合成,其对呼吸肌的直接作用及防止多发性神经肌肉疾病发生的作用,可减少患者机械通气维持天数。胰岛素也可抑制脂肪分解及糖异生关键酶——磷酸烯醇式丙酮酸羧基酶促进糖原合成。亦有研究显示,胰岛素提高血浆高密度及低密度脂蛋白水平,降低甘油三酯水平,部分逆转血浆脂质成分异常,调节外周组织葡萄糖摄取使血糖趋于正常,可能改善危重患者预后。有学者认为可能是以胰岛素水平提高为主、血糖降低为辅或二者协同作用对免疫、血流动力、代谢功能产生有益影响。
危重患者血糖超过何种水平就应该进行给予胰岛素的治疗目前尚无一致的标准,Van den Berghe等的研究提示血糖一旦超过正常水平就应给予胰岛素治疗,下表显示了Van Den Berghe的胰岛素强化治疗方案。近年来,随着控制正常血糖的益处被越来越多的研究所证实,胰岛素强化治疗已被临床广泛采用。目前认为,创伤早期应激反应较强时,如果血糖连续两次高于11. 1mmol/L,或血糖波动较大,可选择胰岛素持续静脉滴注。与皮下注射胰岛素相比,胰岛素持续静脉滴注能显著降低接受冠状动脉旁路移植术糖尿病患者的病死率及并发症发生率。静脉输入胰岛素的初始剂量与患者的病情和血糖水平有关,一般情况下,应<0. 1U/ (kg·h),很少需要超过4~6u/h,待血糖达到理想水平时,多数患者胰岛素的维持用量为1~2U/ h。在使用胰岛素降糖治疗过程中,若静脉输入含葡萄糖的溶液,可按3~6g糖加1u胰岛素以控制血糖。血糖降低过程要平稳,不能太快,也不能降得太低,要尽量减少低血糖的发生。随着机体逐渐恢复,创伤应激逐渐减小,血糖也逐渐易于控制,此时可根据血糖水平改为皮下注射胰岛素,如果患者有糖尿病病史,此时也可加用口服降糖药。在一项多变量回归分析研究中发现,每天胰岛素用量和血糖水平都是危重患者病死率的独立正性预测因子,即每天胰岛素用量越高、血糖水平越高,病死率就越高,因为胰岛素用量越多提示胰岛素抵抗程度越重,意味着预后越差。
van den Berghe胰岛素强化治疗方案
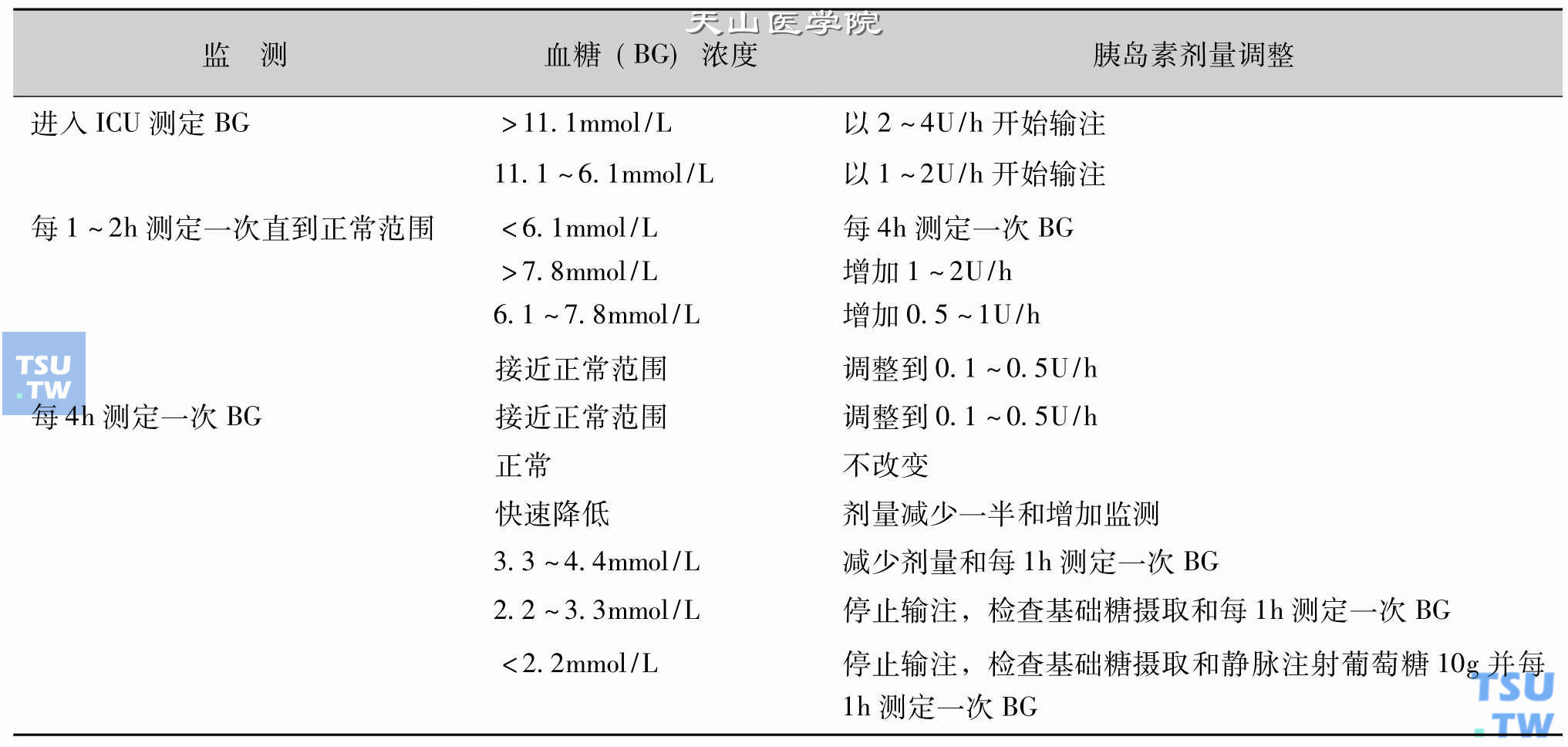
困难的是到底血糖控制在何值是理想水平。以2001年Van den Berghe等对于应激性高血糖的研究结果为主要依据,2004年在美国内分泌学会(American College of Endocrinology,ACE)等多组织参与的会议上,ACE提议关于院内患者的血糖控制目标:ICU患者应低于6. 1mmol/L,普通患者餐前血糖要低于6. 1mmol/L,餐后血糖峰值不超过10mmol/L。由于以往仅有少量的随机研究验证了胰岛素在不同种类疾病患者中应用的可行性、安全性;少数研究评测了不同血糖水平对于预后的实际意义,因此有学者认为ACE的提议不成熟也过于严格,Van den Berghe等的研究对象主要是危重心脏手术患者,其他患者是否也能从严格控制血糖中显著受益或者控制血糖于较高的水平(如7. 2~7. 8mmol/L以下)是否也可产生相似作用尚不清楚,而且非危重患者血糖控制目标仍未有可参考的临床数据。因有关胰岛素强化治疗的前瞻性研究资料尚有限,Inzucchi等认为在对住院患者设定严格的血糖控制目标之前,应有设计良好的临床实验,以准确评估其意义及危险性;美国糖尿病协会建议餐前血糖水平应保持在5. 0~7. 2mmol/L,在缺乏一致数据前可维持于5. 0~8. 3mmol/L;对于普通内外科患者,应避免持续血糖超过11. 1mmol/L。关于ICU患者,目前更倾向于控制血糖于7. 8mmol/L以下并力图接近正常范围,同时避免血糖低于3. 9mmol/L。对于重症脓毒症患者,应于患者内环境稳定后,控制血糖于8. 3mmol/L之下。由内分泌学家、营养学家、护理人员等参与研制的胰岛素输注方案对于实现目标血糖控制水平、防止低血糖发生尤为适用,不提倡单独皮下胰岛素注射疗法。如耶鲁大学内科ICU现用方案血糖控制目标为5. 6~7. 7mmol/L,推荐应用于血糖超过11. 1mmol/L的患者,根据最近两次血糖测量结果的变化及现时胰岛素输注速率调整下一时段用量,血糖控制效果好而低血糖发生率较低。
综上,目前应激性高血糖与患者并发症发生率、死亡率关系的研究仍集中于ICU患者,以心脏手术、心肌梗死、卒中患者为多;此外,也有严重创伤、烧伤、心衰、肾衰及儿科危重患者的研究报道。无论有无糖尿病病史,越来越多的文献支持严格血糖控制对于特定患者群的益处。关于最佳血糖浓度、输注葡萄糖和胰岛素的获益机制尚需进一步的研究数据加以证实。
C肽
如今对C肽生物效应的研究发现其可能与加强胰岛素信号系统功能等有关,C肽也有被应用于治疗创伤应激后高血糖的可能。
促肾上腺皮质激素释放因子
(corticotropin releasing factor,CRF)受体拮抗剂Hager等以行小肠部分切除手术的大鼠作为急性创伤模型,给实验组大鼠一种CRF受体-1拮抗剂,以减轻大鼠受创伤后出现的高血糖症状,实验组大鼠血糖下降与对照组比较差异具有统计学意义,其中机制尚不十分清楚。
脂联素(adiponectin)
脂联素是由脂肪细胞分泌,有治疗价值的激素。Kamon等动物实验发现脂肪细胞激素在肥胖与IR之间具有极其重要的关联,可使小鼠的高血糖和高胰岛素血症症状得以改善;此外,其与瘦素分泌相关,在处理高血糖和糖尿病时可能存在协同作用。
二磷酸果糖
(fructose-1,6-diphosphate FDP)FDP经静脉给药,不透过细胞膜,主要作用于细胞膜,激活磷酸果糖激酶,增加细胞内高能磷酸化合物的含量,促使葡萄糖代谢,为创伤后的组织细胞修复提供能量,提高血中葡萄糖的利用率。FDP还可通过增加红细胞超氧化物歧化酶(SOD)活力,抑制血糖升高。
重视低血糖
危重症患者糖代谢紊乱并非都表现为高血糖,血糖是否升高除取决于病情轻重和应激的强弱外,还与患者营养状况及疾病进程有关。重度营养不良及极度衰竭的临终患者,血糖有时甚至可明显降低。由于缺乏对病情的充分了解和全面掌握,机械地根据血糖水平调整胰岛素用量或未根据输入液体种类及时调整胰岛素泵入速度,血糖监测间隔时间较长从而导致医源性胰岛素摄入过多常是患者发生低血糖的主要原因。另外,在经过一段时间肠外营养治疗后的患者,体内胰岛素分泌会增加,以适应外源性高浓度葡萄糖诱发的血糖变化,此时若突然终止营养液的输入,也极易发生低血糖。治疗中发生低血糖对患者的危害比高血糖更严重。神经性低血糖症状和肾上腺能神经反应是低血糖的两个主要表现。前者初表现为意识错乱等,进而可发展为抽搐,甚至出现局灶性神经功能缺损表现、昏迷乃至死亡。后者是由于低血糖导致儿茶酚胺释放所引起的,其症状和体征包括出汗、心动过速、高血压、心律失常等。但对于昏迷患者或麻醉后尚未苏醒及应用了镇静药物的患者而言,上述症状常常被掩盖而不易及时发现。成人低血糖的早期治疗多选用50%葡萄糖(D50)50ml静脉推注,严重低血糖患者需要追加单次量的D50或以5%~10%葡萄糖静脉维持以防止低血糖复发。
