免疫组化检测方法
1.抗原修复处理
利用经甲醛固定、石蜡包埋的切片进行ER、PR(核内抗原)的免疫组化染色时,染色前的加热处理是一种行之有效的方法。由于加热处理易出现切片损伤、剥离等,故应选用涂有细胞黏着剂的切片。下面具体介绍单纯加热和微波炉加热两种方法。
(1)单纯加热:此法经济适用。切片经脱蜡、水洗后放进耐热容器内,容器内装有柠檬酸液或磷酸缓冲液(PBS),将此容器放入已加热至95~100°C的热水中继续加热15~30分钟(如容器内容改为0.01mol/L的苦味酸缓冲液则须加热60分钟),自然冷却后水洗,加入内源性过氧化物酶阻断及抗原抗体法免疫染色。如使用的是柠檬酸,则用苏木精弱染核2分钟左右即可。如使用的是PBS,则用甲基绿染核10分钟左右即可。另外,经PBS处理的切片比用柠檬酸处理的切片易损伤和剥离,操作时应小心。
(2)微波炉加热:切片放入内盛有0.01mol/L的苦味酸缓冲液(pH 6.0)的耐热容器中,用保鲜膜将其盖封好后放入能自动调控温度在90~100°C的微波炉内,加热30分钟。自然冷却后水洗,加入内源性过氧化物酶阻断及抗原抗体法免疫染色。
2.链霉素-生物素标记法(labeled streptavidin biotin, LSAB)免疫染色操作步骤
操作1 常规脱蜡、水洗、抗原修复处理。
操作2 0.3%过氧化氢及甲醇溶液30分钟,进行内源性过氧化物酶活性的阻断。
配方(20枚切片量):30%过氧化氢 1.5ml
100%甲醇 150ml
操作3 轻轻水洗后冷PBS(0.01mol/L磷酸缓冲生理盐水,pH 7.2)洗3次,每次5分钟。
操作4 特异抗体反应30~60分钟,湿盒内,室温。抗体用1%牛血清白蛋白(BSA)稀释,每张切片用量100~150 μl。
操作5 冷PBS洗,5分钟,3次。
操作6 生物素化二次抗体反应30~60分钟,湿盒内,室温。抗体用1%BSA稀释,每张切片用量100~150 μl。
操作7 冷PBS洗,5分钟,3次。
操作8 辣根过氧化物酶(HRP)标记的链霉素试剂反应30~60分钟,湿盒内,室温。抗体用1%BSA稀释,每张切片用量100~150 μl。
操作9 冷PBS洗,5分钟,3次。
操作10 DAB-过氧化氢反应液(发色)2~10分钟,显微镜观察到足够的茶褐色反应出现且背景清晰时(最好与阳性切片相对照),即可将切片放入冷PBS中以终止发色反应。应注意的是,在显微镜下观察时间过长或者切片在强光暴露时间过长都会造成非特异性反应的出现。
反应液配方(20枚切片量):
DAB(和光纯药,粉末) 30mg
0.05mol/L Tris-HC1缓冲液,pH 7.6 150ml
反应前加入150μl的5%过氧化氢
操作11 轻轻水洗。
操作12 核染色,可用苏木精或甲基绿)染核。
操作13 脱水,透明,封片。
免疫组化检测结果评估
质量控制
首先评估对照片染色结果:①阳性内对照,被检测片内的正常乳腺组织应该有阳性细胞(图19-1);②阳性外对照,经内、外质量控制合格的ER阳性乳腺癌组织(图19-2);③阴性外对照,阳性外对照同一癌组织的连续切片,以PAS代替一抗(图19-3)。对照切片都出现预期结果的同批染色切片可进行免疫组化染色结果评估。
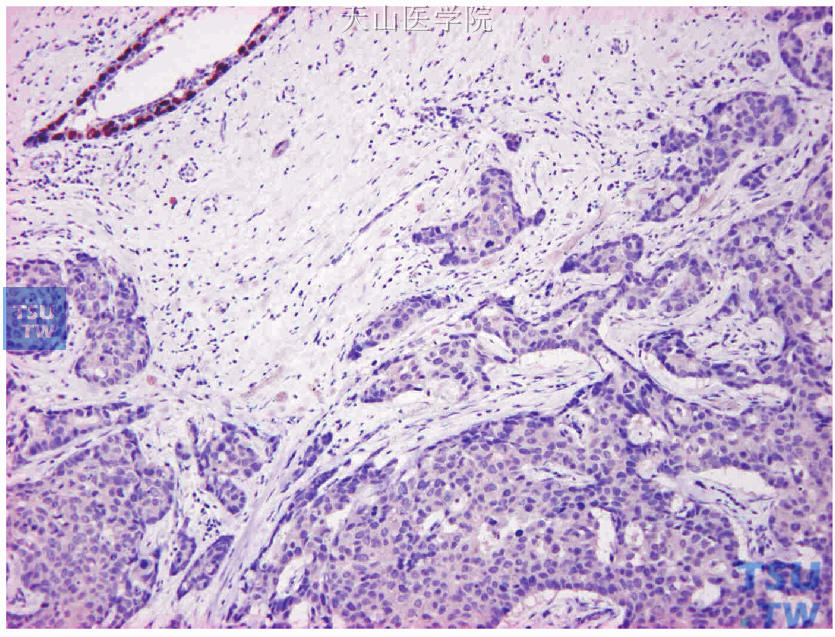
图19-1 被检测肿瘤组织的瘤旁正常乳腺导管作为阳性内对照(左上角的正常乳腺导管腺上皮细胞ER阳性,癌细胞阴性)
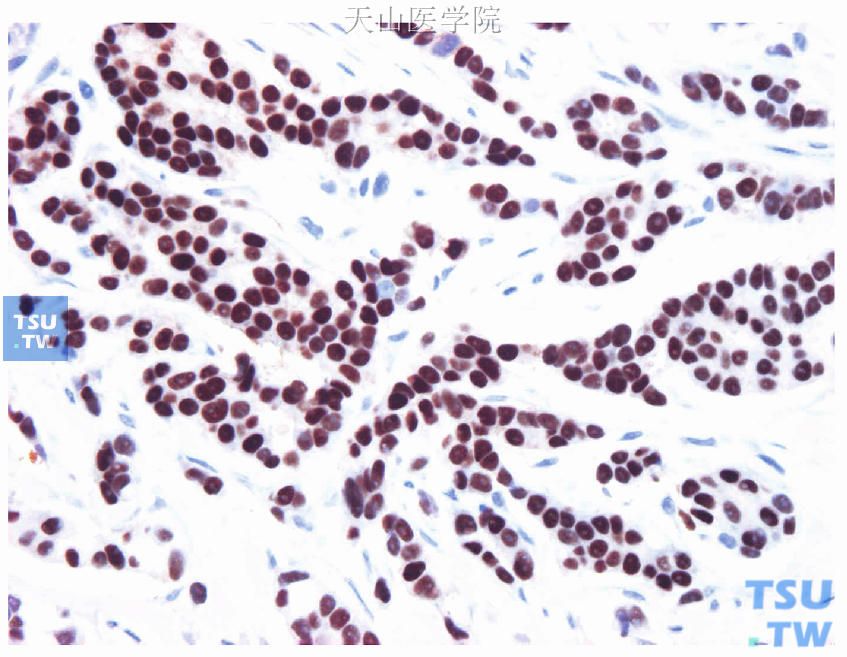
图19-2 符合质量控制的阳性肿瘤组织作为阳性外对照(癌细胞ER阳性)
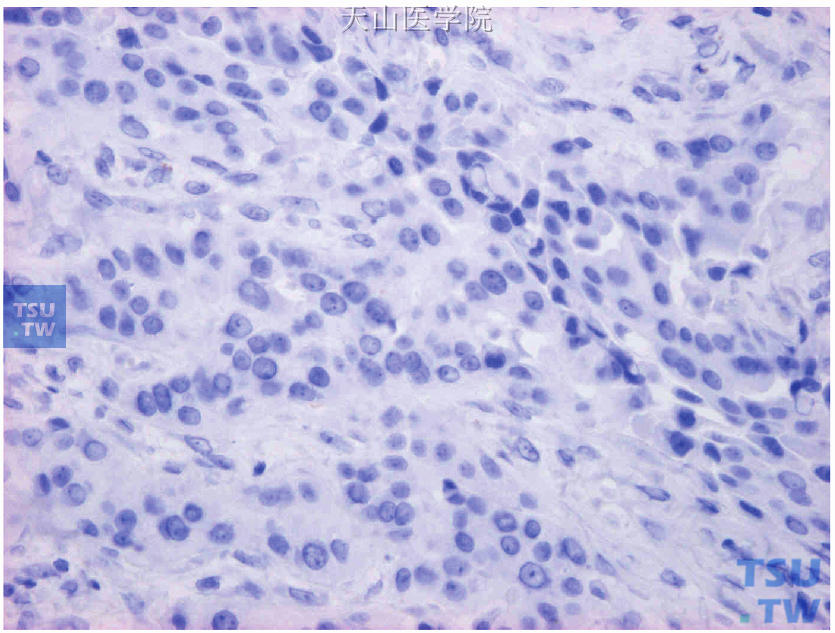
图19-3 符合质量控制的ER肿瘤组织作为阴性外对照(图19-2肿瘤组织的连续切片,以PAS代替ER抗体,结果癌细胞阴性)
结果评估
显微镜下观察,肿瘤细胞核呈棕黄色颗粒着色者为ER/PR阳性细胞。评估阳性肿瘤细胞的百分比和着色强度(图19-4~图19-7)。
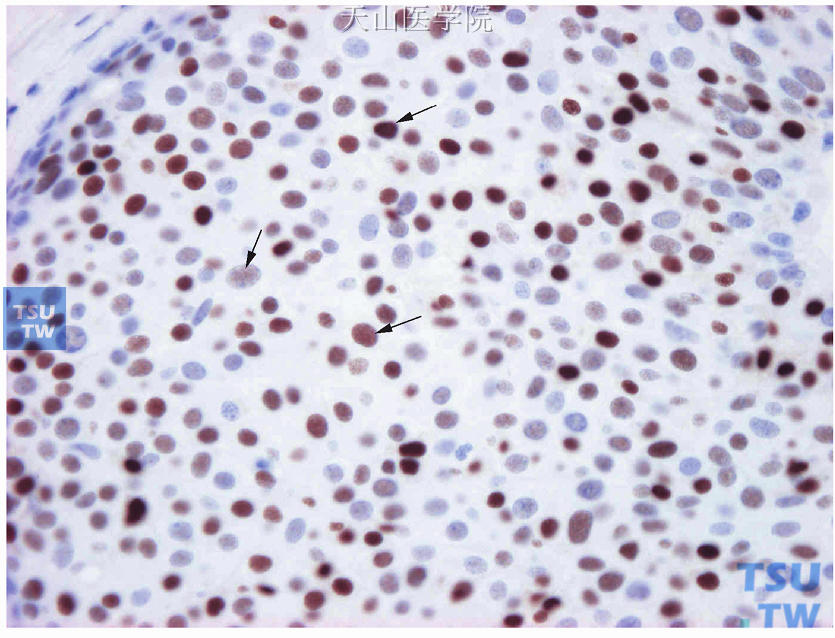
图19-4 ER阳性细胞着色强度(箭头标出强着色、中等着色及弱着色)
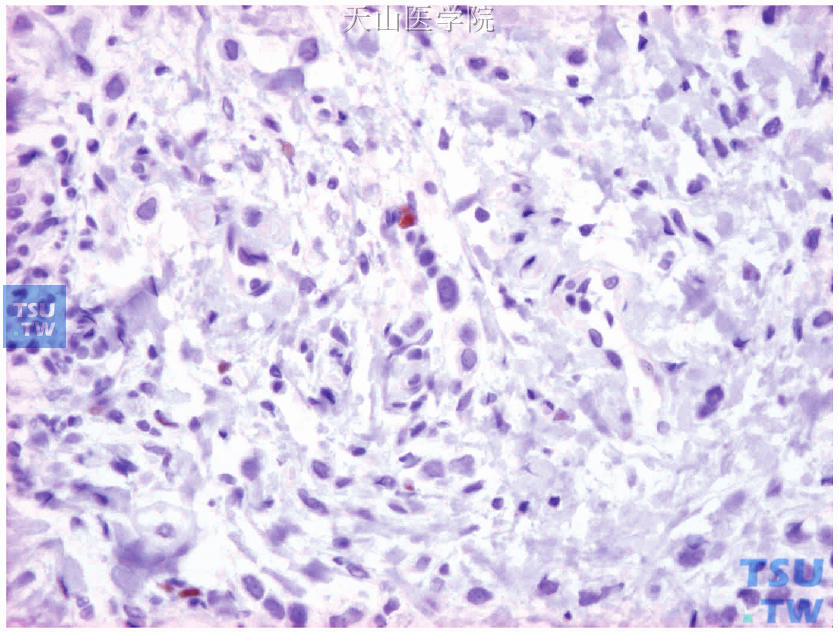
图19-5 ER阳性细胞约占1%,中等着色
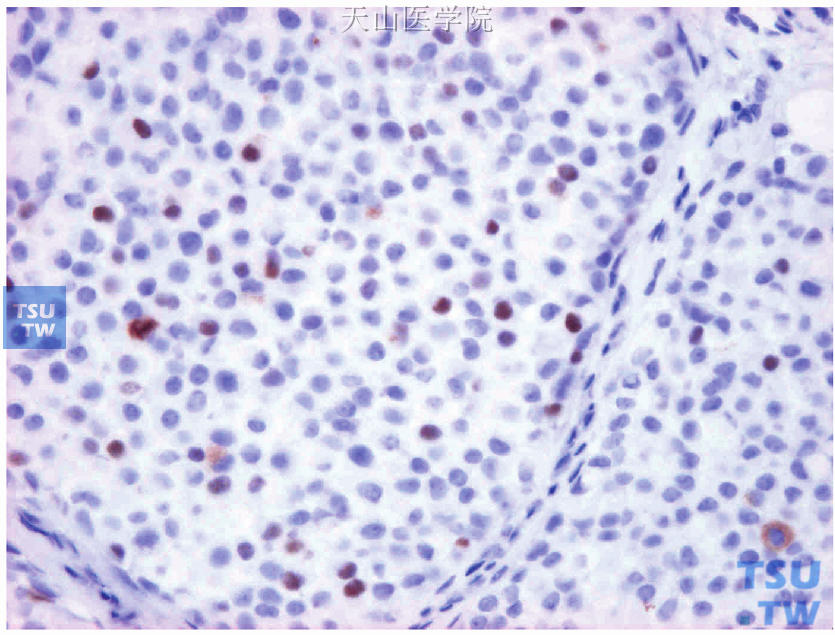
图19-6 ER阳性细胞约占10%,弱-中等着色
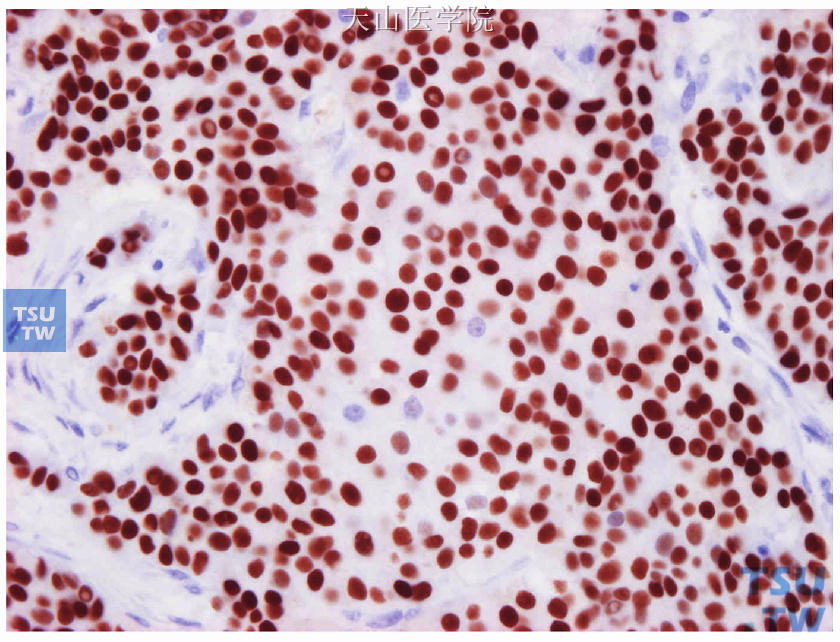
图19-7 ER阳性细胞>90%,强-中等着色
免疫组化检测应注意的问题
选取检测组织
由于乳腺癌具有明显的异质性,选择检测组织时应注意以下几点:①尽量选取肿瘤进展的先端部分,即肿瘤与正常乳腺组织的交界部分。如图19-8所示为癌细胞以实性排列为主的非特殊型浸润性导管癌,癌巢与正常乳腺组织有明显的界限。选择这部分做检测不仅可检测增殖最活跃的肿瘤细胞,同时瘤旁的正常乳腺组织可作为阳性内对照。②尽量选取浸润性癌部分。如图19-9、图19-10所示为癌细胞以腺管形成为主的非特殊型浸润性导管癌,癌巢内由浸润性导管癌和导管内癌混合存在,应多取材制片观察,选择浸润性成分多的部分进行检测和评价。③尽量选择无纤维化、钙化等改变的部分。如图19-11、图19-12所示的非特殊型浸润性导管癌,癌巢中央部分明显纤维化、肿瘤细胞少,应不选这部分进行检测。
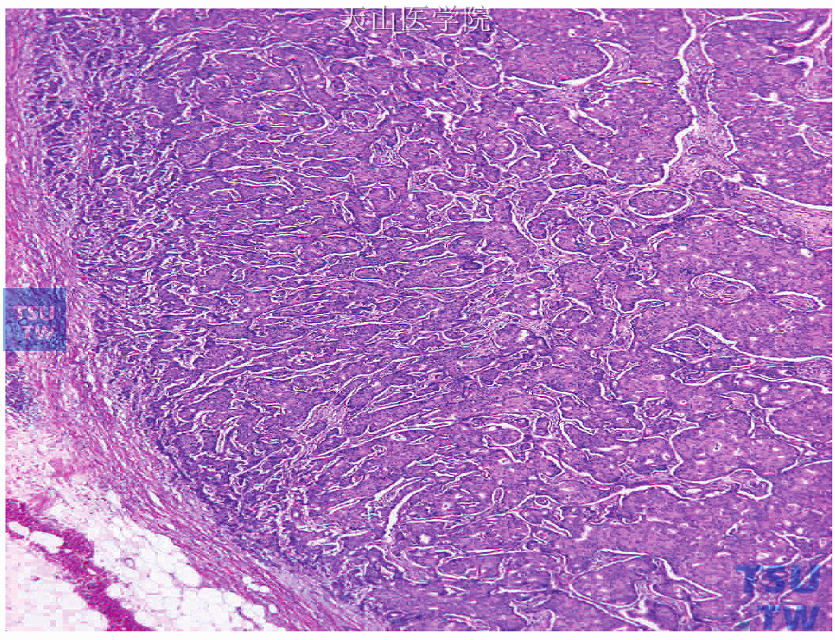
图19-8 癌细胞呈实性排列,选择肿瘤进展的先端部分进行检测
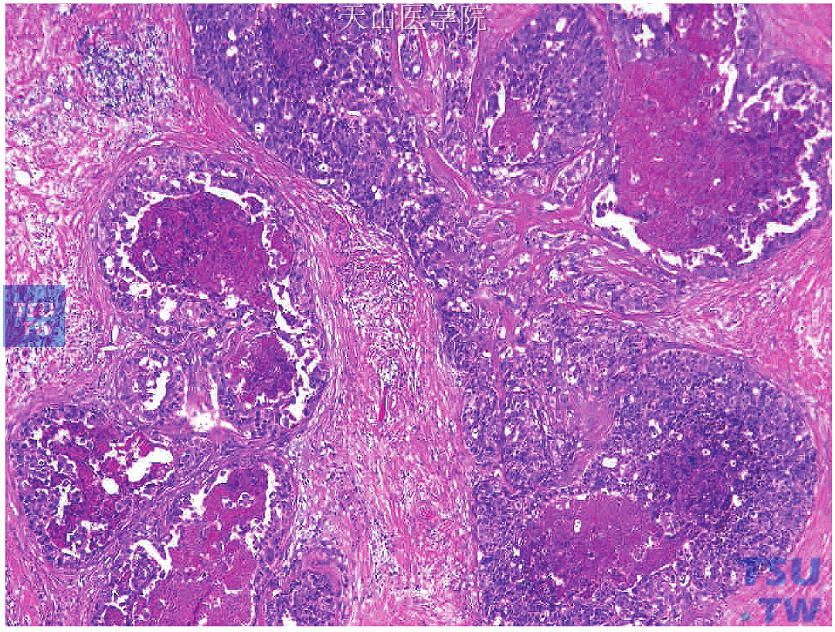
图19-9 浸润性癌与导管内癌混合,选择浸润性癌成分多的部分进行检测
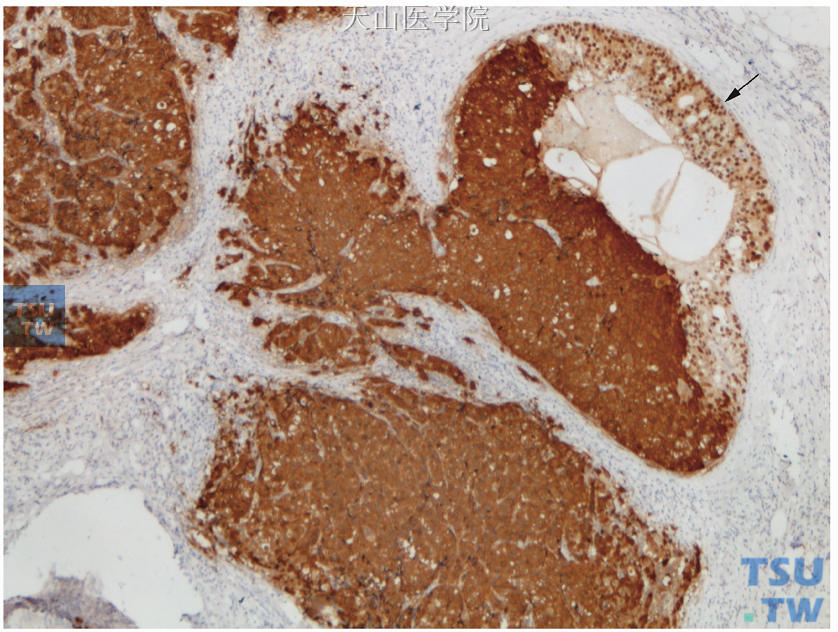
图19-10 图19-9连续切片的ER免疫组化检测,浸润性癌成分及部分导管内癌成分阴性(细胞质着色),仅极少部分导管内癌成分(箭头所示)阳性(核着色)
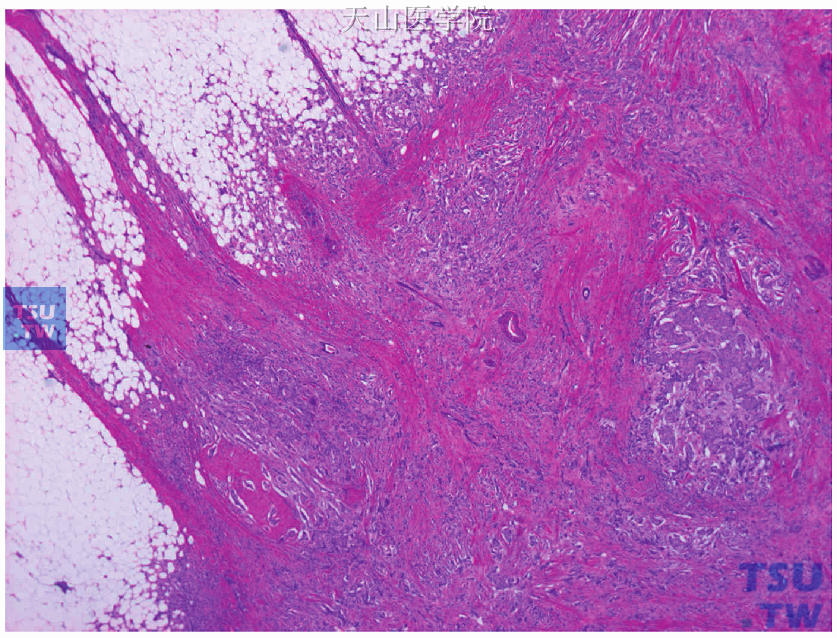
图19-11 癌巢内纤维化,选择癌细胞较多、纤维化较轻的肿瘤先端部分进行检测
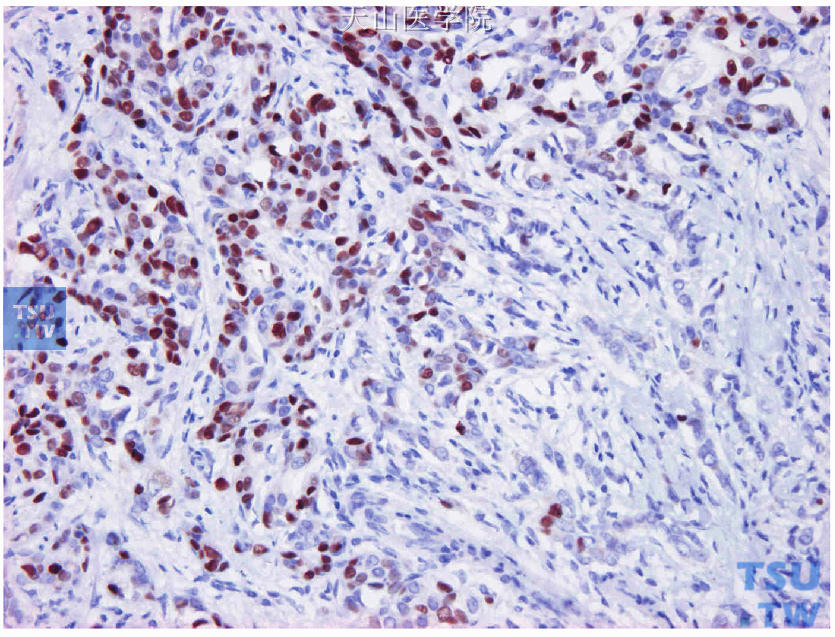
图19-12 图19-11连续切片的ER免疫组化染色,肿瘤中央纤维化明显部分的肿瘤细胞(图右侧)阴性
混合型乳腺癌的检测
同一肿瘤组织内存在两种或两种以上病理组织学类型的乳腺癌(图19-13、图19-14),应对各类型组织都进行检测和评估(图19-15~图19-17),也可选择转移灶进行检测评估。
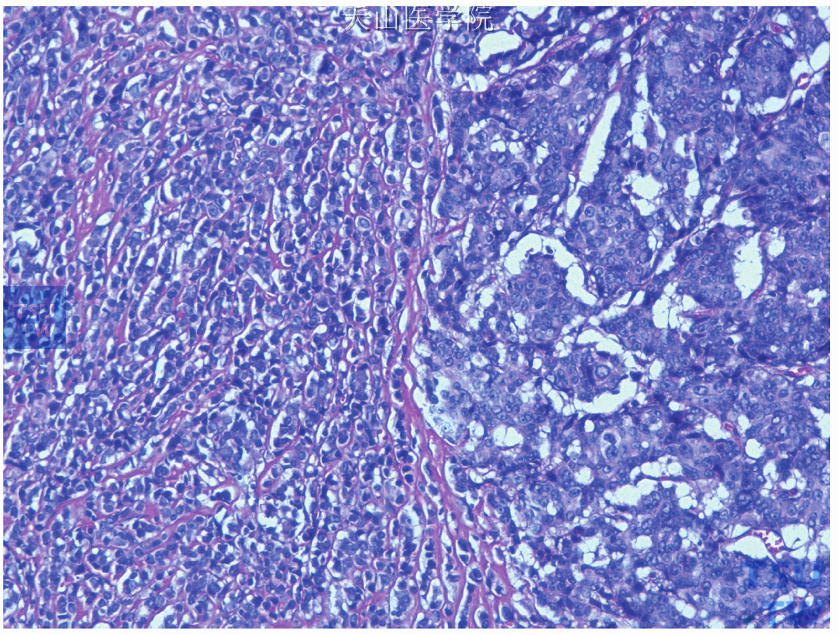
图19-13 混合型癌,经典型浸润性小叶癌(左侧)伴非特殊型浸润性导管癌(右侧)
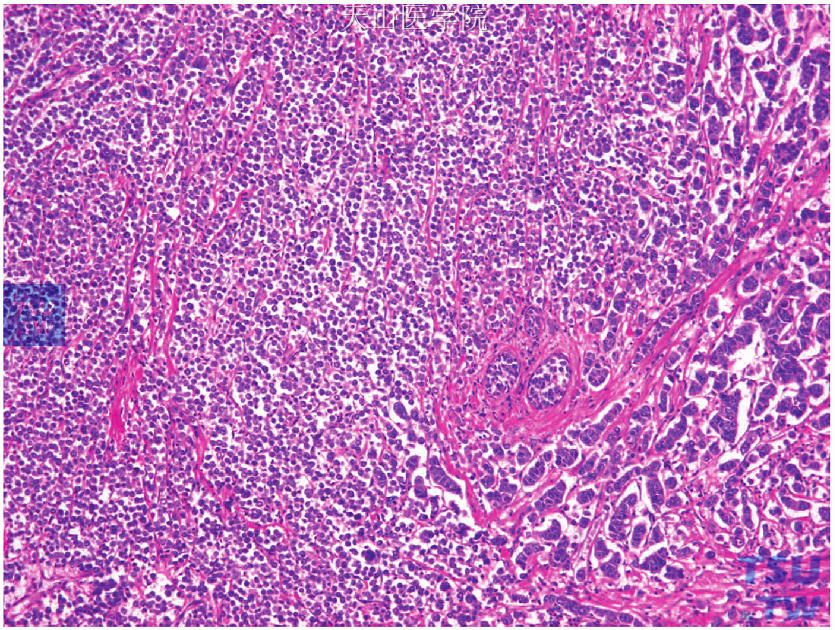
图19-14 混合型癌,变异型浸润性小叶癌(左侧)伴浸润性微乳头状癌(右侧)
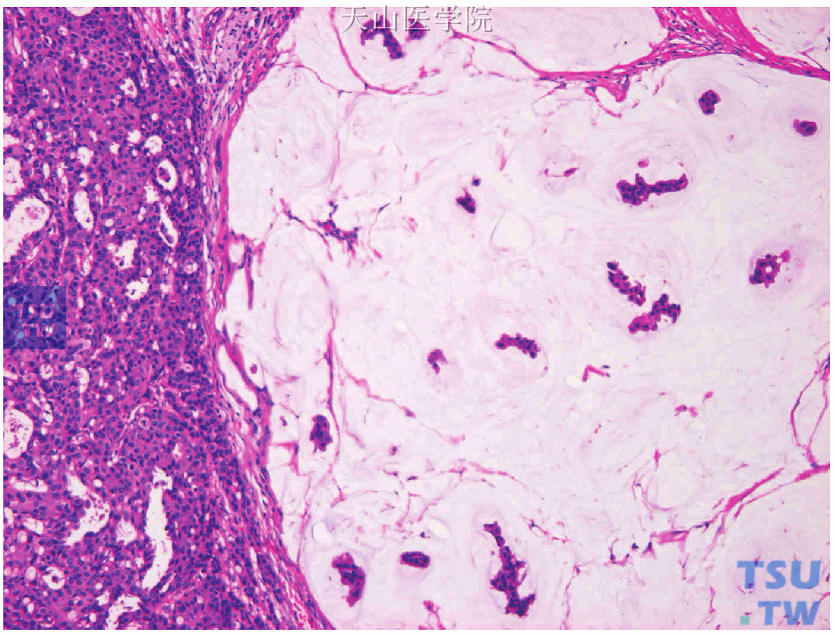
图19-15 混合型癌,非特殊型浸润性导管癌(左侧)伴纯型黏液癌(右侧)
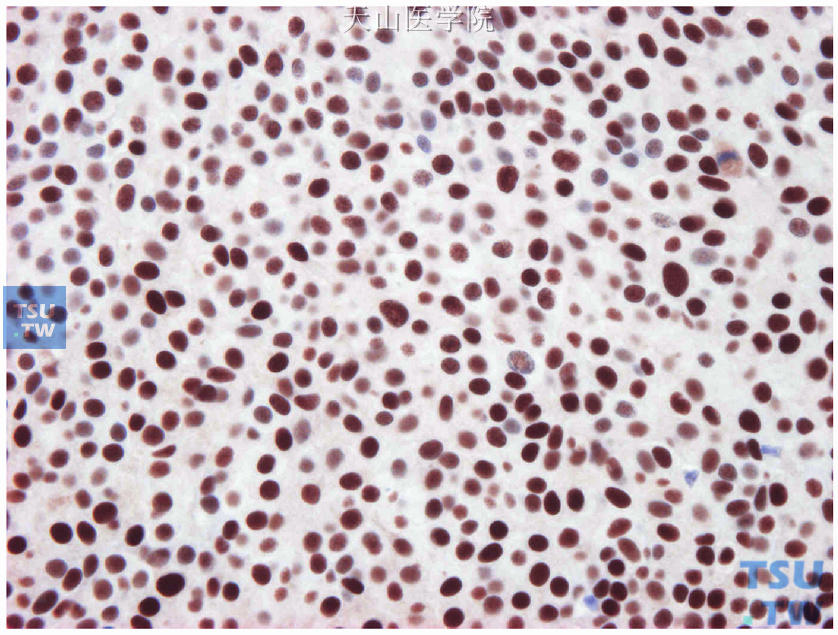
图19-16 图19-15连续切片的ER免疫组化检测,非特殊型浸润性导管癌的阳性细胞>90%,中-强着色
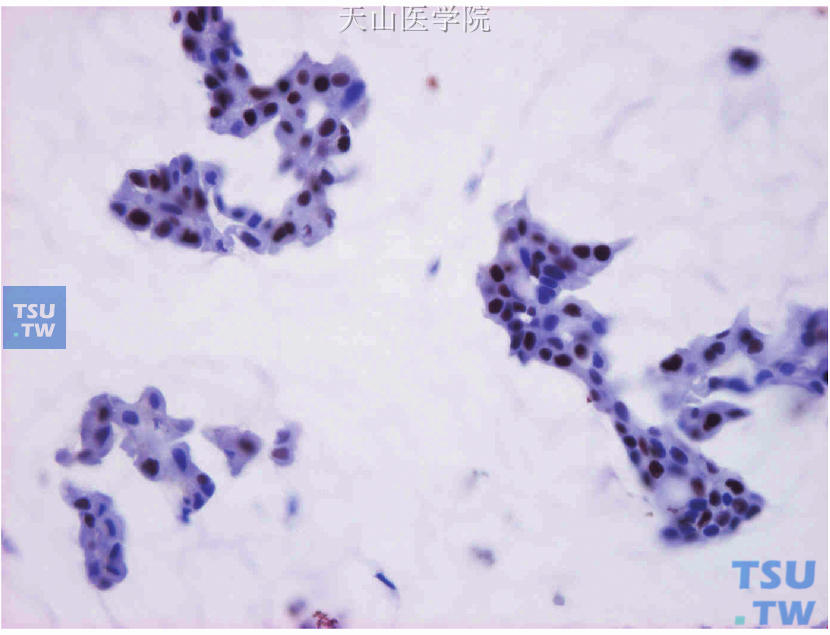
图19-17 图19-15连续切片的ER免疫组化检测,纯型黏液癌的阳性细胞约占70%,强-中着色
