正常情况下,ROS在体内参与能量的产生、重要生物复合物的合成、细胞的吞噬,调节细胞生长和细胞内信号转导,同时与杀菌、炎症反应有关。然而如果机体受到内外各种因素的干扰,使得活性氧的水平增高或者细胞抗氧化系统减弱,机体氧化还原状态失衡,将会导致肿瘤的产生。大量的研究证据显示肿瘤患者处于一个低抗氧化状态,并且氧化应激水平增高。Sharma M等发现治疗前舌癌患者的脂质过氧化水平明显高于对照组(P=0.001),而谷胱甘肽、谷胱甘肽过氧化物酶、SOD、维生素C和维生素E水平明显下降。Laurent A等报道了小鼠结肠癌CT26和肝癌Hepa 1~6模型的SOD和过氧化氢酶的活性明显低于小鼠成纤维细胞NIH 3T3模型,并且通过免疫组化染色揭示了人类和动物的恶性肿瘤早期阶段均出现了低水平的抗氧化酶水平改变。Kumaraguruparan R等对乳腺纤维腺瘤和乳腺癌患者的脂质过氧化和抗氧化状态(包括SOD、CAT、GSH、GPx)做了比较。结果显示,乳腺癌患者脂质过氧化水平增高,而抗氧化酶水平降低(P<0.05)。Abiaka C等对97例肿瘤患者在治疗前测定了红细胞SOD活性,其中包括胃肠道肿瘤(n=40)、乳腺癌(n=30)和其他肿瘤(n=27),通过与60名健康人的对照组比较,发现SOD的活性在所有部位的肿瘤中均明显降低(胃肠道肿瘤、乳腺癌和其他肿瘤同对照组相比分别为P<0.0001、P<0.0001和P<0.0001)。ROS不仅参与肿瘤的发生、发展,它在肿瘤转移方面也发挥着非常重要的作用。Ishikawa K等人发现,细胞线粒体DNA损伤将会导致线粒体复合体Ⅰ的功能低下,产生ROS增多,此种肿瘤细胞具有高转移能力,活性氧清除剂可降低细胞转移能力;如果采用胞质融合技术将此种DNA突变线粒体转移到低转移潜能的细胞株,可以使此细胞株获得高转移能力。这项研究提示我们线粒体的ROS与肿瘤转移有关。Hyoudou K等采用小鼠自发肺转移模型研究发现,尾静脉注射SOD和CAT后的小鼠肺部肿瘤转移结节明显减少,再次为活性氧促进肿瘤转移提供有力的证据。Ryan MJ等报告,别嘌呤醇治疗显著改善足底跖屈肌最大等长收缩力,提示氧化反应参与了骨骼肌减少及功能障碍的病理生理过程(图1-7-8)。
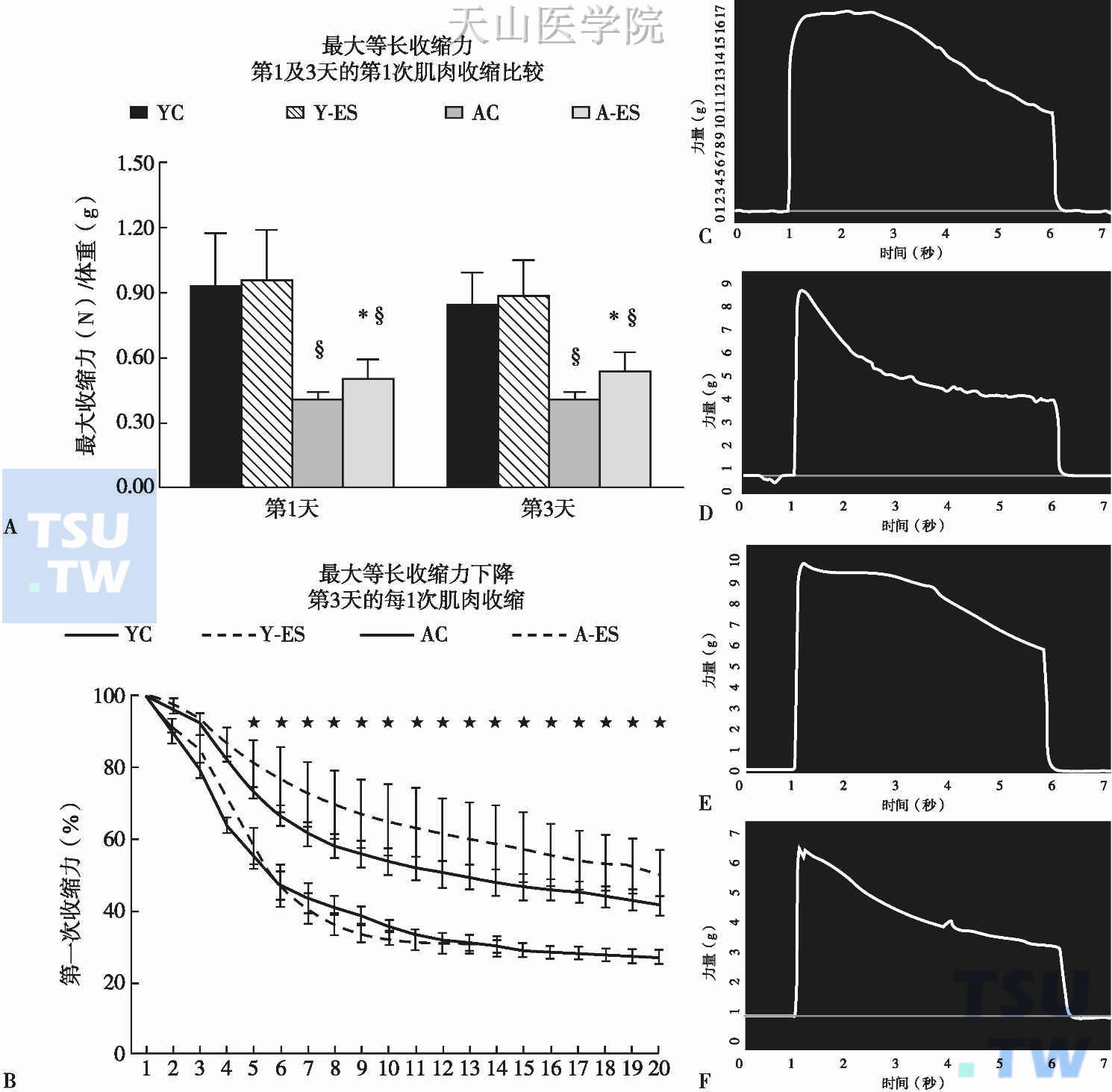
图1-7-8 足底跖屈肌最大等长收缩力
A:年轻对照组(young control,YC)、年轻电刺激组(young electrically stimulated,Y-ES)、年老对照组(agedcontrol,AC)和年老电刺激组(aged electrically stimulated,A-ES)数据均以平均值±平均数标准误格式,表示在原位点刺激的第三天记录到的左侧跖屈肌群的最大等长收缩力,并根据动物体重(g)进行标准化。§在假手术组和别嘌呤治疗组可见老化的效应(P<0.05)。B:数据以平均值±平均数标准误格式,表示每一次收缩的最大等长收缩力与初次收缩的最大等长收缩力之间的相对差异。所有的收缩力测量均根据动物体重进行标准化。*提示在年老假手术组和年老别嘌呤醇组动物中,相比年轻成年空白手术组和年轻成年别嘌呤醇组有统计学意义的差异(P<0.05)。C~F:别嘌呤醇治疗的年轻成年组和年老组动物第三轮电刺激所得代表性的收缩力X时间曲线。C:一只年轻成年小鼠第三天的第一次收缩数据。D:一只年轻成年小鼠第三天的第二十次收缩数据。E:一只年老小鼠第三天的第一次收缩数据。F:一只年老小鼠第三天的第二十次收缩数据
氧化反应损伤是恶液质的重要发病因素。一项包括抗氧化剂、药理营养素、孕酮及COX-2抑制剂的Ⅱ期临床研究发现:上述药物的联合应用治疗不同肿瘤恶液质既安全又有效。目前许多上市的抗肿瘤药物和放疗技术可以通过增加细胞内ROS的产生而诱导肿瘤细胞的凋亡。Mizutani H等用化疗药多柔比星(doxorubicin,DOX)分别作用于人早幼粒白血病细胞株HL-60和耐H2O2的亚克隆HP100,孵育7小时后,HL-60细胞出现DNA氧化损伤,线粒体膜电位改变,半胱天冬酶(caspase)-3激活等诱导的细胞凋亡,而在相同条件下HP100细胞株不发生凋亡,提示我们DOX很可能通过产生H2O2来介导细胞凋亡。Groninger E等用长春新碱(vincristine,VCR)作用于急性淋巴细胞性白血病(acute lymphocytic leukemia,ALL)细胞株Jurkat细胞,在VCR作用的早期即可检测到ROS的存在,应用ROS清除剂作用后,ROS的产生被抑制,caspase-9及caspase-3活性降低,进而细胞凋亡受抑。又如,活性氧的产生在抗癌药三氧化二砷诱导肿瘤细胞凋亡中也发挥重要作用。
尿酸(uric acid,UA)是嘌呤代谢的终产物,恶液质条件下由于黄嘌呤氧化酶(xanthine oxidase,XO)水平升高及组织耗损,UA升高。血浆UA水平升高提示ROS XO依赖的产物升高,并与代谢紊乱及不良预后密切相关。Springer J等人直接观察了XO在肿瘤恶液质中的作用,给动物腹腔注射AH-130肝癌细胞,并以XO抑制剂——别嘌呤醇或异嘌呤醇(活性更强),或安慰剂治疗15天,别嘌呤醇或异嘌呤醇分别设立高剂量[40mg/(kg•d)]、低剂量[(4mg/(kg•d)]两个不同剂量治疗组,作者发现:高、低剂量别嘌呤醇治疗组、低剂量异嘌呤醇治疗组,动物体重丢失及组织耗损显著减轻;安慰剂治疗组,动物XO活性显著升高,OX抑制剂治疗可以显著降低OX活性;XO抑制剂治疗后,ROS诱导的细胞因子信号、蛋白质水解活性、组织分解明显减轻,生存时间延长(呈剂量依赖)、摄食量增加,自主活动能力提高(说明生活质量改善)(图1-7-9)。
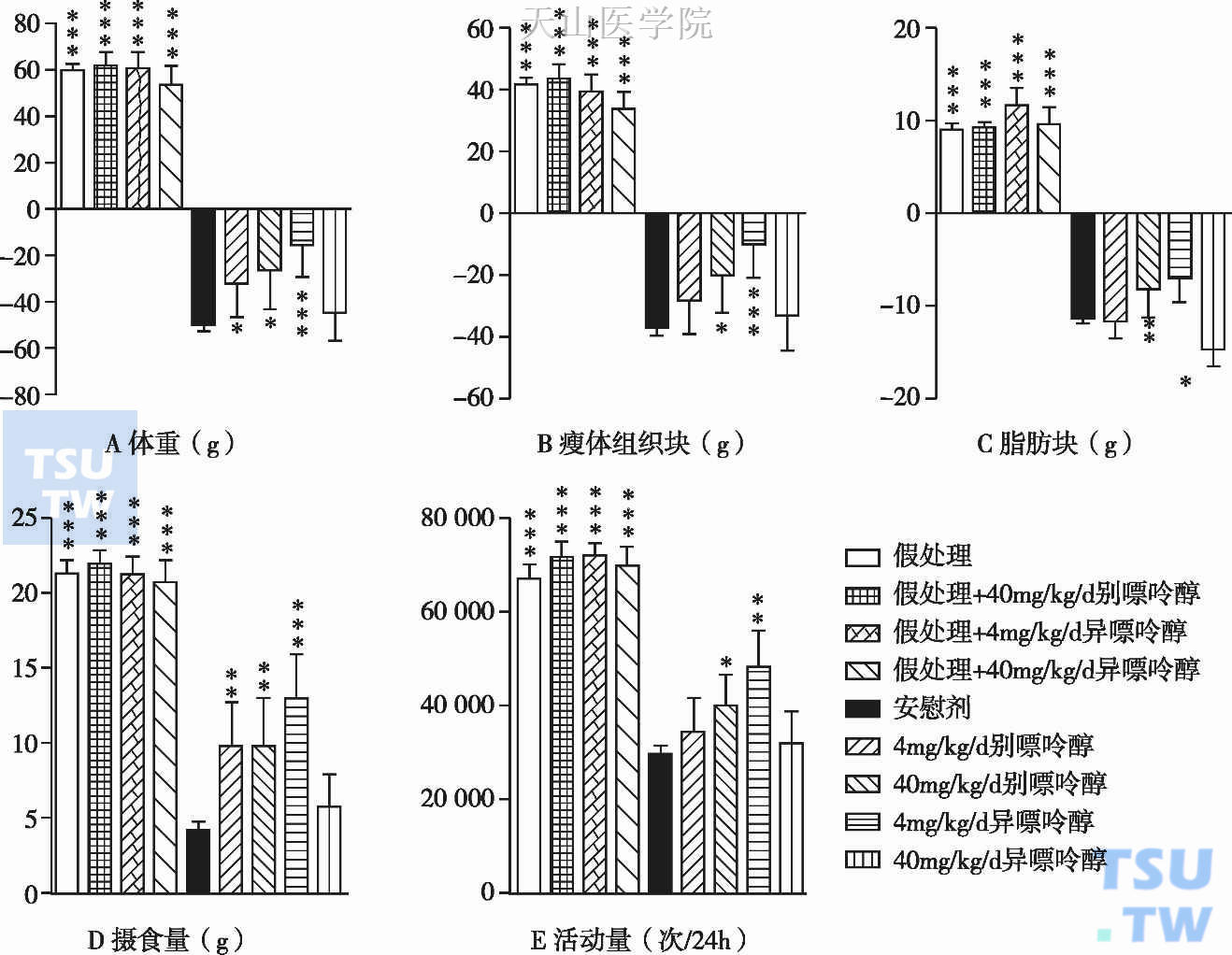
图1-7-9 XO对肿瘤恶液质的治疗作用
A:体重变化;B:瘦体组织块变化;C:脂肪块变化;D:摄食量变化;E:自主活动能力变化。肿瘤恶液质动物表现出严重的体重丢失,低剂量异嘌呤醇及高低剂量别嘌呤醇治疗后,体重丢失明显减轻,但是没有完全逆转;瘦体组织块(骨骼肌)丢失也因低剂量异嘌呤醇及高剂量别嘌呤醇治疗而明显改善,低剂量别嘌呤醇治疗也有改善趋势;只有低剂量异嘌呤醇治疗显著改善了脂肪块;低剂量异嘌呤醇及高剂量别嘌呤醇治疗后第11天,动物生活质量(摄食量及自主运动)显著改善,而低剂量别嘌呤醇只改善了摄食量;与安慰剂比较,*P<0.05,**P<0.01,***P<0.001
