氧化应激被认为是恶液质发展过程中的一个重要元素,它直接通过氧化损伤或者间接通过信号途径导致肌肉的消耗。
本节我们会从肿瘤恶液质、ESRD相关恶液质、COPD相关恶液质等几个方面来探讨恶液质与氧化应激之间的联系。
肿瘤恶液质
Hinch ECA等发现肿瘤恶液质的心肌存在氧化应激水平增高,具体的研究设计如下:
分组:6周龄的小鼠随机分成体重匹配的三组:非肿瘤组(对照组,8例)、肿瘤无恶液质组(肿瘤组,12例)、肿瘤同时伴随有恶液质组(恶液质组,16例),在试验前后分别测量小鼠摄入的食物和饮水量,以便排除能量摄入不足带来的干扰与误差。
模型:在RPMI培养基中加入10%胎牛血清(fetal bovine serum,FBS)和0.5%的青霉素或者链霉素(Invitrogen公司试剂盒)来培养小鼠的腺癌细胞株(murine adeno-carcinoma cell,MAC)13和MAC16。接种了MAC13细胞株的小鼠将会演变为不伴随恶液质的恶性肿瘤(肿瘤组);而接种了MAC16细胞株将会导致实体肿瘤和恶液质的产生(恶液质组)。
细胞被保存在37℃含有10%CO2的潮湿培养器中,当细胞汇合度达到80%后通过胰蛋白酶化作用进行分离,然后在4℃下用500×g离心5分钟,从而从生长培养基中分离出来。接下来细胞要在灭菌的PBS中重悬,然后吸入25口径大小针头的注射器中,最后接种到小鼠体内。小鼠的体重每天都要记录,肿瘤的大小也要用卡尺测量。大概需要(30±3)天,当体重减轻达到小鼠原始重量的25%或肿瘤生长超过1000mm3,小鼠将会被安乐死,获取的组织立即放在液氮中,之后会被储存于-80℃的冰箱用于研究分析。心脏被完整取出,同时要清除所有的血液用于测量;在心室冰冻之前,心房组织及大血管也要去除。
SOD酶的活性分析:在肝素化的PBS中清洗心肌组织,其中的15mg用于酶活性分析。使用5ml的HEPES缓冲液(pH 7.2)20mmol/L来摇匀心肌组织(相当于每克组织中含有1mmol/L EGTA、210mmol/L甘露醇和70mmol/L蔗糖)。样品需要标准化以便于10µl样品(含有10mg蛋白质)加入到96孔试验板的每个小孔中,接下来按照制造商(Cayman Chemical公司)的指示测定SOD的活性。
DNA氧化试验:使用ELISA装置(StressMarq-Biosciences公司)来测量DNA的氧化产物8-羟基-2-脱氧鸟苷(8-hydroxy-2-deoxy guanosine,8-OH-2dG);使用DNA分离装置(Promega公司)从15mg组织中抽取DNA。
RT-PCR:使用trireagent从冰冻的心肌组织中抽取RNA(分子研究中心),总的RNA浓度用260nm波长进行分光光度测量;所有的样品需要使用反转录仪器(Marligen公司)来转变为cDNA(储存于-20℃用于以后的研究)。RT-PCR通过IQ5 PCR检测装置来实行(Bio Rad公司)。
蛋白质定量:心肌组织在20mmol/L HEPES缓冲液中混匀,混合物离心之后提取上清液并放置在冰块上;使用BCA 蛋白定量试剂盒(Bio Rad公司)来测定蛋白质含量。
统计分析:记录值采用平均数±标准误来表达,用双因素方差分析来分析。
结果:心肌的氧化损伤通过测量8-OH-2dG (DNA氧化的生物标记)来评估。
他们发现,恶液质组的小鼠8-OH-2dG[(71±26)pg/ml]高出对照组[(45±18) pg/ml,P=0.02]和肿瘤组[(43±24) pg/ml,P=0.015]1.5倍,证实了恶液质组中氧化应激水平高(图2-4-1)。
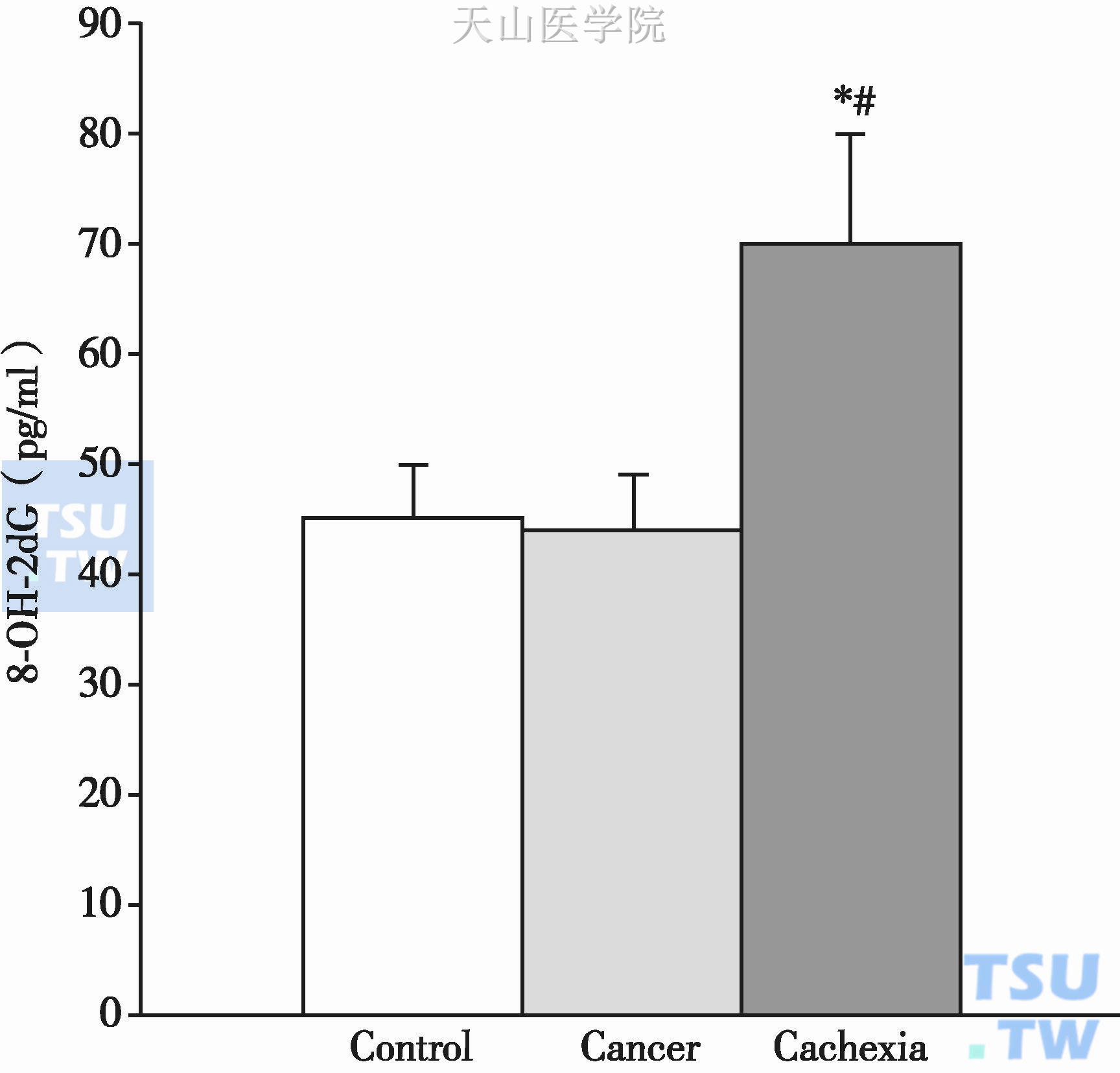
图2-4-1 对照组、肿瘤组、恶液质组的8-OH-2dG量
*,P<0.05,表示与对照组存在统计学意义;#,P<0.05,表示与肿瘤组存在统计学意义
Marin-Corral J等在另外的研究中也发现肿瘤恶液质改变了小鼠骨骼肌和心肌的氧化还原平衡,一些参与肌肉结构和功能的重要蛋白质氧化修饰增加。
ESRD相关的恶液质
在研究终末期肾病相关并发症的过程中,也发现了氧化应激。
终末期肾病患者存在脂质异常,具体包括:
1. 血清载脂蛋白A(apolipoprotein A,ApoA)1和高密度脂蛋白(high-density lipoprotein,HDL)浓度降低,HDL成熟障碍以及HDL抗氧化、抗炎和逆向胆固醇转运功能受损。
2. 肌肉和脂肪组织对于极低密度脂蛋白(very low-density lipoprotein,VLDL)和乳糜蛋白清除能力受损导致高甘油三酯血症、中密度脂蛋白和乳糜蛋白残余物的堆积。
3. 结构的异常、氧化应激以及HDL抗氧化活性的损伤导致低密度脂蛋白(low-density lipoprotein,LDL)和脂蛋白残余物的氧化修饰。
这些异常最终将导致:
1. 泡沫细胞的形成和动脉粥样硬化。
2. 氧化修饰的LDL和磷脂刺激白细胞和巨噬细胞产生炎症介质和ROS,从而增强氧化应激与炎症反应。
3. 循环中氧化的脂类和脂蛋白通过脂质过氧化反应导致氧化应激的扩散。
4. HDL抗氧化、抗炎和抗血栓的特性降低,使得氧化应激以及炎症的损伤效应加大。
5. VLDL和乳糜蛋白将脂质原料运送到肌肉和脂肪组织的能力受损将导致肌肉萎缩和恶液质,这在终末期肾病患者中常发生(图2-4-2和图2-4-3)。
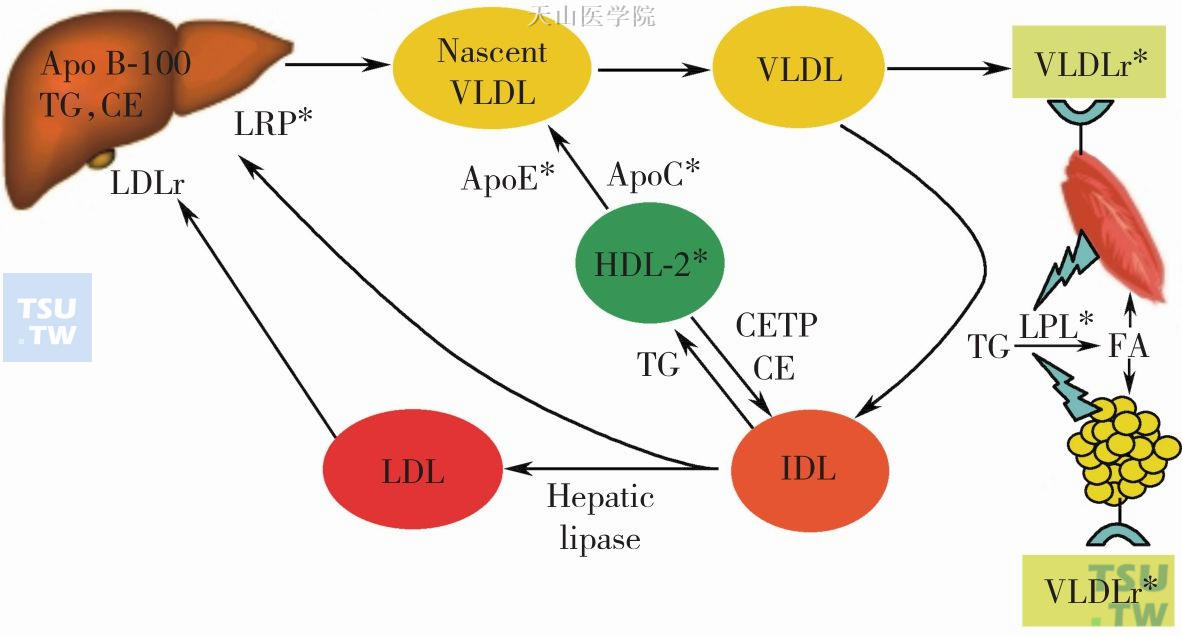
图2-4-2 VLDL代谢途径
新生的VLDL由肝脏产生并释放入循环中,它是以ApoB100为核心,装载了甘油三酯(triglycerides,TG)、胆固醇酯(cholesterol ester,CE)和磷脂的脂滴。在循环中,新生的VLDL需要从HDL-2中获取ApoE和ApoC转变为成熟的VLDL,再通过脂蛋白酯酶(lipoprotein lipase,LPL)裂解TG释放大量的脂肪酸,邻近的脂肪细胞可以用来储存能量,而肌肉细胞可用其产生能量。慢性肾脏疾病将引起LPL等重要酶的下调,导致VLDL的蓄积,同时减少了骨骼肌细胞对于脂质的利用和脂肪细胞对于脂质的储存
它提示我们氧化应激参与终末期肾病相关恶液质的病理生理过程,找到降低氧化应激水平的途径,将有利于阻止疾病的进展。
一项流行病学资料显示美国的350 000个持续性血液透析患者每年有超过20%的死亡率,将近一半被认为是由于心血管因素引起的,Kalantar-Zadeh K等的研究指出肾脏疾病消耗状态(kidney disease wasting,KDW)的指标比如低蛋白血症、食欲减退、体重和脂肪的丢失更像是这些患者早期死亡的主要因素。KDW与氧化应激密切相关,换句话说,氧化应激关系到持续性血液透析患者的预后。
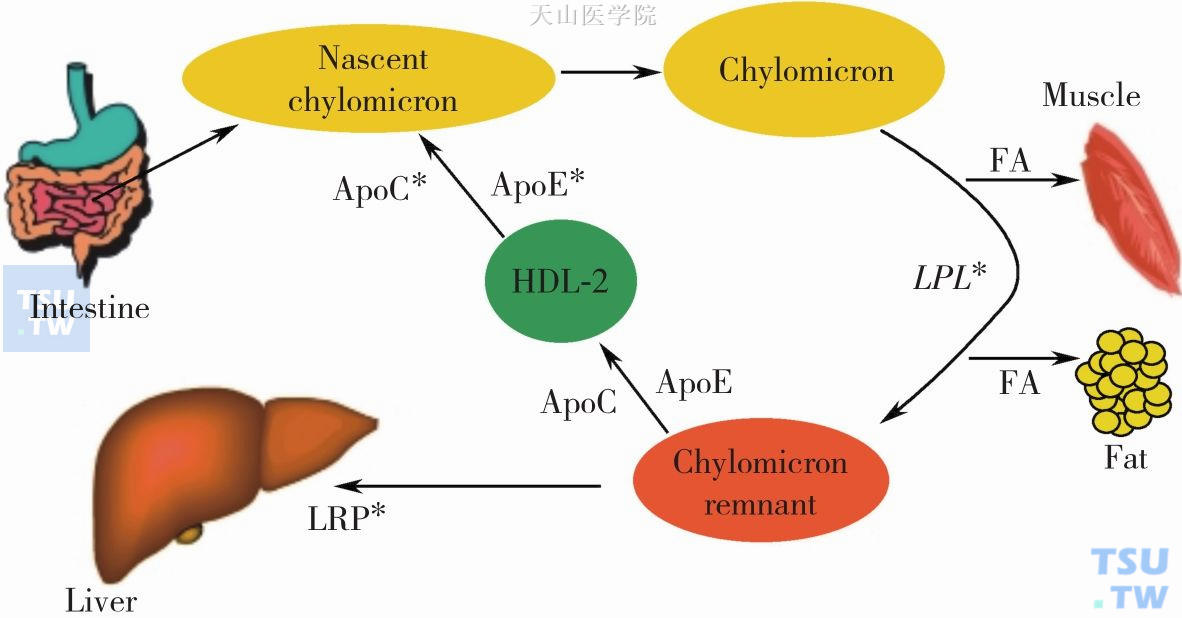
图2-4-3 乳糜蛋白的代谢途径
乳糜蛋白负责将饮食中的脂类燃料输送到骨骼肌细胞产能和脂肪细胞储能。新生的乳糜蛋白以ApoB48作为核心,装载了TG、胆固醇酯和磷脂。它先从HDL-2中获取ApoE 和ApoC,然后在骨骼肌和脂肪组织中通过LPL完成脂解作用,游离脂肪酸被肌肉组织和脂肪组织利用,乳糜蛋白的残余物再通过LDL受体相关蛋白(LDL recepter-related protein,LRP)进入肝脏代谢。慢性肾脏病下调了LPL和LRP,导致乳糜蛋白的清除障碍,同时引起骨骼肌、脂肪细胞对于脂质的利用障碍
COPD相关的恶液质
基于运动可以引起急性的炎症反应和氧化应激,Van Helvoort HA等为了比较运动对于存在肌肉萎缩的COPD患者和健康者之间氧化应激水平的影响,评估了10例肌肉萎缩(无脂肪质量指数,fat-free mass index,FFMI<16kg/m2男性;<15kg/m2女性)和10例无肌肉萎缩的COPD患者及10例健康者的肺功能以及股四头肌的肌力,同时在最大量和次最大量(最大工作效率的50%)的运动前后测定了中性粒细胞产生ROS的量、血浆抗氧化能力、蛋白质氧化、脂质过氧化反应、氧化谷胱甘肽与还原型谷胱甘肽的比值(GSSG/GSH),结果显示在肌肉萎缩的COPD患者中抗氧化水平减低(血浆抗氧化能力,P<0.05;GSH,P<0.05),蛋白质氧化水平升高(P<0.001),反映了基础的氧化应激水平升高;他们同时发现最大量和次最大量的运动可以提高试验组氧化反应水平(中性粒细胞释放ROS+32%;GSSG/GSH+29%;脂质过氧化+30%)。研究提示我们伴有肌肉萎缩的COPD患者氧化应激水平增高,同时对于运动的反应更加灵敏,氧化应激可能在某种程度上促进COPD疾病的进展。
Bismas S等分析研究了大量文献,他们发现许多药物或饮食的方式可以通过增强肺的抗氧化水平,从而干预COPD的进展。我们推测控制氧化应激水平能够阻止COPD的进展,包括恶液质、心血管的并发症等。
