一系列关于恶液质的研究提示我们,氧化应激在恶液质的发生发展过程中发挥很重要的作用,然而具体的机制还不是很清楚,学者们试图从下面的研究中找到线索。
泛素-蛋白酶体系统的活化
证据表明,泛素-蛋白酶体系统(ubiquitin proteasome system,UPS)的活化在氧化应激与恶液质肌肉萎缩的联系中起到重要的作用。
为了阐明ROS导致瘦体组织丢失的机制,Gomes-Marcondes等将小鼠的肌小管细胞暴露在H2O2中来诱导氧化应激,他们发现UPS重要成分(比如20S蛋白酶体和E214k连接酶)的表达量增加。
UPS E3连接酶肌肉环指蛋白(muscle ring finger,MuRF)1和肌肉萎缩 F-box 蛋白(muscle atrophy F-box,MAFbx)在心肌细胞中表达,对于心脏蛋白质转化很重要。这些连接酶mRNA的表达与心肌肌钙蛋白I、α-肌动蛋白-2和骨骼肌细胞肌源分化因子(myogenic differentiation antigen,MyoD)的降解有关,从而导致心肌收缩力的下降。E.C.A.Hinch等也做了相应的研究,他们发现MuRF-1和MAFbx mRNA的水平比对照组分别高出4.3倍(P=0.04)和3.8倍(P=0.04)。
目前的局限是MuRF-1和MAFbx的研究停留在mRNA水平,另外,UPS如何活化、其他蛋白裂解系统的作用和泛素连接酶上游蛋白比如Akt和Foxo的磷酸化水平需要进一步阐明。
NADPH氧化酶
NADPH氧化酶(NADPH oxidase,NOX)是一类能够催化O2-产生的酶系统,具有多个亚单位,它被认为是肿瘤恶液质ROS主要的缔造者。NOX与细胞许多负性效应有关,比如细胞凋亡和炎症反应,这些将最终导致疾病的产生和进展。NOX在一些氧化还原信号途径中也充当了下游的调节剂,在这些途径中,其产生的ROS可以作为信号级联反应的步骤,最终影响到基因的表达调控(图2-4-4)。
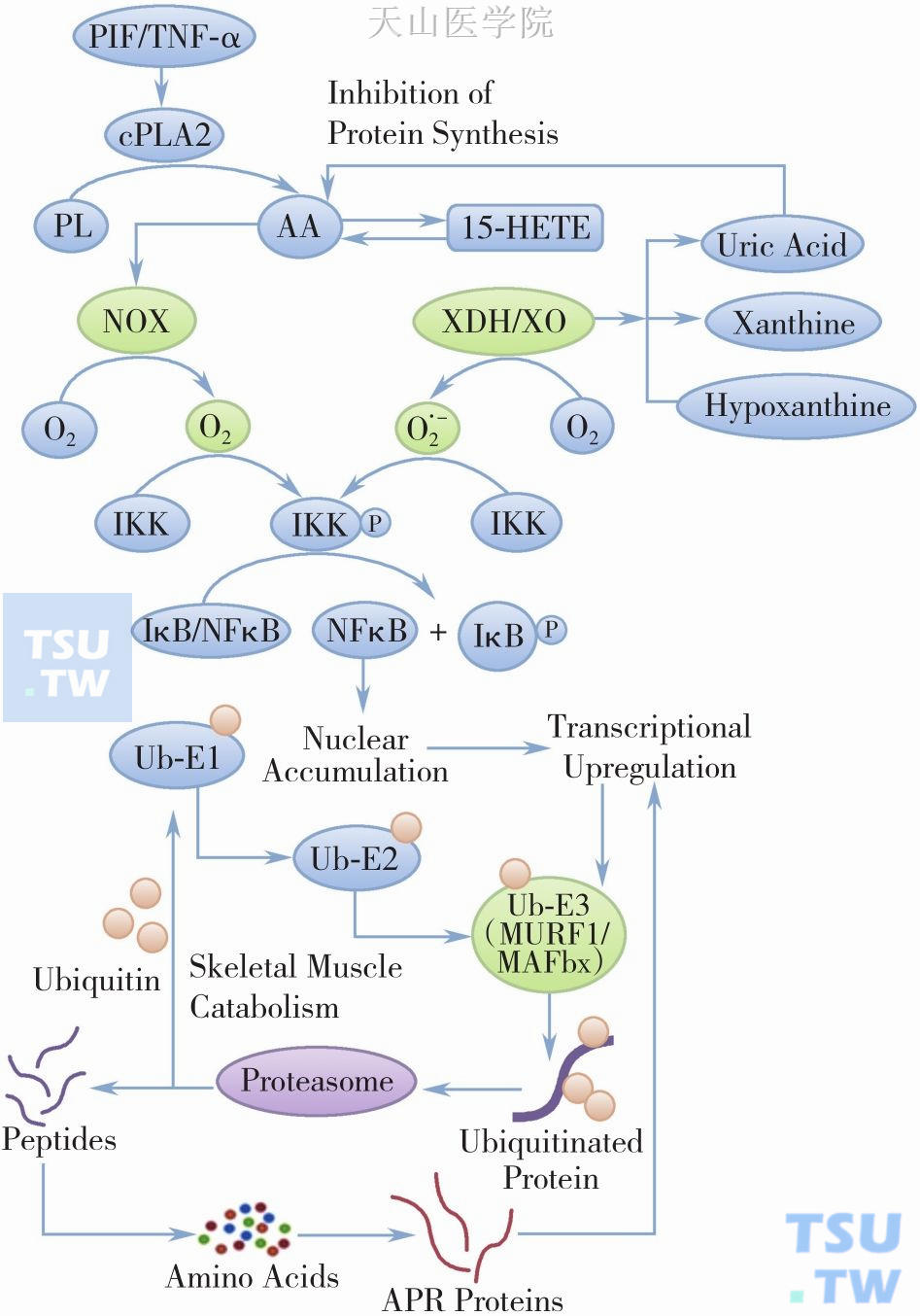
图2-4-4 泛素-蛋白酶体途径的诱导
肿瘤因子和前炎性介质启动了复杂的信号级联反应,最终导致骨骼肌分解代谢的增加。PL,磷脂;AA,花生四烯酸
根据上述的理论,我们猜想在恶液质患者中NOX的水平会增高,继而氧化应激水平高。E.C.A.Hinch等利用RT-PCR检测了NOX的重要调节亚单位(p40phox和p67phox)和催化核心单位(NOX1、 NOX2和NOX4)的水平,结果显示除了恶液质组NOX2的基因表达量比肿瘤组要低1.7倍,他们未发现其他成分具有统计学意义。同样,Melanie J等的研究也发现在恶液质骨骼肌中NOX2酶的亚单位比如p40phox和p67phox的表达量降低,这说明NOX2的下调是伴随着O2-的积累、蛋白质氧化的适应结果,同时提示我们肿瘤恶液质存在额外的产生O2-的机制。
黄嘌呤氧化还原酶
黄嘌呤氧化还原酶(xanthine oxidoreductase,XOR)具有两种不同的形式,黄嘌呤脱氢酶(xanthine dehydrogenase,XDH)和黄嘌呤氧化酶(xanthine oxidase,XO),它能够催化次黄嘌呤向黄嘌呤以及黄嘌呤向尿酸的转变。XDH能够利用NAD+作为电子接受者进行还原反应,同时生成NADH。在前炎性介质的参与下,XDH裂解成XO,它能够利用分子氧来完成次黄嘌呤向黄嘌呤以及黄嘌呤向尿酸的转变,同时产生高度活性的O2-和H2O2。
E.C.A.Hinch等在小鼠心肌模型上利用RTPCR发现恶液质组XDH mRNA的量比对照组和肿瘤组高两倍(P=0.04)。Menishian等也发现肿瘤患者血清中XO的水平比对照组高。最近一项研究表明,在衰老小鼠建立的肌肉减少症模型上,通过抑制XO的活性可以改善伴随氧化应激的骨骼肌损伤这一状态,这提示我们XO的抑制能够有效减少ROS的产生,从而减缓肌肉萎缩。如果我们利用这一点来指导恶液质的相关治疗,将很有前景。
解耦联蛋白3
线粒体是ROS产生的主要来源,为了避免ROS对蛋白质、DNA、RNA的损伤,线粒体产生一些机制来调节ROS的产生,这其中包括线粒体呼吸链的解耦联作用,解耦联蛋白3 (uncouplingprotein 3,UCP3)参与其中。UCP3由脂质过氧化物活化,能够从线粒体基质中运出脂肪酸或者过氧化物,从而避免了氧化损伤,同时可以通过诱导轻度解耦联作用来限制线粒体ROS的产生。
由于广泛而大量的肌肉损失,分解状态存在于多种恶液质模型。UCP3作为能量的调节者,也被用来研究与恶液质之间的关系。Ronnie Minnaard等指出,伴随着4-羟基-2-壬烯醛(4-hydroxy-2-nonenal,4-HNE,脂质过氧化的副产物)的增加,恶液质小鼠的骨骼肌UCP3蛋白含量也增加,提示我们,恶液质状态下UCP3水平的增加有利于调节恶液质相关的氧化应激并且缓解脂质毒性。
但是,UCP调节ROS的具体机制目前仍不清楚,有待于进一步的研究。
抗氧化剂
机体氧化与抗氧化需要维持一个平衡状态,才能保证正常的新陈代谢。抗氧化系统功能不足,ROS清除减少,导致氧化应激状态,也将参与恶液质的发生发展过程。
SOD能够将O2-转变为H2O2和氧气,如果SOD不能代偿O2-引起的氧化应激,将导致氧化损伤,同时引起细胞结构和功能的改变。E.C.A.Hinch等在小鼠心肌模型上发现线粒体和胞浆中SOD的mRNA水平无明显变化,但是在进一步的关于SOD活性的研究中他们得出恶液质组SOD的活性要比对照组(P=0.02)和肿瘤组(P=0.001)低1.5倍(图2-4-5)。
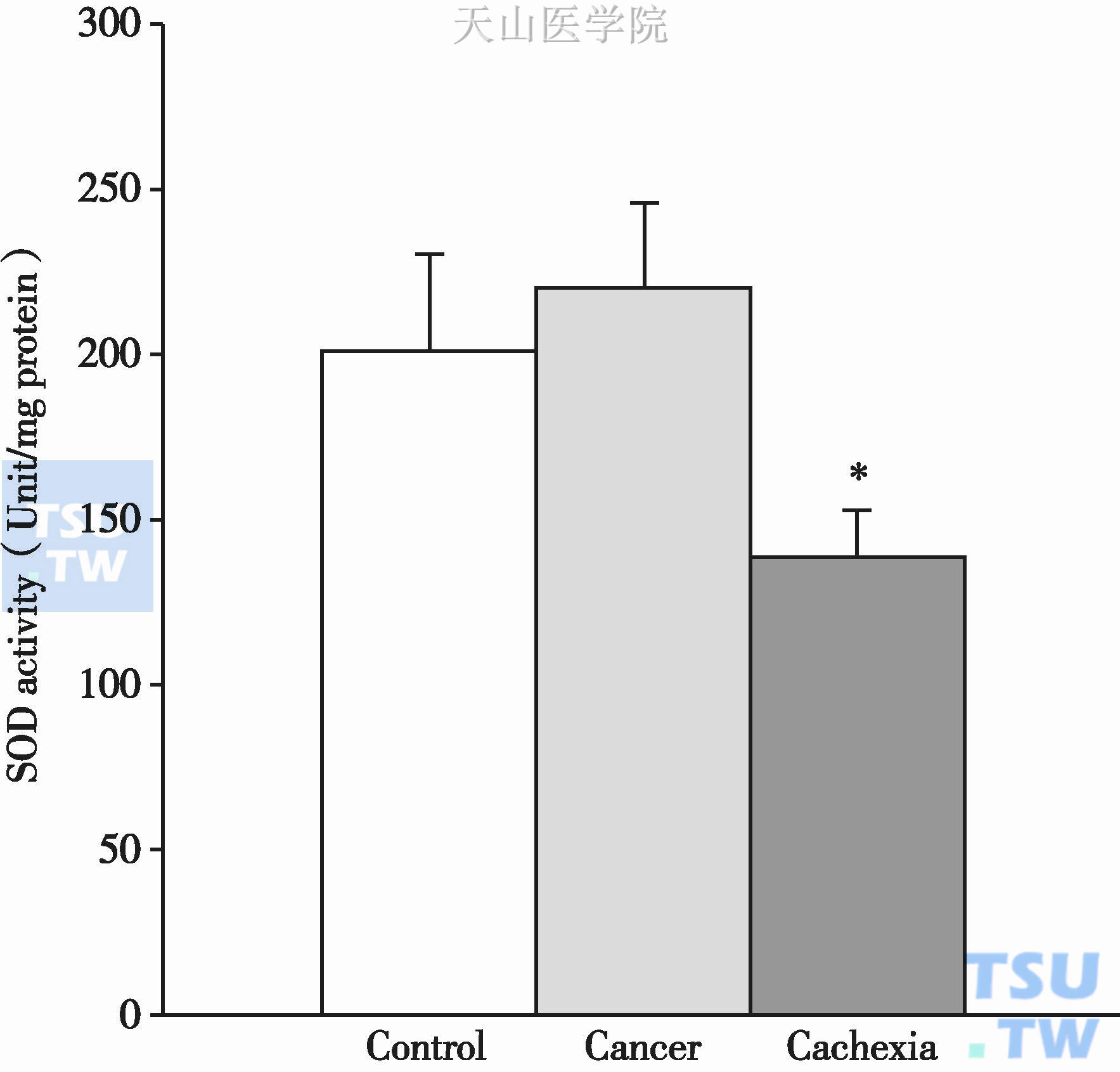
图2-4-5 总的SOD活性
*,P<0.05,表示与对照组存在统计学意义;#,P<0.05,表示与肿瘤组存在统计学意义
在一些恶液质的研究中,骨骼肌SOD的活性是降低的,而在另外的研究却没有发现这一变化,这一不同可能受设计方法以及恶液质模型的影响,具体的原因有待于进一步的研究。
过氧化氢酶是另一种抗氧化酶,它能够将H2O2分解成水和氧气。虽然H2O2没有O2-活性高,但是高水平的H2O2仍然会对细胞造成损伤,并且干扰代谢。已有恶液质方面的研究发现其水平降低。
GPx在ROS的代谢中也发挥着重要的作用,它能够利用谷胱甘肽作为还原底物来还原过氧化氢酶,不过恶液质方面的研究未发现其活性的改变。
综合相关的研究,抗氧化剂含量减少以及其对氧化的反应能力减弱,使得在恶液质状态下未能很好地保护细胞免受氧化应激的损伤,同时抗氧化剂的功能障碍可能是肿瘤恶液质氧化应激状态的主要因素。
