病例与思考
患者,男,49岁。因“进行性消瘦伴声嘶2月余,进行性吞咽困难20天”入院。患者2年前在全麻下行“食管癌根治术”,手术过程顺利。病理检查示:食管鳞癌。最近1月患者出现消瘦,体重1个月内减轻约8kg,伴声嘶食欲差,时有呕吐。入院查体:消瘦,身高1.68m,体重45kg,重度贫血貌,浅表淋巴结无肿大。胸部有一约15cm手术瘢痕。左侧腹部及腰部有瘀斑。卡氏评分40。辅助检查:血常规RBC 2.8×1012/L,Hb 85g/L,WBC4.2×109/L,生化:ALT 32U/L,AST 21U/L,TP 67g/L,ALB 28g/L,PA 60mg/L,ALP 221U/L,GGT 125U/L,TBIL 17.8µmol/L,DBIt 4.0µmol/L,Cr 31µmol/L,Ua 236µmol/L,BUN 1.6mmol/L,GLU 4.11mmol/L,TG 0.36mmol/L,GHO 2.56mmol/L,K+ 3.8mmol/L,Na+ 139mmol/L,Cl- 102mmol/L,Ca2+ 1.96mmol/L,肿瘤指标:CEA 3.7ng/ml,AFP 6.6ng/ml,CA-125 12U/ml,CA-153 12U/ml,CA19-9 27ml,TSGF 31.7U/ml。胃镜检查吻合口红肿糜烂,病理报道吻合口活检处癌变,中分化鳞癌。食管钡餐:食管下段术后改变,吻合口处黏膜钡剂充盈缺损。大便潜血:(++)。诊断:食管癌术后复发。
- 根据国内2011年的专家共识,患者是否符合恶液质的诊断?
- 营养支持治疗的方案应考虑到哪些方面?
- ω-3脂肪酸是否能改善患者目前的症状?推荐使用的剂量与剂型?
最近这些年的研究发现,常规的营养支持与治疗虽然从某种程度上能改善肿瘤患者的营养状况,但是,并不能有效地减轻由肿瘤治疗(手术、放疗、化疗)引起的分解代谢与炎性反应的过程。针对恶液质的患者更是如此。因此,学者们将注意力投向了特殊营养素,它们具有调控细胞因子的分泌与释放,减轻炎症反应,维持肠道黏膜屏障功能,增强机体免疫应答等多方面的作用。其中,ω-3多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)是肿瘤患者营养干预手段中最炙手可热的研究题材。流行病调查研究显示,城市居民不仅总脂肪摄入量相比过去20年大幅度增加,而且,饮食中ω-6 PUFAs摄入过量,ω-3 PUFAs严重不足,ω-6/ω-3比例失衡与多种疾病的发生有潜在的关联。关于ω-3 PUFAs对肿瘤恶液质患者影响的研究层出不穷,然而,不同研究的结果却不尽相同。
ω-3、ω-6 PUFAs的膳食来源
人体可以从头合成或从食物中摄取多种饱和及单不饱和脂肪酸,然而,由于哺乳动物缺乏合成ω-3、ω-6 PUFAs的脱氢酶,因此这些必需脂肪酸只能从食物中摄取。陆生植物可以合成ω-6系列PUFAs的第一个成员——亚油酸(linoleic acid,LA;18∶2ω-6)。几乎所有经常食用的植物油如玉米油、葵花油、红花油、橄榄油中,LA的含量都很丰富。植物也能合成ω-3系列PUFAs的第一个成员——α-亚麻酸(linolenic acid,LNA;18∶3 ω-3),富含α-LNA的植物包括大豆、核桃、深绿色叶蔬菜如甘蓝、菠菜、椰菜、抱子甘蓝的种子等,一些油类如亚麻子油、芥菜籽油、菜籽油中,α-LNA的含量也很丰富,同时也富含大量LA。膳食中的长链ω-3 PUFAs主要以二十碳五烯酸(eicosapentaenoic acid,EPA;20∶5 ω-3)和二十二碳六烯酸(ducosahexenoic acid,DHA;22∶6 ω-3)的形式储存于冷水鱼体内。鱼类可以从浮游植物和浮游动物中摄取EPA和DHA,值得注意的是不同种类、栖息在不同水域的鱼类,体内总脂肪及ω-3 PUFAs的含量变化很大;即便同一种类的鱼,生活在大西洋和太平洋,体内ω-3 PUFAs含量的差异也很大。但总的来讲,深海冷水鱼如鲭鱼、金枪鱼、鲑鱼等,含DHA和EPA的量最高。人工饲养的鱼类,喂食不同的饲料,其体内脂肪酸的组成也有着显著区别。ω-3 PUFAs的结构见图14-5-1。
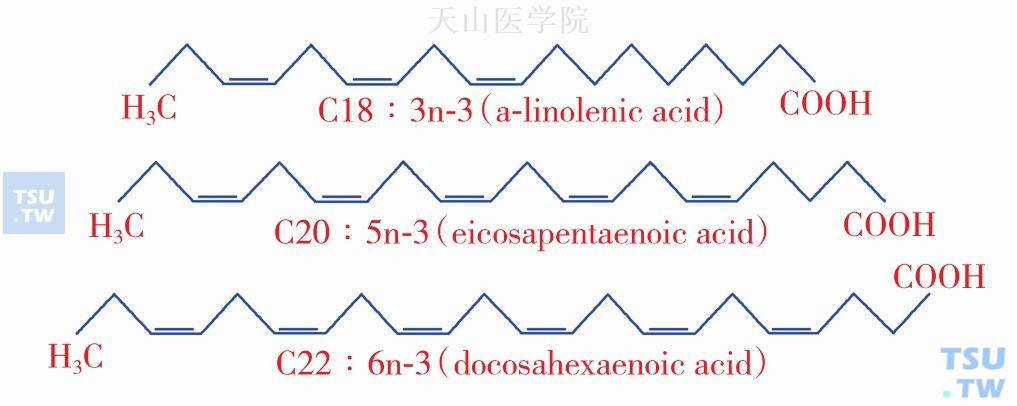
图14-5-1 ω-3 PUFAs结构图
ω-3、ω-6 PUFAs在人体内的代谢
虽然哺乳动物不能从头合成ω-3、ω-6 PUFAs,但哺乳动物细胞可以通过碳链的延长、去饱和作用和逆转等方式使PUFAs之间发生转化。摄食后,LA通过一系列氧化去饱和及碳链延长的交替作用被代谢,生成花生四烯酸(arachidonic acid,AA;20∶4 ω-6)。PUFAs转化的主要代谢途径如图14-5-2所示。Δ6途径负责LA转化为AA,α-LNA转化为EPA,这个步骤主要在肝脏细胞的内质网中进行。Δ8途径主要存在于植物中,可以生成AA 与EPA,但是与α-LNA转化为EPA不同的是,EPA能否转化为DHA是存在很大争议的。从图14-5-2看,EPA可以通过Δ4途径转化为DHA,然而,Δ4途径在DHA合成过程中的脂肪酸脱饱和作用多年来一直受到质疑,直到在植物中鉴定出Δ4脂肪酸去饱和酶后,科学家们才肯定EPA可以通过Δ4途径转化为DHA。然而,在哺乳动物体,DHA的合成是否也可经此途径,目前还不清楚。此外,有证据表明,DHA可以通过的Sprecher途径发生转化,即将二十二碳五烯醇(docosapentaenol,DPA;22∶5ω-3)转化为二十四碳二烯酸(tetracosandienoic acid,THA;24∶6ω-3)并且移位至过氧化物酶体,再通过β-氧化作用,生成比原来少2个碳原子的DHA,最后将DHA移至内质网。通过Δ6途径的去饱和酶及碳链延长作用(elo)和Δ5去饱和酶的作用,亚油酸(LA)和α-亚麻酸(α-LNA)转化为花生四烯酸(AA)和二十碳五烯酸(EPA)。EPA可以延长碳链,转化为二十二碳五烯醇(DPA),然后在Δ4途径脂肪酸去饱和酶的作用下转化为二十二碳六烯酸(DHA)。Sprecher描述,EPA可能在Δ6去饱和酶的作用下延长碳链转化为12-氧-十四烷酰佛波醇-13-醋酸酯(12-O-tetradecanoyl-phorbol-13-acetate,TPA),再进一步转化为二十四碳二烯酸(tetracosahexaenoic acid,THA),移位至过氧化物酶体,通过β-氧化生成DHA(图14-5-2)。
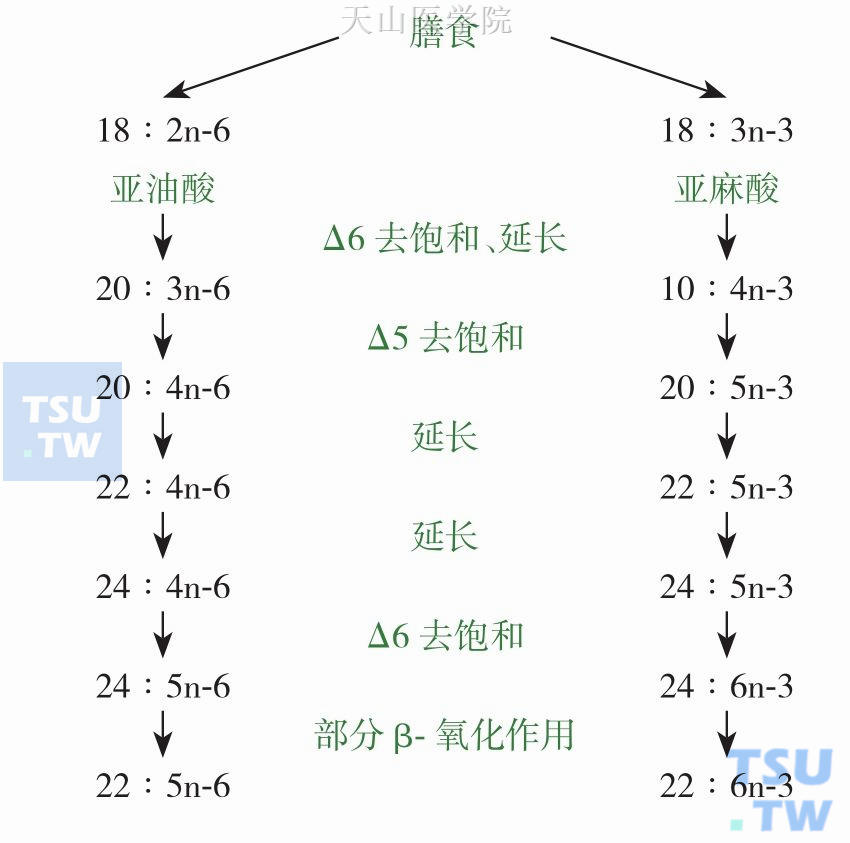
图14-5-2 ω-3 PUFAs在体内的代谢
在人体内,α-LNA转化为DHA的效率是非常低的,原因在于人体内缺乏ω-3和ω-6转化途径中的酶类。α-LNA喂养实验和稳定核素实验发现:α-LNA摄入量的增加并不会导致血浆或细胞脂质中DHA的增加。进入人体的大多数α-LNA通过β-氧化产生能量,为人体提供能源,仅有少于10% 的α-LNA转化为EPA。
ω-3 PUFAs与肿瘤风险的相关研究
从众多流行病学调查的结果来看,ω-3 PUFAs能够降低人类恶性肿瘤发生的风险,而ω-6 PUFAs则具有促进肿瘤发生的作用。近年来的多数研究认为,多不饱和脂肪酸具有一定的抗癌活性,这种抗癌活性与游离羧基和不饱和双键有很大关系。许多动物实验及流行病学资料显示,恶性肿瘤的发生与摄入脂肪的种类和数量关系密切,饱和脂肪酸和动物脂肪的高摄入会增加罹患结肠癌、乳腺癌、前列腺癌等的危险性,而经常食用富含ω-3 PUFAs的深海鱼及其他海产品的人群发生恶性肿瘤如乳癌、前列腺癌的危险性明显降低。苏格兰进行的一项研究发现,摄入整体ω-3 PUFAs及单独摄入DHA、EPA均可降低结肠癌发病的风险。
然而,也有不同的研究显示不同的结论。Kimura Y在日本进行的一项研究发现:ω-3 PUFAs的摄取量与大肠癌的发生呈负相关,这种负相关只在远端结肠癌的发生过程中有统计学意义,而食入大量ω-6 PUFAs并不增加结肠癌的发病率,摄入大量鱼类也并不能降低结肠癌的发病率。针对上述相互矛盾的结论,有学者表示可能与研究对象摄入的脂肪酸数量、质量;ω-3 PUFAs与ω-6 PUFAs的比例;组成的配方与剂型不同等因素有关。
ω-3 PUFAs的抗癌机制
改变肿瘤细胞生物膜的结构和功能
PUFAs是构成生物膜的重要成分,膜磷脂中ω-3/ω-6的比例是否恰当直接影响着生物膜的正常活性和生理功能。PUFAs的改变对膜结构、膜流动性及跨膜信号转导途径都有重要的影响。ω-3 PUFAs对生物膜实施调节的可能机制见图14-5-3。此外,ω-3 PUFAs易与肿瘤细胞膜融合,能影响膜表面酶活性、受体表达及改变离子通道功能,因此能够增加药物,尤其是经过扩散的方式进入肿瘤细胞内的疏水性药物向肿瘤细胞内流,并且能够促使药物在细胞内聚集,增加药物浓度,提高药物的细胞毒性作用,增强肿瘤细胞对化疗的敏感性。
增加肿瘤细胞内脂质过氧化物的产生
肿瘤细胞与正常细胞相比,前者内抗氧化酶含量低,细胞抗氧化功能缺陷,随着脂质过氧化产物和自由基的积聚,容易遭受过氧化损伤。ω-3型多不饱和脂肪酸通过诱导脂质过氧化和自由基的产生,影响肿瘤细胞的增殖,但这一过程并不累及正常细胞,因为正常细胞能有效地清除和中和过氧化物和自由基,同时对脂质过氧化产物和自由基具有一定的耐受能力。PUFAs是细胞内脂质过氧化的主要底物,所含不饱和双键越多越容易氧化,产生的过氧化产物和自由基能损伤肿瘤细胞膜,线粒体膜,肿瘤细胞内的蛋白质,甚至DNA,能改变细胞成分或细胞骨架的组装,调节膜转运系统,或抑制聚合酶反应和(或)聚胺合成,从而影响肿瘤细胞的代谢和遗传信息传递,导致代谢障碍,细胞死亡或凋亡。外源性ω-3 PUFAs可与瘤细胞膜融合,通过酶途径(细胞来源的过氧化物酶如COX)和非酶途径(膜脂的自由基打击)产生脂质过氧化产物和活性基团,这些物质能机械性损伤肿瘤细胞膜,导致膜穿孔,引起细胞内蛋白质、氨基酸交联及DNA、RNA共价结合,破坏线粒体脂膜,造成肿瘤细胞多方面的损伤,最终导致细胞死亡。另一方面,自由基还能作用于膜磷脂的其他脂肪酸,引起脂质过氧化连锁反应,形成更多的脂质过氧化产物,增强细胞毒作用。
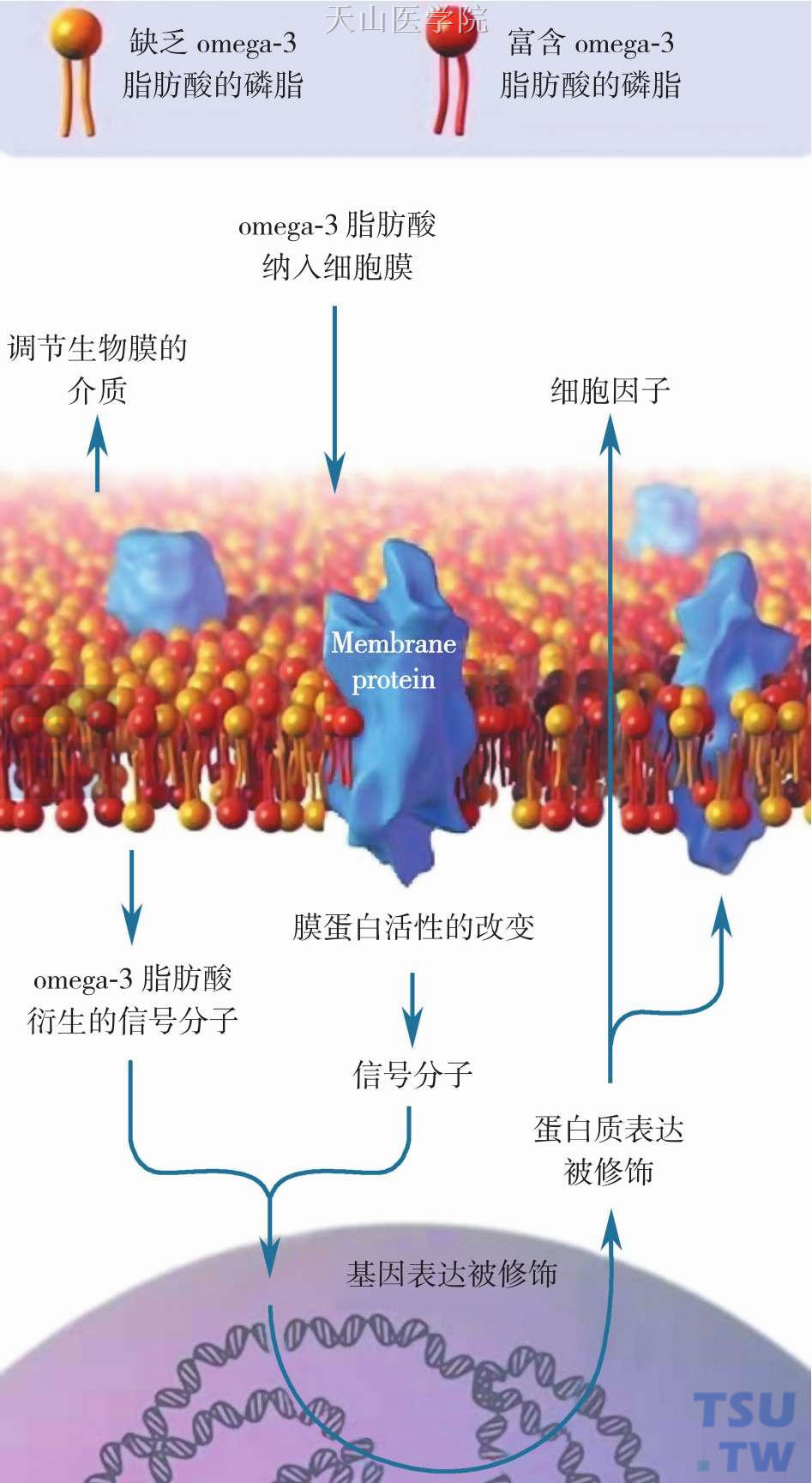
图14-5-3 omega-3脂肪酸通过调节生物膜从而修饰基因的表达、Membrane protein:膜蛋白
导致细胞代谢障碍、促进细胞凋亡
细胞凋亡在肿瘤的发生和生长过程中发挥重要作用。线粒体不仅是细胞呼吸链和氧化磷酸化的场所,也是细胞凋亡的调控中心。外源性ω-3PUFAs通过与线粒体膜磷脂酰基的高度结合力,改变了线粒体膜脂的ω-3/ω-6构成比,导致线粒体膜电位下降,细胞呼吸链和电子传递受损。氧化应激产生的活性氧是细胞凋亡的信使分子和效应分子,可增加对线粒体膜的破坏作用,同时膜表面凋亡调节蛋白Bcl-2家族的表达发生改变,这些因素共同导致线粒体膜转移通透性(permeabilitytransition)孔开放,膜通透性增加,为细胞色素C和凋亡诱导因子的释放、caspase酶解级联反应等凋亡执行过程提供有效的微环境。迄今,已有不少文献都证实,ω-3PUFAs能够调节凋亡相关蛋白在多种肿瘤细胞系内的表达及活性,从而发挥抑制肿瘤细胞增殖的作用。
调节机体免疫系统
ω-3 PUFAs可能通过以下几种机制对机体的免疫系统产生影响。首先,如前所述,ω-3 PUFAs可以融入细胞膜,改变细胞膜成分,改变细胞内的第二信使产生;其次,可以影响类花生酸类物质的合成,此类物质是免疫调节中的重要分子;最后,ω-3 PUFAs可以与细胞内的靶点直接作用,如直接作用于转录因子,而这种作用反过来又可能会改变基因表达。
已有不少研究证实,PUFAs可抑制淋巴细胞增生,抑制自然杀伤细胞的活性和黏附分子的表达,调节免疫反应和炎症因子。类花生酸类物质除了在血小板聚集,细胞生长和分化中起到作用以外,还参与了PUFAs对炎症的调节和对免疫的抑制作用。通常,EPA衍生的类花生四烯酸类物质有抗炎作用,而AA衍生物则有促炎症反应。研究证实,前列腺素E2(prostaglandin E2,PGE2)能够通过抑制巨噬细胞、T细胞、B细胞的功能,激活免疫抑制细胞起到抑制免疫反应的作用,还可以抑制辅助T-1细胞的细胞因子如白介素-2(interleukin-2,IL-2)、γ-干扰素、IL-12的产生,促进辅助T-2细胞的细胞因子如IL-4、IL-5、IL-10的产生。而饮食中高ω-3 PUFAs能够增加炎症性花生四烯酸物质的产生,相反,低ω-3 PUFAs则有相反的作用。因此,ω-3 PUFAs可以通过对花生四烯酸的调节,达到调节免疫和炎症反应的目的。体内试验和体外细胞培养试验表明高剂量的ω-3 PUFA显著降低淋巴细胞增殖,使细胞因子IL-1和IL-2产量下降,降低迟发型过敏反应,且降低抗体生成数量。而低剂量的ω-3 PUFA试验结果往往相反。PUFA与特异免疫功能的这种剂量依赖关系的机制目前不是十分清楚。但可能的机制至少包括:当机体摄入PUFA过多时,免疫细胞膜磷脂中PUFA含量也增加,即膜磷脂不饱和度增加,而膜磷脂是自由基攻击的主要目标,不饱和度的增加导致脂质过氧化作用增强,从而加剧细胞膜的损伤,免疫细胞功能受到影响。
一般来说,肿瘤患者的免疫力较低,而必需脂肪酸缺乏会导致患者免疫功能减弱。外源性适量的ω-3 PUFAs可改善营养不良和术后患者细胞免疫及体液免疫功能,但过量的PUFAs会抑制细胞免疫及单核-吞噬细胞功能。
影响肿瘤细胞的相关基因表达
ω-3 PUFAs可调节肿瘤相关基因的表达,抑制肿瘤细胞的增殖。膳食中ω-6/ω-3的比例不当可能是促使肿瘤发生的重要因素,而PUFAs可以在转录水平和mRNA的稳定性两个方面对肿瘤基因表达进行调节。
ω-3 PUFAs在肿瘤患者中的作用
我国临床常用的脂肪乳多为大豆提取物,其中ω-3脂肪酸的含量较低。考虑到ω-3多不饱和脂肪酸的上述特点,在20世纪90年代末期,学者们开始了肠外使用鱼油脂肪乳的基础与临床研究。国外学者在对健康人群输注富含ω-3的脂肪乳后发现受试者体内的促炎因子,包括肿瘤坏死因子、IL-1、IL-6与IL-8的水平较前下降。Koller等进一步表明,给大手术后的患者连续使用5天富含ω-3的脂肪乳,检测到体内白三烯B5/B4的水平显著增高,提示术后高炎性反应受抑。我国的临床诊疗指南也表明鱼油脂肪乳有助于减少腹部大手术后患者的感染并发症与缩短住院时间。国外学者进行的3项,超过200名受试对象的随机对照研究均表明,给接受胃肠道肿瘤手术的患者,在围术期(术前5天,或术后7~14天)使用富含ω-3的脂肪乳,相比对照组,更有利于抑制机体的炎性反应,促进患者术后康复;并且能增强机体免疫功能,减少感染性并发症的发生率,以及缩短住院时间。一项较大样本的,由我国蒋朱明教授牵头进行的多中心,随机双盲对照研究(N=203),给予消化道肿瘤的患者(N=103)术后提供鱼油脂肪乳[鱼油0.2g/(kg•d),ω-6∶ω-3比值约为3∶1]连续7天,结果显示,治疗组相比单用静脉大豆油脂肪乳的对照组(ω-6∶ω-3比值约为7∶1),术后全身炎症反应综合征的发生率与住院时间显著减少。国内的一项Meta分析报道表明ω-3脂肪乳能显著降低患者术后感染并发症发生率,缩短住院时间。
ω-3 PUFAs在恶液质中的应用
过往的动物实验一致表明,恶液质动物的细胞核内表现为核因子-κB(nuclear factor-kappa B,NF-κB)的聚集,它能增加蛋白质的分解,促进肌管的凋亡。除此以外,泛素-蛋白水解酶途径中的蛋白质水解诱导因子(proteolysis induced factor,PIF)是肿瘤组织分泌的一种物质,同样能加速蛋白质的分解。EPA通过抑制NF-κB的聚集,阻断泛素-蛋白水解酶途径中PIF的表达,以抑制肌肉蛋白质的分解,缓解恶液质的症状。
细胞膜富含脂肪酸,检测细胞(红细胞、中性粒细胞)膜脂肪酸的比例通常用于评价机体近期或长期脂肪酸摄入的情况。有研究指出,进展期的肿瘤患者血浆磷脂中脂肪酸含量低于正常值的30%。这部分患者体内EPA含量低于同年龄的正常人,他们的生存期显著缩短(大概缩短8个月)。此外,学者们发现,在肿瘤恶液质的患者中,肌肉减少与EPA、DHA浓度降低呈正相关。针对体内EPA、DHA水平降低的肿瘤恶液质患者,给予补充ω-3 PUFAs具有增加体重,阻止肌肉分解的作用。肿瘤患者在接受化疗前,细胞膜ω-3 PUFAs浓度减少者,相比ω-3 PUFAs浓度正常者,表现为肌肉分解加速,化疗过程明显的毒副作用,治疗时间延长,化疗药物剂量难以达到推荐用量等。因此,在患者使用化疗药物同时补充ω-3 PUFAs制剂,利用CT的方法准确检测体内脂肪与肌肉含量,结果表明,患者肌肉含量相比对照组显著增加。部分小样本随机对照研究同样显示ω-3 PUFAs制剂不仅与大部分的化疗药物呈协同增强的作用,还能减轻化疗药物带来的不良反应。部分研究认为ω-3 PUFAs制剂能阻止肿瘤恶液质患者肌肉分解,减少化疗药物的毒副作用,增加肿瘤组织对化疗药物的敏感性,同时不会促进肿瘤的生长等作用。
Fearon等进行的一项较大样本的(518名受试者被随机分为3组)随机对照研究,额外补充EPA2g-4g(2g EPA,n=175,4g EPA,n=172,对照组,n=171),干预时间为8周。结果显示,补充4g EPA组体重相比对照组,平均增加0.3kg。补充2g EPA组相比对照组,体重平均增加1.2kg。然而,3组间在总体重、去脂体重、卡氏评分、生存率等指标未见有显著差异。
截至2010年,国外共有4篇Cochrane review报道有关ω-3 PUFAs对肿瘤恶液质的影响,评价终点包括患者的体重变化、食欲改善、生活质量等。其中,Dewey等发表在2007年的报道与Mazzotta等在2009年发表的报道均否定了ω-3 PUFAs对恶液质患者的积极作用,尤其在体重方面未见改善。然而,Colomer等在2007年发表的系统综述却指出,给患者补充EPA与DHA 1500mg/d,持续8周才能起到增加体重,改善食欲与生活质量的作用。Ries A等最近发表的文章囊括了6项高质量的空白对照组的RCT研究,3项对照组为其他药物,8项无对照组的研究。研究方法通常是通过外源性补充EPA的剂量在1.1~12g之间,观察时间为期2~8周。最终的结论是,报道ω-3 PUFAs改善肿瘤恶液质的研究均为设计存在缺陷,样本量小的研究。目前的数据尚未能明确ω-3 PUFAs具有增加体重、改善食欲、提高生活质量的作用。但是,针对围术期的肿瘤患者,它确实能减轻体内炎症反应,促进伤口愈合(图14-5-4)。
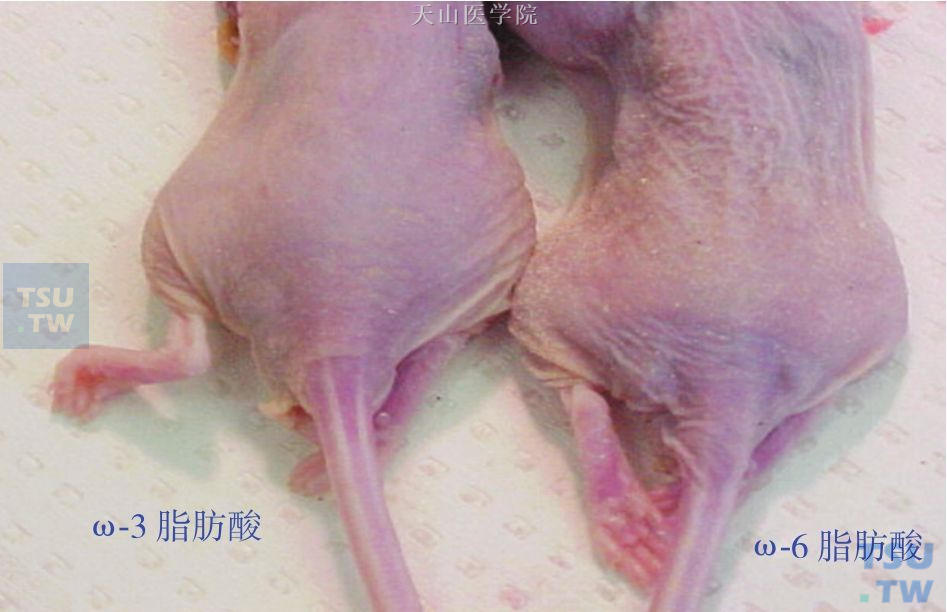
图14-5-4 动物实验提示ω-3脂肪酸具有改善恶病质的作用
ω-3 PUFAs的安全剂量与副作用
关于临床应用ω-3 PUFAs的安全剂量,各项研究报道不一。4项超过71名受试者的研究显示,患者能耐受的鱼油平均剂量高达12g/d(相当于EPA 2g/d),持续时间长达12周。后续还有学者报道,患者能耐受EPA剂量高达6~18g/d[相当于0.1~0.3g/(kg•d)]。而且,关于ω-3 PUFAs的副作用鲜少报道。基本上为消化系统症状,如腹胀、恶心、呕吐、腹泻、一过性的腹部绞痛等。报道最严重的一例出现严重的感觉异常症状。总的来说,ω-3PUFAs补充剂还是比较安全的。
结语
PUFAs是细胞膜的重要组成成分,在细胞内发挥着重要作用。我国蒋朱明教授牵头进行的研究表明,富含ω-3 PUFAs的鱼油脂肪乳有助于降低接受手术的肿瘤患者的感染并发症发生率,缩短住院时间。然而,对于肿瘤恶液质患者的干预研究却显示出截然不同的结果,考虑与纳入研究对象所处的肿瘤分期,干预的时期,患者的依从性,不同的膳食摄入的监测手段,研究终点(如体重、去脂体重受水肿,放、化疗治疗的干扰)等多因素不相一致有关。Anke等于2012年发表的系统综述的结论是,就目前的证据,尚未能明确ω-3 PUFAs能使恶液质患者获益。今后仍需设计更为合理的大样本的随机双盲对照研究提供更多的依据。(杨婷 区俊文 石汉平)
