病例与思考
患者,男,45岁,因“左侧阴囊皮肤癌”入院。于泌尿外科接受手术,术后病理证实为“皮肤外分泌腺癌,Ki-67(+)”,腹部MRI发现腹腔多枚淋巴结转移。术后给予紫杉醇、顺铂、甲氨蝶呤、吉西他滨等方案化疗(具体方案此处不赘述)。化疗期间出现口腔溃疡,恶心、呕吐,食欲下降(自诉每日勉强进食1碗瘦肉粥),全身乏力,双下肢水肿。患者身高1.66m,化疗前体重58kg,化疗期间体重减轻5kg。
- 该患者是否需要进行营养支持治疗?
- 目前指南中推荐改善食欲的方法有哪些?
- 谷氨酰胺补充剂能否令该患者获益?推荐的使用方法与剂量如何?
谷氨酰胺(glutamine,Gln)作为一种组成蛋白质的氨基酸,由于它能利用谷氨酸和氨自身合成,不需要额外补充就能满足机体的需要,而一直被认为是“非必需的氨基酸”。过去的很长一段时间,人们并没有认识到它的重要性。直到20世纪70年代,美国国立卫生研究所的学者发现谷氨酰胺而非葡萄糖才是消化道重要的供能物质后,对它的研究才逐渐被重视起来。到了20世纪80年代,越来越多的学者发现谷氨酰胺在分解代谢状态下,如:大手术后、肿瘤、烧伤、创伤、脓毒血症等情况下消耗量加大,超过了机体自身的合成能力,导致肌肉组织的减少,从而重新将其划分为“条件必需氨基酸”。在最近的十多年,国内、外学者对谷氨酰胺在外科、危重症、肿瘤等领域进行了大量的动物实验及随机对照试验,并获得了令人鼓舞的结果,使谷氨酰胺在营养学界成为了炙手可热的研究题材。
谷氨酰胺在体内的代谢情况
谷氨酰胺在血液中的浓度为8.3mg/dl,在所有氨基酸中含量最高。它广泛存在于骨骼肌、肝脏、大脑与血液中。这些组织中含有谷氨酰胺合成酶(glutamine synthetase,GS)与谷氨酰胺酶(glutaminase,GA),前者通过催化氨与谷氨酸合成谷氨酰胺。后者存在于线粒体内膜,是肿瘤细胞利用Gln时的起始酶和关键酶。能将谷氨酰胺水解为氨与谷氨酸,这个过程是不可逆的(图14-6-1)。
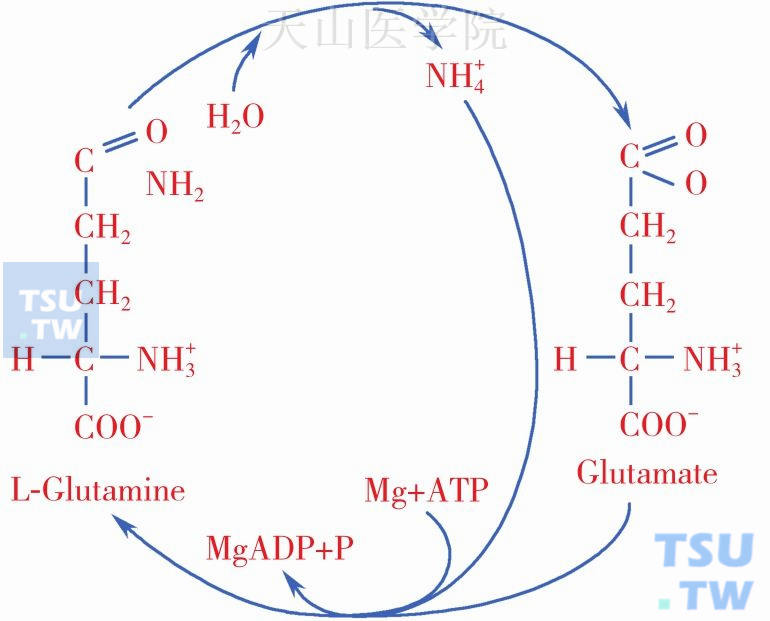
图14-6-1 谷氨酰胺合成酶(Glutamine Synthetase,GS)催化氨与谷氨酸合成谷氨酰胺,这个过程需要消耗ATP。谷氨酰胺酶(Glutaminase,GA)能催化谷氨酰胺水解为氨与谷氨酸
通过上述两种酶的作用,由蛋白质代谢产生的有毒性的氨可以被固定在无毒的谷氨酰胺中,通过血液输送至肝脏,在谷氨酰胺酶的作用下水解为氨,在肝脏内合成尿素,最终通过肾脏排泄,防止机体氨中毒。谷氨酰胺的特别之处在于它含有两个氮原子。因此,它承担了30%的“氮源运载体”的工作,将肌肉中的氮源转运至各个器官;同时,它为蛋白质、嘌呤、嘧啶这类生物分子提供合成原料;它还是尿素和氨合成的主要物质;并能减弱胰岛素的抵抗性;它还是蛋白质代谢的调节因子,促进其合成,减少其分解;为体内快速增殖细胞如肠上皮细胞、淋巴细胞、成纤维细胞和肿瘤细胞提供能量;并且促进体内主要的抗氧化剂谷胱甘肽的合成。因此,它在维持机体肠道黏膜屏障功能,提高机体免疫功能,维持体内酸碱平衡,以及提高机体对应激的适应能力等方面都起到重要的作用。
谷氨酰胺在荷瘤状态下的代谢特点
由于肿瘤细胞偏嗜谷氨酰胺(图14-6-2),所以它在荷瘤宿主体内的代谢方式有所改变。针对荷瘤大鼠骨骼肌内谷氨酰胺代谢情况的研究提示,患肿瘤一侧的大腿肌肉内谷氨酰胺的浓度增高,健侧腿肌肉内谷氨酰胺的浓度降低。Quessada等进行的一项研究表明,在荷瘤早期,宿主血液中谷氨酰胺的浓度增高,随着荷瘤时间的延长以及肿瘤体积的逐渐增大,谷氨酰胺的浓度会逐渐下降。这是机体为了维持血液内谷氨酰胺浓度的一个调节机制。当肿瘤组织占总体重的10%时,肌肉中谷氨酰胺的浓度大约下降20%。机体为了维持血液中的浓度,除了加速释放肌肉中的谷氨酰胺以外,还通过上调肌肉组织中谷氨酰胺合成酶的活性来满足肿瘤的需要。Collins等研究人乳腺癌细胞在急性与慢性Gln缺乏的不同情况下谷氨酰胺合成酶的变化,结果表明,急性缺乏的情况下,谷氨酰胺合成酶水平增高,但谷氨酰胺合成酶mRNA水平没变化。在慢性缺乏的情况下,两者的水平均增高,提示谷氨酰胺合成酶蛋白上调是机体对慢性疾病尤其是荷瘤状态下的一种适应性的改变。在疾病晚期,肌肉内谷氨酰胺接近耗竭,有学者认为,这是引发肿瘤恶液质的重要原因之一。肌肉中的谷氨酰胺远不能满足肿瘤的需求,它开始转向小肠撷取。此时测得肠道摄取谷氨酰胺的速度降低,除了与维持血液中的浓度有关,还与肠黏膜谷氨酰胺酶活性降低有关。随着肿瘤的进展,肠上皮细胞内谷氨酰胺浓度逐步降低,最终破坏肠道黏膜屏障的功能,导致肠道黏膜通透性增加,宿主发生感染的机会增加。同样地,当肠道内谷氨酰胺消耗殆尽时,肿瘤组织转而瞄上了肝脏内的谷氨酰胺。Chen等通过测定肝脏谷氨酰胺酶与谷氨酰胺合成酶的活性,了解谷氨酰胺在荷瘤宿主中肝脏代谢的变化。实验动物在皮下纤维瘤种植后2~3周,肿瘤的重量分别占总体重的5%与20%的时候,肝脏谷氨酰胺酶活性开始下降,谷氨酰胺合成酶的活性逐渐增加。与此同时,早期的肝脏内谷氨酰胺的水平表现为增高,随着荷瘤时间的延长,表现为降低,而动脉血中的谷氨酰胺含量也逐渐降低。肝脏通过上调GS/GA的比例,使其对谷氨酰胺从净摄取转变为净释放,以满足肿瘤生长的需求。
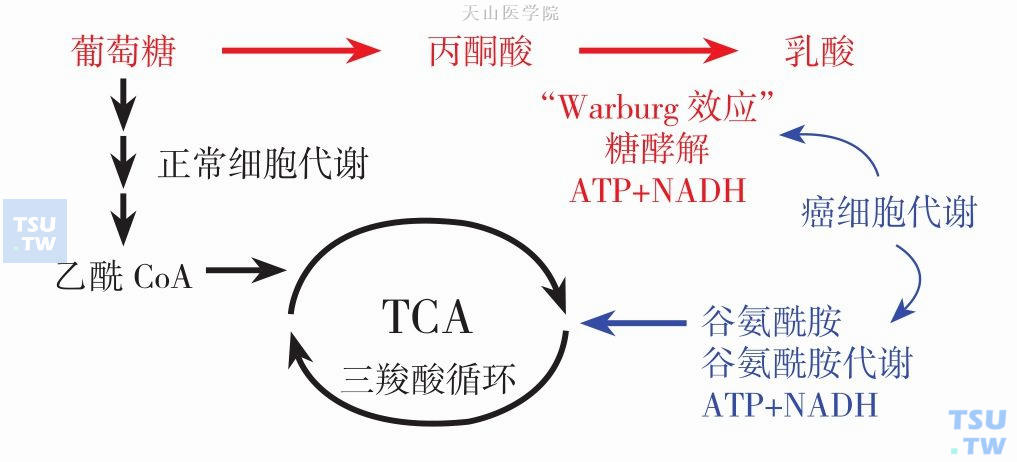
图14-6-2 谷氨酰胺在癌细胞中的代谢
归纳起来,荷瘤宿主中谷氨酰胺的代谢顺序是:首先动用肌肉内的谷氨酰胺,通过加速其释放及上调谷氨酰胺合成酶的活性以维持血液中的浓度,当肌肉中的谷氨酰胺接近耗竭时,开始转向小肠撷取,最后通过肝脏的净释放以维持血液中的浓度,随着病程的进展,荷瘤动物最终死于谷氨酰胺缺乏引起的并发症。
有学者提出谷氨酰胺在荷瘤宿主中的代谢应该有中间介质的参与。荷瘤宿主中细胞因子的浓度较高,Durick等发现荷肝癌大鼠谷氨酰胺的转运速度较快。Souba等发现荷瘤大鼠注射肿瘤坏死因子的抗体之后,肝脏内谷氨酰胺转运的速度明显降低。Pacitti等给健康大鼠注射肿瘤坏死因子以后,肝脏内谷氨酰胺的转运速度明显提高。提示谷氨酰胺的代谢可能有中间介质的参与。
谷氨酰胺对免疫功能的影响
谷氨酰胺在免疫系统细胞中利用率很高,由于它在代谢过程中会产生还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH),而免疫细胞的功能活性如细胞增殖、抗原呈递、产生一氧化氮和过氧化物、吞噬作用、合成分泌细胞因子等都依赖NADPH,所以谷氨酰胺是免疫细胞快速增长的能量来源。除此以外,当谷氨酰胺与还原型谷胱甘肽(reduced glutathione,GSH)浓度降低时,会下调NK细胞的活性,导致肿瘤组织迅速增长。Klimberg等在一项针对荷MCF-7肿瘤的大鼠研究中发现,在谷氨酰胺强化组使用7周后[1g/(kg•d)],肿瘤生长速度减慢约40%。此结果与谷氨酰胺显著增强NK细胞的活性(相比对照组增高2.5倍),同时提高GSH的浓度(相比对照组增高25%),抑制前列腺素E2的分泌有关。除此以外,国内学者报道了结直肠癌患者术后使用谷氨酰胺强化的肠外营养支持7天以后CD4、CD4/CD8、NK细胞、IL-2R等免疫指标较对照组明显改善。代永霞等对胃肠道肿瘤患者术后提供富含谷氨酰胺的肠外营养支持,发现肿瘤患者的IgG、IgM、IgA较对照组明显升高,提示谷氨酰胺能改善患者的免疫功能。
谷氨酰胺在围术期与化疗期间的应用
Oquz等报道的一项随机对照研究显示:109名准备接受手术的结肠癌患者被随机分为两组,治疗组在手术前5天与手术后5天接受肠外营养液,并添加谷氨酰胺[1g/(kg•d)],两组在手术前、后5天均给予肠内营养支持。结果提示谷氨酰胺能减少术后的并发症,并且缩短住院时间。
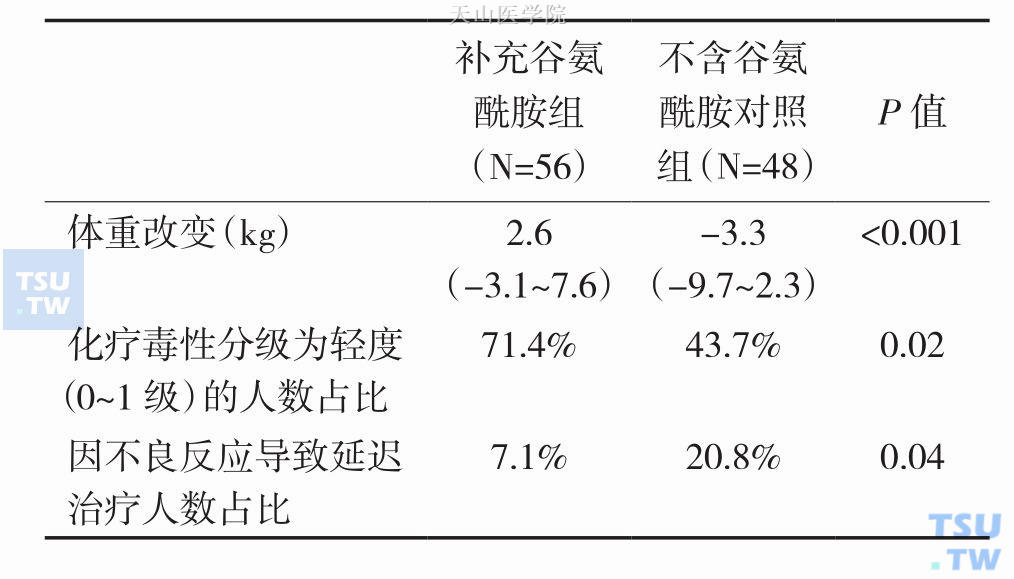
另一项报道指出,肿瘤患者在给予第二周期化疗的同时每天口服8g谷氨酰胺混悬液,持续28天,口腔黏膜的损伤程度相比第一周期化疗时明显减轻(毒性作用分级从2级降至0.5级)。一项最近的关于非小细胞肺癌的随机对照研究,治疗组在接受同步放化疗的同时,每天补充谷氨酰胺30g,补充时间从放疗前一周开始,持续至放疗结束后两周。结果表明,治疗组的急性放射性食管炎发生率显著低于对照组(7.2% vs. 16.7%,P=0.02);体重减轻发生率较低(44.6% vs. 72.9%,P=0.02)(表14-6-1),因不良反应被迫中断治疗的发生率明显低于对照组(7.1% vs. 20.8%,P=0.04)。而且,未见有促进肿瘤生长的情况发生。然而,各组间的生存期没有显著差异。
表14-6-1 额外补充谷氨酰胺对接受同步放化疗患者的影响
Anderson等进行的一项随机双盲对照试验,将193名需要接受骨髓移植的患者随机分为两组,治疗组口服1g/m2的谷氨酰胺,每天4次;对照组口服亮氨酸,持续28天,结果显示谷氨酰胺能降低自体骨髓移植患者口腔黏膜炎症的疼痛感,缩短疼痛时间;然而对接受同种异基因骨髓移植的患者作用不明显。Daniel等对70名患结肠癌并接受氟尿嘧啶与甲酰四氢叶酸联合化疗的患者随机分为两组,治疗组在化疗前5天就口服给予剂量为18g/d的谷氨酰胺,持续使用15天,观察两组患者的肠道吸收功能及肠黏膜通透性的改变。结果显示谷氨酰胺能降低由化疗药物引起的肠黏膜通透性,改善肠道的吸收功能,并减少化疗药引起的腹泻次数。
化疗药物的毒副作用除了上述提到的消化道黏膜炎以外,常常还伴随着周围神经毒性反应,表现为肢端麻木、刺痛、感觉异常、感觉迟钝。部分研究报道额外补充GLN能减轻化疗药物对周围神经的毒性作用。Wang等对转移性结直肠癌患者使用化疗的同时提供谷氨酰胺(30g/d,口服),发现它能减轻由奥沙利铂引起的周围神经毒性,并且不干扰化疗药物的治疗作用。Vahdat等表明对接受紫杉醇化疗的乳腺癌患者同时给予口服谷氨酰胺(30g/d,连续使用4天),发现它能明显改善患者肢端麻木及感觉异常的症状。同样地,Stubblefield也获得相似的结论,谷氨酰胺能减轻由紫杉醇引起的肢端无力、感觉异常及足趾麻木等症状。
谷氨酰胺减轻放、化疗引起的肠黏膜屏障功能损伤,可能的作用机制为下表所示(表14-6-2)。
表14-6-2 谷氨酰胺减轻放、化疗引起的肠黏膜屏障功能损伤的作用机制

谷氨酰胺在恶液质中的作用
早期的一项随机对照研究,给Ⅳ期肿瘤患者补充HMB(3g/d)、精氨酸(14g/d)和谷氨酰胺(14g/d)持续4周,体重及瘦体重相比对照组显著增加。体重在24周时仍能继续保持。由Rathmacher等发表的一篇报道指出,针对罹患HIV/AIDS、肿瘤并伴随体重减轻的患者,每天补充含有3g HMB、14g精氨酸,与14g谷氨酰胺的混合制剂。相比对照组,治疗组患者感觉乏力减轻,红细胞计数、血红蛋白、淋巴细胞计数显著增高。未见异常反应。然而,另外的部分研究未能获得与上述一致的结果。作者给类风湿关节炎导致的恶液质患者,口服补充HMB/谷氨酰胺/精氨酸的混合补充剂,结果发现体重、上肢与下肢的肌肉重量的变化在两组间无显著差异。2008年的一项超过400名进展期恶性肿瘤患者(体重减轻在2%~10%范围内)的研究,给予试验组补充含有HMB、谷氨酰胺及精氨酸的混合氨基酸制剂,每天2次,持续使用8周,最终也未能发现两组有显著差异。
上述研究结论不一考虑有以下几个原因,研究对象虽然都是恶液质患者,但是基础疾病不同,因此接受的基础治疗多种多样;不同的研究使用GLN的剂量不同;持续使用的时间不同;使用的时机不同等多种因素均会影响研究的结果。因此,关于谷氨酰胺在恶液质患者中是否具有积极作用,目前尚未有明确的结论。
小结
目前看来,大部分研究支持GLN能减轻放、化疗的毒副作用,如减轻消化道黏膜损伤,维持肠黏膜屏障功能,增强小肠绒毛及隐窝结构功能,增强细胞免疫功能等。而且,目前的临床报道并未发现它会促进肿瘤组织的生长。ESPEN对非手术治疗的肿瘤患者的肠外营养支持指南指出,对于需要接受造血干细胞移植的患者,使用添加GLN[补充剂量:0.6g/(kg•d)]的肠外营养可能使肿瘤患者获益。然而,关于谷氨酰胺对恶液质患者的影响,目前仍存有争议,仍需更多设计合理的大样本研究提供依据。(区俊文)
