Myostatin的受体:Myostatin的信号转导类似于TGF-β超家族中的TGF-β家族成员(TGF-β1、TGF-β2和TGF-β3),是由两种不同类型(Ⅰ型和Ⅱ型)丝氨酸/苏氨酸激酶受体介导的。利用纯化的重组myostatin蛋白进行交联的研究结果表明,myostatin 在体外条件下能够同活化素Ⅱ型受体A (activin receptor type ⅡA,ActRⅡA)和活化素Ⅱ型受体B(activin receptor typeⅡB,ActRⅡB)结合,但myostatin同ActRⅡB结合得更多且更强。ActRⅡB 在myostatin信号转导中的作用也得到了体内实验的进一步支持。过量表达显性负ActRⅡB 的转基因小鼠,其肌肉重量的增加比剔除myostatin基因的小鼠还要多。利用ActRⅡB和单个的Ⅰ型受体共转染细胞进行交联的研究结果表明,myostatin能够在体外条件下同TGF-βⅠ型受体(TGF-β receptor type Ⅰ,TβRⅠ/ALK5)和活化素Ⅰ型受体B (activin receptor type ⅠB,ActRⅠB/ALK4)结合。但与ActRⅡB不同的是,目前仍然没有遗传学的证据能够证明TβRⅠ或ActRⅠB 参与介导myostatin 的信号转导。
TGF-β超家族由一大类具有共同结构特征的细胞因子组成,在细胞生长和分化、物质代谢等方面都有极其重要的作用。近年来发现TGF-β信号通路涉及Ser/Thr蛋白激酶受体家族和Smads家族。TGF-β超家族成员作为配体与受体结合形成复合物并激活R-Smads,R-Smads再与Co-Smads结合进入细胞核,通过识别不同的Smads结合蛋白并形成复合体,从而调控不同靶基因的特异性表达,最终实现TGF-β多种生物学效应。
Myostatin作为TGF-β超家族的一员,与其他家族成员分享Ⅱ型B类的Activin受体,以及Ⅰ型的TGF-β受体。与TGF-β激活受体的途径类似,Myostatin也能够激活其受体,并磷酸化下游的Smad2/3,与Smad4结合后转入细胞核,调控靶基因的表达,并且Smad7也在其中起负调控的作用。与TNF-α不同,Myostatin单独通过NF-κB途径诱导恶液质,提高Myostatin水平,可调低pax3和MyoD的表达水平,以阻断肌细胞生成。此外,Myostatin通过抑制PI3K/Akt信号通路使Foxo1磷酸化以调高泛素-蛋白酶系水平(图2-13-2)。
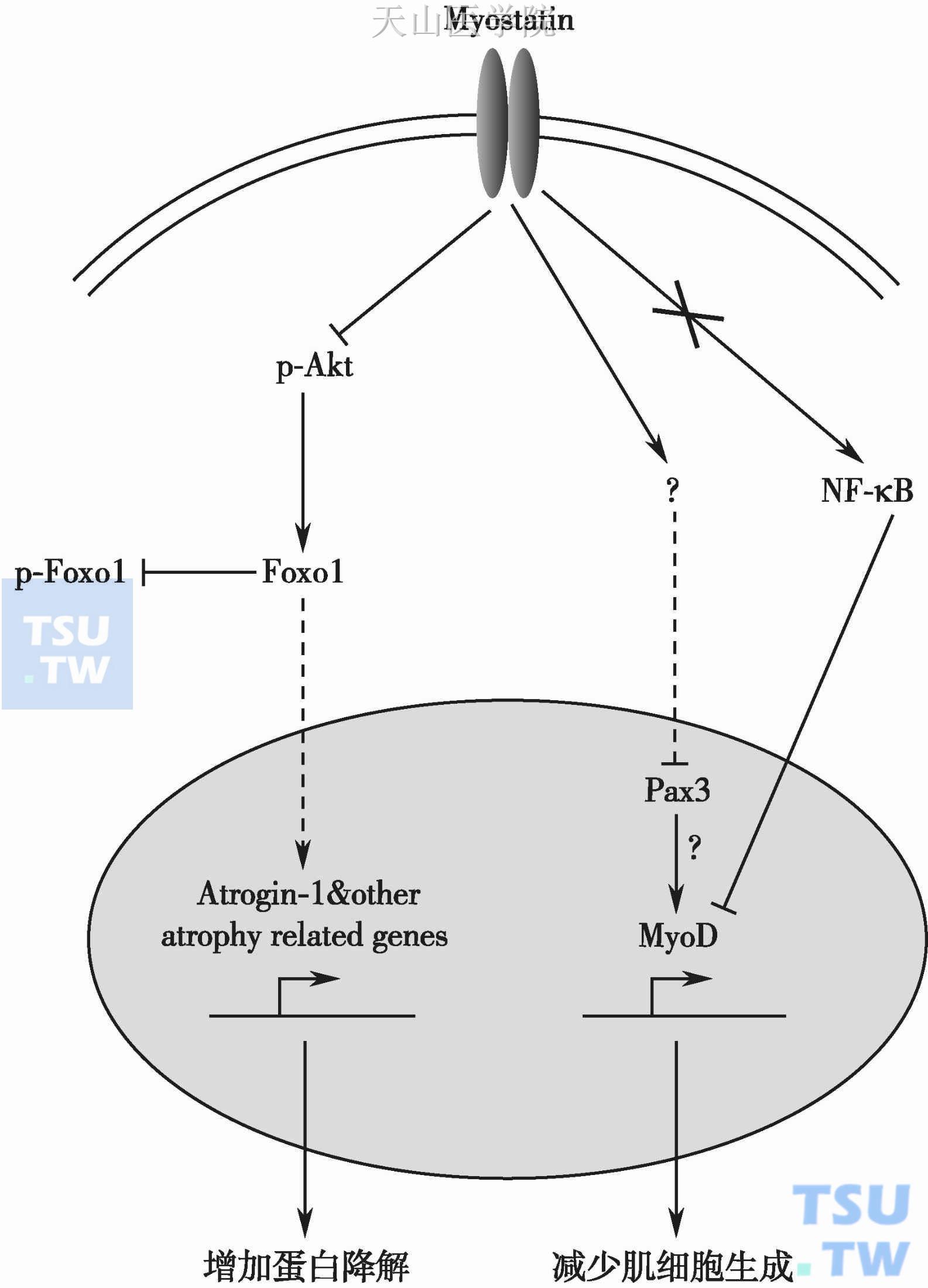
图2-13-2 Myostatin诱发恶液质的机制示意图(虚线表示核易位,箭头表示激活,钝头表示抑制)
Myostatin通过激活Erk1/2抑制成肌细胞分化。Myostatin可以通过ActRllB激活Ras,及其下游的Erk1/2,Erk1/2的抑制剂PD98059能够解除Myostatin对细胞分化的抑制作用。至于Myostatin激活Ras的机制还有待于进一步的研究。Philip等人的研究证明Myostatin能够激活MAPK-p38,这种激活不依赖于Smad,而是通过与TGF-β非常相似的TAK1-MKK6途径完成的。并且激活的p38对于Myostatin下游的靶基因的转录有促进作用。p38的底物ATF被p38激活后能够与Smad3/4形成复合物。另外,p38的激活还能够促进Myostatin上调p21并导致细胞周期阻滞(图2-13-3)。
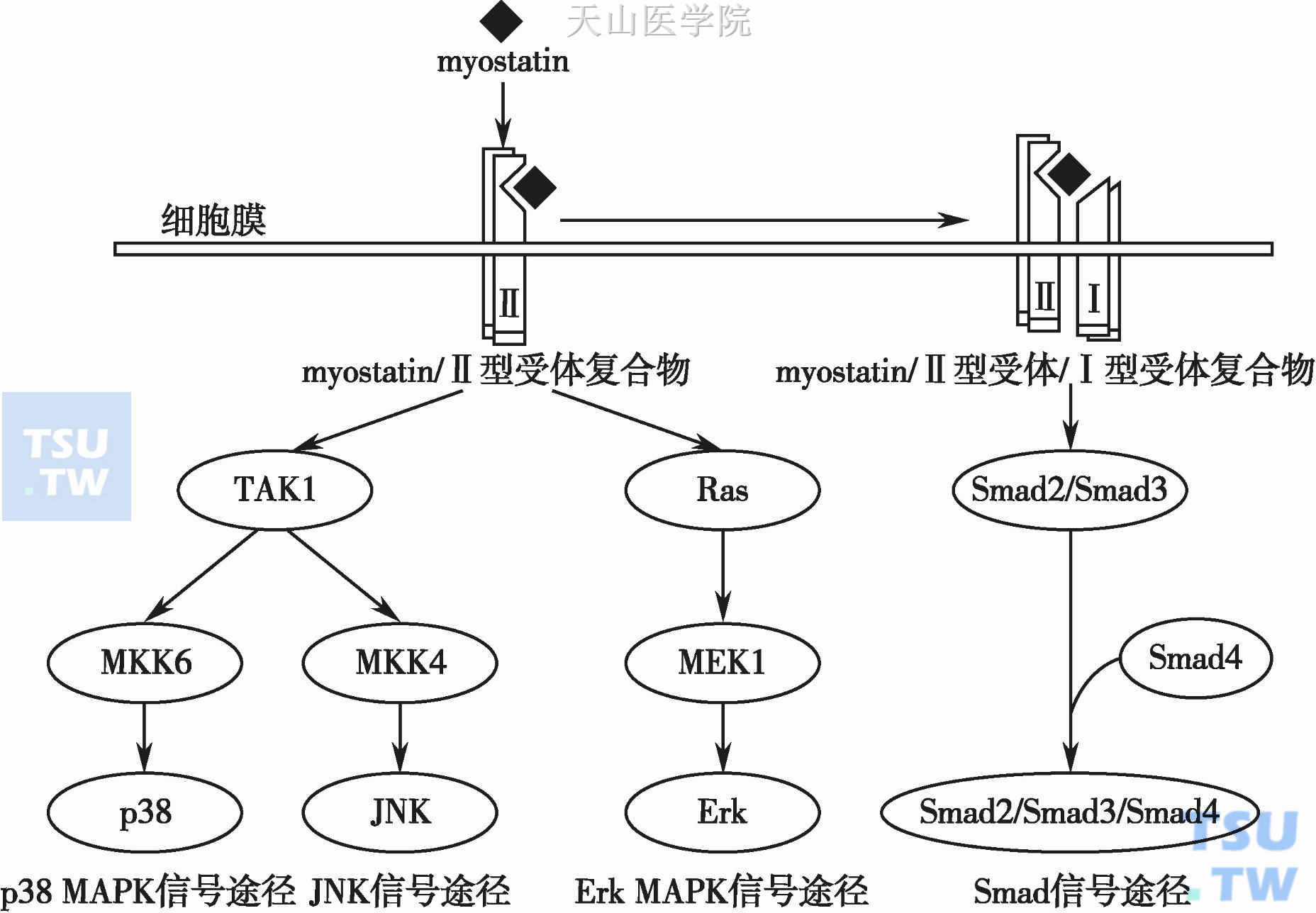
图2-13-3 Myostatin的信号途径
